HIV-1 CAP2NC蛋白的表达及体外自组装
白诗梦,张芝晴,乔佳明,沈鸿霖,黄芳,高双全,李少勇,李少伟,,夏宁邵,,顾颖,
1厦门大学 生命科学学院 国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102
2厦门大学 公共卫生学院 分子疫苗学和分子诊断学国家重点实验室,福建 厦门 361102
人类免疫缺陷病毒Ⅰ型 (HIV-1)gag基因所编码的55 kDa蛋白是该病毒主要的结构蛋白。所有逆转录病毒的Gag蛋白包含N末端的膜结合MA(基质蛋白)区域、CA(衣壳蛋白)以及临近Gag蛋白C末端的RNA结合的核壳体 (NC)区域[1]。而衣壳蛋白 (CA)在HIV病毒的组装和成熟过程中起着至关重要的作用[2]。
一个具有感染性的HIV病毒粒子的组装是分为两个阶段进行的[3]。首先Gag蛋白在质膜表面发生寡聚化,随后与膜分离释放出一个非成熟形式的非感染性的颗粒。在组装的第二个阶段,蛋白酶被激活后,水解Gag前体蛋白为各个成熟的结构蛋白。酶切导致病毒颗粒内部发生结构重排,从而使病毒粒子从非成熟形式重组为成熟的具有感染性的颗粒。其中蛋白酶水解导致的病毒颗粒的成熟是抗逆转录病毒药物的一个重要靶点[4]。因此非成熟病毒颗粒的形成是HIV-1组装的一个关键阶段。
目前,人们对HIV病毒的整体结构有了清晰的认识,并且随着结构生物学与生物信息学的迅猛发展,近年来对成熟的HIV-1病毒颗粒的结构蛋白进行了大量高分辨的结构解析,但对非成熟病毒颗粒结构了解较少。病毒颗粒的组装和感染性粒子的形成是一个十分复杂的过程,弄清这一过程,有助于抗病毒药物及疫苗的研制[4-6],可以为人类提供一个研究预防和治疗HIV感染的新途径。相关研究借助纯化后重组的部分Gag蛋白——CAP2NC蛋白模拟非成熟病毒颗粒体外自组装系统[7-9],用来探索逆转录病毒生活周期中发生的形态变化[10]。
本研究利用大肠杆菌表达系统得到大量可溶的CAP2NC蛋白,并对表达的CAP2NC蛋白反应活性、体外组装特性等进行分析,探索其体外自组装条件,为进一步解析该蛋白结构并深入研究非成熟病毒样颗粒提供了原料。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及质粒
E.coliBL21(DE3)菌株由本实验室保存;NL4-3质粒及克隆表达载体pTO-T7质粒为本实验室保存[11];单抗A10F9、13E11、12G4均由本实验室保存。
1.1.2 主要试剂
DNA marker为TaKaRa公司产品;质粒抽提试剂盒和PCR产物纯化试剂盒为TIANGEN公司产品;苯甲基磺酰氟PMSF蛋白酶抑制剂为上海碧云天公司产品;Super Signal Western化学发光底物为PIERCE公司产品;限制性内切酶、TaqDNA聚合酶和T4 DNA连接酶为TaKaRa公司产品;MES购自SIGMA-ALDRICH;辣根过氧化物酶标记的二抗由本实验室生产;Phenyl agarose Fast Flow疏水层析介质填料购自美国GE healthcare公司。
1.2 方法
1.2.1 原核表达载体的构建
根据 HIV-1 NL4-3 CAP2NC基因序列设计一对特异性引物,上游引物:5′-TAACTTAAGAAGG AGATATACATATGCCTATAGTGCAGAACCTCC AG-3′和下游引物:5′-GTGGTGGCTCGAGGCGG CCGCAAGCTTATTAGCCTGTCTCTCAGTACAA T-3′(下划线为NdeⅠ和HindⅢ酶切位点),由生工生物工程 (上海)股份有限公司合成。以NL4-3质粒为模板,用合成引物进行PCR扩增。扩增产物经1.5%琼脂糖凝胶电泳分析,并按照DNA凝胶电泳回收试剂盒说明书操作,切胶回收目的基因片段。用限制性内切酶NdeⅠ和HindⅢ双酶切pTO-T7载体,酶切产物经回收并纯化后用本实验构建的Gibsen装配液进行载体与目的片段的连接,构建pTO-T7-CAP2NC表达载体,并转化大肠杆菌DH5α感受态细胞,挑取单个阳性克隆,PCR扩增鉴定重组质粒,并由本实验室内部进行测序验证其正确性。
1.2.2 CAP2NC蛋白理化性质分析
利用瑞士生物信息学研究所的蛋白分析专家系统 (Expert Protein Analysis System,ExPASy)提供的生物信息学工具Protparam,分析预测蛋白质的氨基酸残基性质、分子量、亲水性强弱及理论等电点。
1.2.3 CAP2NC蛋白的纯化与鉴定
将测序正确的表达质粒转化BL21(DE3)感受态细胞,挑单克隆接种于LB培养液,37℃振荡培养过夜,按1%接种到相同的LB培养液中,37℃振荡培养至OD600约为0.9时,加入终浓度为0.8 mmol/L的IPTG,37℃振荡培养,诱导4 h后,7000×g离心10 min收集菌体。菌体沉淀重悬于破菌缓冲液 (50 mmol/L Tris-HCl,1 mmol/L EDTA,1 mol/L NaCl,10 mmol/L DTT,1 mmol/L PMSF,10%(V/V)甘油,pH 8.0),在冰浴下超声破菌。破菌液4℃、25000×g离心20 min,收集上清部分。
离心后的上清加0.5%(V/V)饱和硫铵后进样至以5倍柱体积的A液 (50 mmol/L Tris-HCl,1 mmol/L EDTA,1 mol/L NaCl,10 mmol/L DTT,1 mmol/L PMSF,10%(V/V)饱和硫铵,pH 8.0)平衡的Phenyl-Sepharose FF疏水层析柱,2 mL/min流速上样,用B液 (20 mmol/LMes(pH 6.0),20 mmol/L DTT,1 mmol/L PMSF)进行阶段洗脱,分段收集目的峰。进行SDS-PAGE和蛋白质印迹鉴定 (一抗为 A10F9[12])。
1.2.4 CAP2NC蛋白与抗p24抗体结合反应活性的检测
以纯化的CAP2NC蛋白包被96孔ELISA板,100 ng/孔,以1×CB(pH 9.6的碳酸盐缓冲液)作为稀释液,4℃过夜。以5%的脱脂牛奶37℃封闭 2 h,180 μL/孔。抗 p24 mAb 用样品稀释液 (含蔗糖,酪蛋白,小牛血清等)稀释到100 ng/mL,按照2倍比从高到底进行梯度稀释,共12个梯度,100 μL/孔,37 ℃反应1 h,以TBST洗5遍,加入1∶5000稀释的羊抗鼠二抗 GAM-HRP。37℃反应30 min后,TBST洗5遍,甩干后以1∶1加入TMB底物显色液A液和B液,100 μL/孔,37℃反应10 min。加终止液 (2 mol/L H2SO4)终止反应,50 μL/孔,测定波长为 450–630 nm 的吸光值。
1.2.5 CAP2NC蛋白体外组装特性分析
为监测目的蛋白的组装特性,首先通过颗粒分析实验,将纯化后的不同浓度的目的蛋白透析到50 mmol/L TB 8.0+0.1 mol/L NaCl缓冲液中,并且在透析之前于样品中加入一定浓度 (W/W)的Yeast-RNA,于室温下透析16 h后,将样品进行高速离心 (13000×g,30 min)。将组装的颗粒样品与未组装的分离,分别取上清和沉淀进行非还原性和还原性SDS-PAGE,考染后观察蛋白体外自组装情况[13]。
1.2.6 凝胶过滤层析分析
根据透析后的蛋白样品非还原SDS-PAGE结果,选取可以自组装的蛋白样品进行分子筛排阻层析分析:利用TSK-Gel PW5000(8 mm×300 mm)层析柱,以0.5 mL/min的流速将待测样品通过层析介质,并记录样品中各组分的吸收峰情况。
1.2.7 透射电子显微镜观察
将0.1 mg/mL透析后的蛋白样品吸附于镀炭的铜网上10 min,用滤纸从边缘小心吸去样品残液,再将样品用2%磷钨酸溶液 (pH 7.0)负染15 min,再次吸去残液,在白炽灯下照射待其完全干燥。使用Tecnai G2 Spirit透射电镜 (美国FEI公司)进行观察。
2 结果
2.1 重组表达载体的构建
将经PCR扩增纯化回收后的目的片段连接NdeⅠ和HindⅢ双酶切后的pTO-T7载体,构建CAP2NC重组质粒pTO-T7-CAP2NC,将测序正确的表达质粒用于后续纯化实验。
2.2 CAP2NC蛋白的纯化与鉴定
利用ProtParam工具预测表明CAP2NC蛋白理论等电点 (pI值)9.09,亲水性平均系数 (GRAVY)为–0.507。根据该蛋白的总亲水性系数得出该蛋白亲水性较弱,初步推测可以使用疏水层析进行纯化。并且纯化缓冲液的pH值需低于理论pI值,初步将其定在6.0–8.0,然后根据不同试剂的缓冲能力选择相应的缓冲液。
菌体沉淀经缓冲液重悬并超声裂解后,裂解上清通过苯基疏水柱纯化得到了重组的CAP2NC蛋白,经SDS-PAGE和Western blotting鉴定。由图1A可见,在33 kDa左右处有一条与理论值相符的目的条带。超声上清经Phenyl-HP疏水层析阶段洗脱后,获得不同浓度的洗脱峰,经10%SDS-PAGE分析可看出,泳道2穿透液中只有少量目的蛋白未挂柱,目的蛋白和与之大小相近的杂蛋白都得到有效分离,且杂蛋白较少,经软件扫描蛋白纯度达到95%以上。Western blotting结果表明 (图1B),最终纯化产物为CAP2NC蛋白,并且与抗p24单抗有较好的反应性。
2.3 CAP2NC蛋白与抗p24抗体结合反应活性的检测
纯化后的CAP2NC蛋白与抗p24的3种单抗A10F9、13E11、12G4进一步通过酶联免疫吸附实验 (ELISA)检测其反应活性,结果如图2所示。可以看到75%B洗脱时收集的目的蛋白与不同抗体有较好反应活性,这与Western blotting(图1B)结果一致,进一步说明通过疏水柱层析纯化后的目的蛋白具有活性。
2.4 CAP2NC蛋白体外组装特性分析
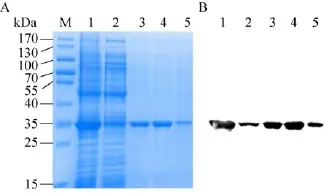
图1 CAP2NC蛋白的分离纯化及鉴定Fig.1 Purification and identification of CAP2NC.(A)Purification through phenyl-HP column.M:protein marker;1:broken bacterial supernatant total protein;2:over phenyl-HP agarose column flowthrough post;3:75%B elution fraction;4:100%B elution component;5:ultrapure water elution component.(B)Western blotting identification of the purified CAP2NC;1–5:each band is corresponding to the figure A.

图2 CAP2NC反应活性检测Fig.2 Identification the reactivity of CAP2NC.
用颗粒分析实验检测CAP2NC蛋白的体外自组装特性,纯化后的不同洗脱成分的CAP2NC蛋白经3倍浓缩后透析到50 mmol/L TB 8.0+0.1 mol/L NaCl缓冲液,并且在透析之前于样品中加入10%(W/W)的Yeast-RNA(本实验还尝试了1%、5%的质量百分比,方法相同),室温下透析16 h,样品经高速离心后,取上清和沉淀进行10%非还原性SDS-PAGE分析。如图3A所示,大部分蛋白透析后经离心后均在沉淀中,并且在沉淀中 (泳道1、3、5)可看到二聚体、五聚体以及多聚体,而上清中只有少量单体蛋白 (泳道2、4、6),说明CAP2NC蛋白在体外可以自组装。取75%B洗脱的目的蛋白透析后的样品,分别进行10%的还原性和非还原性SDS-PAGE分析,在蛋白形成聚体过程中,分子间作用力或二硫键均会起到比较重要的作用,而从图3B可看出,无论是否经过还原处理,CAP2NC蛋白透析后均有多聚体形成,这进一步表明该蛋白的体外自组装不是源于二硫键的作用,推测在特定的缓冲液中CAP2NC蛋白形成聚体主要是因RNA的加入来驱动不同蛋白分子间的相互作用导致的。
2.5 CAP2NC蛋白自组装后凝胶过滤层析分析

图3 SDS-PAGE检测CAP2NC蛋白体外自组装特性Fig.3 Monitoring the self-assembly properties of the CAP2NC proteins in vitro.(A)Employing pelleting assays to investigate the assembly properties.M:protein marker;After dialysis,75% B elution fraction was centrifuged to separate the pellet(1)and supernatant(2)fractions, both components were subjected to non-reducing SDS-PAGE gels;3:the pellet of 100%B elution component;4:the supernatant of 100%B elution component;5:the pellet of ultrapure water elution constituent;6:the supernatant of ultrapure water elution constituent.(B)Identification of the assembly properties of 75%B elution component.M:protein marker;1,2:reducing;3,4:non-reducing.
以75%B洗脱纯化的CAP2NC蛋白在50 mmol/L TB 8.0+0.1 mol/L NaCl缓冲液中透析,12000×g高速离心10 min后,取上清通过凝胶层析柱 (G5000)分析蛋白透析后组装情况,结果如图4所示。图4A为凝胶过滤层析蛋白标准品G5000分子筛图谱。根据不同大小的蛋白标准品 (美国GE healthcare公司)峰保留时间推测CAP2NC蛋白透析后各组分中聚体及颗粒形成情况。其中440 kDa蛋白标准品峰保留时间为17.3 min,75 kDa蛋白标准品峰保留时间为21.5 min,30 kDa蛋白标准品峰保留时间22.9 min。图4B为透析前加入1%或5%Yeast-RNA的样品出峰图谱,大部分样品峰保留时间在14.8 min,小部分为11.5 min。由于CAP2NC蛋白单体大小理论值为33 kDa,推测该蛋白透析后形成了不同大小的颗粒或者聚体,分子量大于440 kDa。而图4C为透析前加入10%Yeast-RNA的样品出峰图谱,较多样品峰保留时间在11.7 min,少量为21.3 min和22.6 min,推测较多的样品在加入10%RNA透析后形成了颗粒,只有较少部分蛋白以二聚体或单体形式存在。
2.6 CAP2NC蛋白自组装后电镜观察
取凝胶过滤层析鉴定后的样品进行负染,通过电镜进一步观察颗粒形态。结果如图5A显示,经染色后,若透析之前样品中加入1%或者5%的Yeast-RNA,电镜下既可看到与野生型CA体外自组装后形成的形态相似的空心管状的颗粒[14],又可观察到空心的颗粒样或者圆形薄片状结构;若透析前样品中加入10%RNA,观察到大部分CAP2NC蛋白组装为空心管状颗粒,长短大小不一 (图5B)。推测透析前样品中由于RNA的加入,在很大程度上驱动了CAP2NC蛋白的多聚化,并且在其形成颗粒的过程中有各种各样的结构,并且空心的颗粒样或者圆形薄片状结构或许是组装过程中的一种中间形态。
3 讨论
HIV的高变异性使其对药物的耐受性日趋严重,抗艾滋药物本身也具有较强的毒副作用,那么寻找新的药物作用靶点成为了抗HIV感染研究的核心[15]。而HIV病毒生活周期的每一个阶段都可以作为抗逆转录病毒药物研发的一个重要靶点[4-6]。目前有报道利用X线断层成像技术及电镜技术精确揭示了未成熟HIV的CA-SP1的3D信息,并从结构水平上检测一种新型药物抑制HIV病毒的成熟过程,为深入揭示HIV对药物产生耐药性的机制及后期开发改造靶向HIV的新型药物提供研究线索和思路[16]。未成熟的病毒颗粒作为HIV组装过程中的一个关键产物,对于揭示介导非成熟病毒组装的蛋白质界面和结构变化是很重要的。而这种变化需要进一步运用结构生物学方法比较研究。CAP2NC蛋白作为Gag蛋白的一部分,本身能够装配为非成熟的管状结构。本研究对该蛋白纯化优化后鉴定了其具有体外自组装的性质。

图4 CAP2NC蛋白组装后高效液相色谱仪分析Fig.4 Analysis of self-assembly CAP2NC by HPSEC.(A)G5000 molecular sieve map of 440 kDa protein standard.(B)CAP2NC sample G5000 molecular sieve map with addition of 1%or 5%yeast-RNA prior to dialysis.(C)CAP2NC sample G5000 molecular sieve map with addition of 10%yeast-RNA before dialysis.
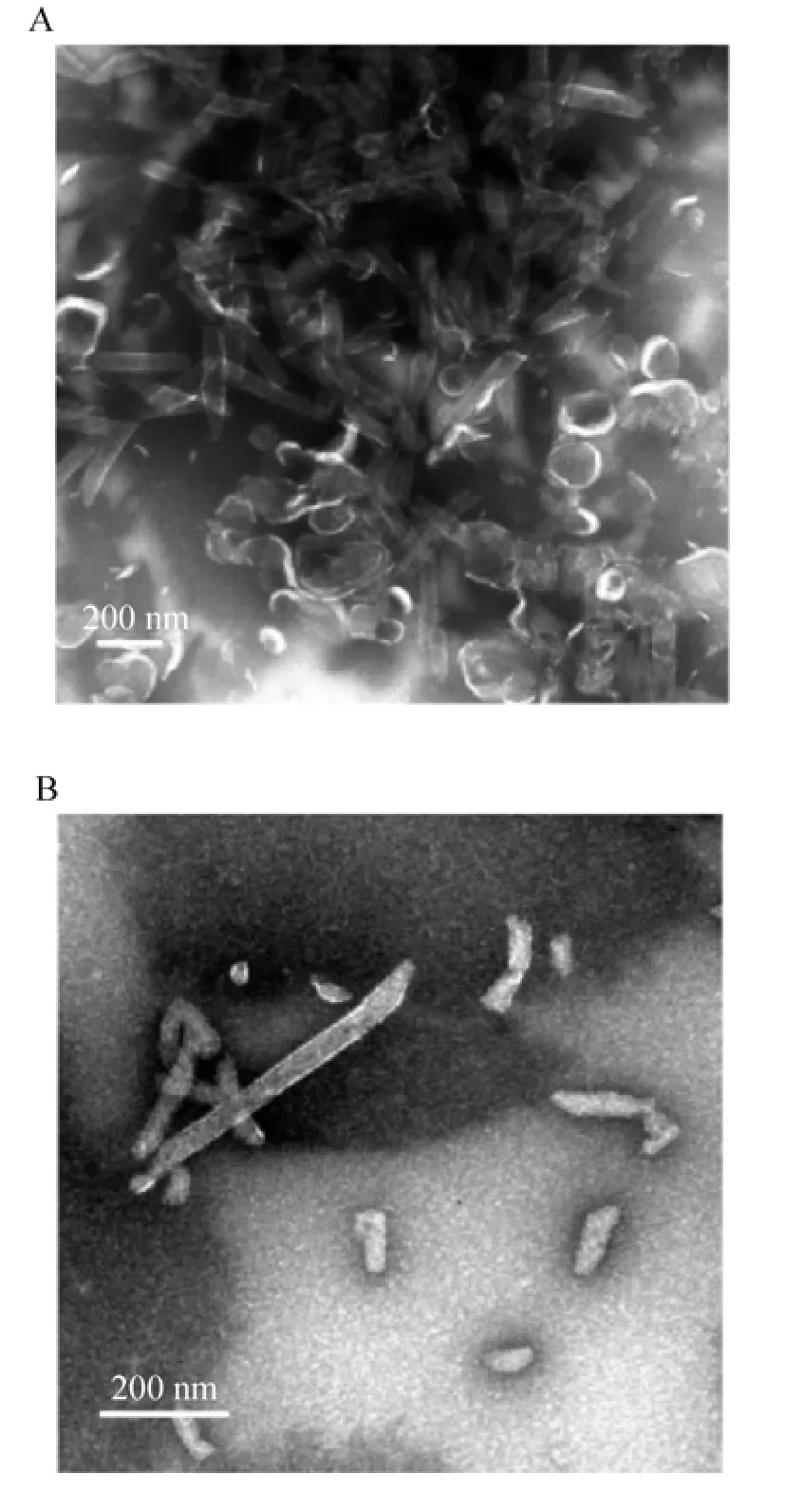
图5 CAP2NC蛋白自组装为颗粒后电镜观察Fig.5 Observation of the morphology of self-assembly CAP2NC by transmission electron microscopy.(A)The morphology of self-assembly CAP2NC with addition of 1% or5% yeast-RNA priortodialysis.(B)The morphology of self-assembly CAP2NC with addition of 10%yeast-RNA before dialysis.
在分析CAP2NC蛋白体外组装条件的过程中,本研究通过建立该蛋白体外组装体系,首先通过颗粒分析实验鉴定了该蛋白可自组装。接下来通过分子筛分析发现样品中加入1%或5%RNA,在 50 mmol/L Tris-HCI(pH 8.0)、100 mmol/L NaCl溶液条件下,根据峰保留时间分析一部分蛋白形成颗粒,有较多多聚体存在。进一步通过电镜验证,既可观察到不同长度的管状颗粒,也可观察到空心的颗粒样或片状结构;而样品中加入10%RNA,相同的缓冲条件下推测大部分蛋白形成颗粒,只有少部分蛋白为二聚体或单体形式存在,电镜下观察时只有管状结构形成,并且室温下放置一段时间后,仍有颗粒存在。出现这种差异的原因可能是RNA与蛋白的结合存在一个饱和度[2,17-18]。推测CAP2NC蛋白体外组装加入RNA后,RNA作为支架,通过与NC的相互作用,诱导蛋白构象发生变化 (类似于核糖核蛋白链),从而促进非成熟颗粒的组装,空心圆柱形管状结构的形成。该推论还需进一步结构生物学方面的验证。本研究通过分析CAP2NC蛋白理化性质并确定以10%RNA加入量为标准进行后续相关实验,进一步增加病毒衣壳体外的稳定性,为接下来对该蛋白的空间结构研究奠定基础,同时也为HIV非成熟病毒颗粒结构的相关研究提供了参考。
[1]Ganser-Pornillos BK,Yeager M,Sundquist IW.The structural biology of HIV assembly.Curr Opin Struct Biol,2008,18(2):203–217.
[2]Lingappa JR,Reed JC,Tanaka M,et al.How HIV-1 Gag assembles in cells:putting together pieces of the puzzle.Virus Res,2014,193:89–107.
[3]SundquistWI,Kräusslich HG.HIV-1 assembly,budding,and maturation.Cold Spring Harb Perspect Med,2012,2(7):a006924.
[4]Arts EJ,Hazuda DJ.HIV-1 antiretroviral drug therapy.Cold Spring Harb Perspect Med,2012,2(4):a007161.
[5]Spearman P.HIV-1 Gag as an antiviraltarget:development of assembly and maturation inhibitors.Curr Top Med Chem,2016,16(10):1154–1166.
[6]Waheed AA,Freed EO.HIV type 1 Gag as a target for antiviral therapy.AIDS Res Hum Retroviruses,2012,28(1):54–75.
[7]Klikova M,Rhee SS,Hunter E,et al.Efficientin vivoandin vitroassembly of retroviral capsids from Gag precursor proteins expressed in bacteria.J Virol,1995,69(2):1093–1098.
[8]Zuber G,McDermott J,Karanjia S,et al.Assembly of retrovirus capsid-nucleocapsid proteins in the presence ofmembranesorRNA.JVirol,2000,74(16):7431–7441.
[9]Hadravová R,de Marco A,Ulbrich P,et al.In vitroassembly of virus-like particles of a gammaretrovirus,the murine leukemia virus XMRV.J Virol,2012,86(3):1297–1306.
[10]López CS,Eccles JD,Still A,et al.Determinants of the HIV-1 core assembly pathway.Virology,2011,417(1):137–146.
[11]Luo WX,Zhang J,Yang HJ,et al.Construction and application ofanEscherichiacolihigh effective expression vector with an enhancer.Chin J Biotech,2000,16(5):578–581(in Chinese).罗文新,张军,杨海杰,等.一种带增强子的原核高效表达载体的构建及初步应用.生物工程学报,2000,16(5):578–581.
[12]Gu Y,Cao F,Wang L,et al.Structure of a novel shoulder-to-shoulder p24 dimer in complex with the broad-spectrum antibody A10F9 and its implication in capsid assembly.PLoS ONE,2013,8(4):e61314.
[13]Huseby D,Barklis RL,Alfadhli A,et al.Assembly of human immunodeficiency virus precursor gag proteins.J Biol Chem,2005,280(18):17664–17670.
[14]Ganser-Pornillos BK,Cheng AC,Yeager M.Structure of full-length HIV-1 CA:a model for the mature capsid lattice.Cell,2007,131(1):70–79.
[15]Liu Y,Su J,Yang CL,et al.Novel drug targets for anti-HIV-1 therapy.Int J Pharm Res,2008,35(1):4–8(in Chinese).刘瑶,苏靖,杨春玲,等.抗艾滋病药物研究的新靶点.国际药学研究杂志,2008,35(1):4–8.
[16]Schur FKM,Obr M,Hagen WJH,et al.An atomic model of HIV-1 capsid-SP1 reveals structures regulating assembly and maturation.Science,2016,353(6298):506–508.
[17]Briggs JAG,Simon MN,Gross I,etal.The stoichiometry of Gag protein in HIV-1.Nat Struct Mol Biol,2004,11(7):672–675.
[18]Parker SD,Wall JS,Hunter E.Analysis of mason-pfizer monkey virus gag particles by scanning transmission electron microscopy.J Virol,2001,75(19):9543–9548.

