生物合成聚3-羟基丙酸酯的研究进展
常乐,詹元龙,刘长莉
东北林业大学 生命科学学院,黑龙江 哈尔滨 150040
聚羟基脂肪酸酯 (Polyhydroxyalkanoates,PHAs)是微生物合成的一类线性高分子聚酯的总称[1]。自1926年Lemoigne在巨大芽孢杆菌Bacillus megaterium中首次发现聚羟基丁酸酯(P3HB)以来[2],已有超过150种PHAs单体被发现[3]。聚3-羟基丙酸脂 (Poly(3-hydroxypropionate),P3HP)是PHAs家族中新出现的一种聚酯,具有优异的材料学性质和机械性能,如高机械强度和拉伸强度、生物降解性、生物相容性等,被认为是石化合成塑料的重要代替品之一,具有广泛的应用价值与开发前景[4]。
迄今还未见野生微生物天然合成P3HP的报道,以往P3HP多采用化学方法合成,其中以β-丙内酯开环聚合 (ROP)和3-HP酯类缩合两种方法为主。前者虽然可以通过开环聚合产生高分子量的P3HP,但其反应过程会产生强烈的致癌物质[5-6],对生物和环境产生威胁;后者可利用无毒3-HP直接缩合生成P3HP,但产生的聚合物分子量不稳定,难以控制生产过程[7],因此两者均不适用于规模化商业生产。Zhang等[8]结合了缩合反应和开环聚合反应两者的优势,使用将3-HP单体优先制备成大环单体的两步法化学合成P3HP,其分子量(Mn)可达2.4−67 kg/mol。为了避免聚合反应中使用大量有机溶剂造成的环境污染和开环聚合中有害中间体产生的问题,方孝斌等[9]以自制的3-HP为单体,采用金属铪作为新型催化剂,在甲苯和氮气的保护下直接催化缩聚制备高分子量的P3HP,P3HP的数均分子量可达到14.7 kg/mol,这种方式合成的高分子P3HP呈现出很好的成膜特性和稳定性。除此之外,通过添加P3HP结构类似的前体物,如 3-HP、丙烯酸[10]或 1,3-丙二醇(1,3-PDO)[11]等,也能达到合成P3HP的目的。
综合研究表明,化学法制备P3HP的合成效率不高,且污染环境。而添加的P3HP结构类似前体物价格昂贵,且添加生产方式有细胞毒性从而抑制菌体生长,不适用于工业化规模生产[12]。因此近年来,采用基因工程方法构建能够利用廉价、可再生碳源合成P3HP的工程菌株已逐渐成为研究的热点。P3HP的生物合成路径主要包括甘油途径和丙二酸单酰辅酶A(Malonyl-CoA)途径。其中丙二酸单酰辅酶A是脂肪酸中心代谢路径中重要的限速步骤,亦是细菌脂肪酸合成途径中理想的调控枢纽。Zhang课题组[13]研究的丙二酸单酰辅酶A生物传感器对脂肪酸代谢的动态调控与稳态维持机制的应用对P3HP的合成有着至关重要的作用。此外,最新研究开发的P3HP合成路线——β-丙氨酸途径,可以在降低生产成本的同时提高合成P3HP效率,具有一定发展潜力。本文针对P3HP生物合成的研究进展进行概括总结。
1 生物法合成P3HP
1.1 甘油途径
近些年,甘油作为生产生物柴油的副产物,已成为合成各种生物制品最具吸引力的碳源[14],其可用量已超过化学、制药和化妆品行业等传统消费的需求,且来源便利。在以甲醇进行植物油或动物脂肪的酯交换反应中,10%的产物都为甘油[15-16],致使甘油价格急剧下降。因此,以廉价的甘油为原料合成P3HP能够降低成本,提高经济效益。
Andreeßen等[4]将专性厌氧菌丁酸梭菌Clostridium butyricum的甘油脱水酶基因dhaB1Cb、肠道沙门氏菌Salmonella enteric中的丙醛脱氢酶基因pduPSe和真氧产碱杆菌Ralstonia eutropha的PHA聚合酶基因phaCRe转入大肠杆菌Escherichia coli,以纯甘油为唯一碳源,采用两步补料分批发酵法合成P3HP,在好氧阶段菌体生长与繁殖,厌氧阶段通过添加还原剂促进产物大量积累。最终结果显示,P3HP最高产量可达1.4 g/L,占细胞干重的12%。经过Andreeßen等[4]进一步分析后发现,由于甘油脱水酶DhaB1Cb仅在严格的厌氧条件下具有活性,为了维持厌氧条件必须添加还原剂 (延胡索酸二钠和酒石酸钾钠),不仅增加了生产成本,且与其他途径合成的P3HP相比,产量相对较低,需要进一步开发甘油高产P3HP的发酵工艺。
在此研究基础上,Wang等[17]使用对氧气敏感性较低的肺炎克雷伯氏菌Klebsiellapneumonia中维生素B12依赖型甘油脱水酶基因dhaB123Kp及辅助基因gdrABKp代替dhaB1Cb,并将来自鼠伤寒沙门氏菌Salmonella typhimurium的丙醛脱氢酶基因pduPSt及来自R.eutropha的PHA聚合酶基因phaC1Re表达于E.coli中。在该优化策略中,省略了Andreeßen等[4]实验中的P3HP厌氧累积阶段,即避免了延胡索酸二钠和酒石酸钾钠还原剂的添加,且在缩减发酵程序和添加剂的同时降低了生产成本。此外,添加维生素B12可维持代谢途径中甘油脱水酶的活性;同时添加葡萄糖作为辅助剂,将葡萄糖分解代谢产生的生物质能量及甘油用于P3HP生产,从而提高产量。该合成方法仅采用有氧发酵即可使得P3HP产量达10.1 g/L,占细胞干重的46.4%(图1)。尽管甘油法合成P3HP已经取得了非常大的进展,但仍存在一些问题尚待解决。例如,添加维生素B12导致发酵成本增加,而采用生产维生素B12的菌株K.pneumonia作为P3HP合成的宿主菌,就可以解决该问题。另外,发酵生产中的氧化还原平衡问题也困扰P3HP的合成,此问题可能通过引入消耗NADH的合成代谢途径来解决。
为了避免维生素B12的添加,Heinrich等[18]引入维生素B12的天然生产者Shimwellia blattae作为载体,在S.blattae中表达恶臭假单胞菌Pseudomonas putida的1,3-PDO脱氢酶基因dhaTPp和醛脱氢酶基因aldDPp、丙酸梭菌Clostridium propionicumX2的丙酸酯辅酶A转移酶基因pctCp及R.eutrophaH16的PHA聚合酶基因phaC1Re(图1),实现不添加维生素B12也可以高产P3HP的设想。除此之外,与Andreeßen等[4]描述的两相发酵方法相反,该发酵过程采用厌氧-好氧两阶段培养,不仅实现获得比完全厌氧生产过程中更高的细胞干重,且在好氧阶段减少了前体3-羟基丙醛对1,3-PDO的转化。另一个有趣的发现是,用粗甘油发酵时细胞干重增加,可能是由于粗甘油碳源中的有机物可以被微生物作为补充碳源,从而比纯甘油发酵生产获得更高的生物量[19]。最终结果表明,在2 L补料分批发酵工艺中,该重组菌培养72 h后P3HP积累占细胞干重的9.8%±0.4%。
Feng等[20]在K.pneumonia菌株中引入E.coli的丙酰辅酶A合成酶基因prpEEc(图1),结果发现,曝气条件在P3HP生产和细胞生长中起着至关重要的作用。在该课题组研究的工程代谢途径中,以3-HP作为P3HP的前体。然而,在以改变振荡培养转速为50、100、200 r/min的3种曝气条件下,P3HP生产仅占3-HP生产的10%左右。最终在不含维生素B12及优化曝气的条件下,培养48 h后P3HP含量占细胞干重的12.7%。经研究结果推测,从3-HP合成P3HP的转化效率低很可能是由于丙酰辅酶A合成酶 (PrpE)的酶活较低造成的,同样在构建R.eutropha表达载体时也发现类似现象[21]。另一方面,PrpE是丙酸分解代谢过程中将丙酸酯催化合成丙酰辅酶A的关键酶,与丙酸盐相比,3-HP可能并不适合作为PrpE合成底物。通过修饰PrpE或使用如S.typhimurium[22]等不同菌株来源的其他PrpE等方法,可达到改善P3HP生产的目的。
通常,微生物合成的PHA聚合物的分子量和产量之间存在平衡[23]。PHA聚合物的分子量和产量通常由合成PHA的3个关键酶,即phaC编码的聚合酶、phaA编码的β-酮硫解酶和phaB编码的NADPH依赖性的乙酰乙酰CoA还原酶合成的比例确定。换句话说,这3种基因的表达水平可能会导致PHA合成产量的差异。众所周知,对于操纵子下游的基因,靠近启动子的基因将被更高度表达[24]。Hiroe等[25]探索了工程菌株E.coli中phaCAB操纵子基因序列对目的基因转录效率的影响。研究结果表明,操纵子中核酸序列的特异性位置和排序构成了调节基因表达的有效方法,如改变启动子或调整诱导物的浓度都能够有效地控制重组菌株合成PHA聚合物的产率和分子量。在此基础之上,Andreeßen等[26]重新排列phaCAB操纵子基因序列来完成P3HP合成操纵子结构的优化,即在磷酸丙糖异构酶敲除突变体中,通过工程化碳源依赖性质粒成瘾体系来克服发酵期间质粒丢失问题,从而达到提高聚酯产率。
在以甘油为底物生物合成3-HP的代谢途径中,杨鹏等[27]发现了该途径中存在还原力不平衡从而限制P3HP产量的问题。该课题组基于K.pneumonia的1,3-PDO氧化还原酶基因dhaTKp,在P3HP合成途径中引入1,3-PDO的合成 (图1),用以平衡细菌体内还原力。通过自杀性载体系统介导的同源重组技术,将甘油脱水酶及其激活因子的合成基因整合到E.coli基因组中,能够有效降低质粒的丢失率,增强质粒稳定性。经过发酵条件优化后,最终构建的工程菌可以获得2.7 g/L的P3HP和2.4 g/L的1,3-PDO,相比此前研究中1.54 g/L的P3HP摇瓶产量[28],此代谢途径合成P3HP产量有了近2倍的提高,且同时能够获得高附加值的副产物。
为稳定P3HP生产,Gao等[29]构建了遗传稳定的E.coli重组菌株,在氨基酸合成代谢基础上,采用染色体基因整合和质粒成瘾系统技术,获得高产P3HP的工程菌株E.coliQ1738。在有氧条件下,该重组菌株经甘油发酵可获得25.7 g/L的P3HP,细胞积累高达67.9%。此项研究表明,如果在相同菌株中存在两种或更多种类型的质粒,则质粒稳定性将降低,导致P3HP产量不高。据报道,在验证质粒的稳定性实验中,随着质粒长度的增加而稳定性随之降低,而质粒重复数量的增加引起的代谢负荷是质粒损失的主要原因[30-31]。由此推测,多重质粒对细胞代谢负担较重,单一质粒更加合理稳定。此外,在甘油途径中经由甘油脱水酶转化生成的3-羟基丙醛具有的毒性作用也是降低P3HP产量的原因之一。
1.2 丙二酸单酰辅酶A途径
丙二酸单酰辅酶A途径,即脂肪酸从头合成途径。这一途径可以利用各类碳源为底物,尤其是廉价、丰富的、可再生木质纤维素类物质都能通过细胞代谢生成乙酰辅酶A,从而进一步生成中间产物丙二酸单酰辅酶A以达到合成终产物P3HP的目的,该途径是低成本合成P3HP的首选途径[32]。
Fukui等[21]将乙酰辅酶A在乙酰辅酶A羧化酶基因acc作用下转化为丙二酸单酰辅酶A,并引入橙色绿屈挠菌Chloroflexus aurantiacus的丙二酸单酰辅酶A还原酶基因mcrCa合成3-HP,再将丙酰辅酶A合成酶基因pcsCa转入到R.eutropha合成P3HP,该项研究成功搭建了一条人工廉价合成P3HP的新通路 (图1)。Wang等[12]为了提高该反应体系中P3HP的合成效率,过表达E.coli的基因accABCDEc以提高胞内丙二酸单酰辅酶A浓度,并同时以转入E.coli的丙酰辅酶A合成酶基因prpEEc替换pcsCa基因,在E.coli中重新构建P3HP合成通路。该重组E.coli以葡萄糖为碳源合成P3HP,其产量最高为13 mg/L,占细胞干重的0.98%。
丙二酸单酰辅酶A途径中,以遗传背景明确且易培养的E.coli为宿主菌进行P3HP合成时,虽能利用非结构相关碳源但其产量明显过低。Wang等[12]发现,P3HP产量低可能是由质粒丢失引起的。首先,重组菌株中含有抗生素抗性的质粒选择性标记基因分泌于培养基中,可能造成相应抗生素快速分解及无质粒细胞过度生长;其次,在丙二酸单酰辅酶A还原酶 (MCR)催化两步反应中的中间产物丙二酸半醛及产物3-HP对E.coli的毒性作用,加重了质粒的不稳定性。另一方面,低活性的MCR也是造成P3HP含量低的原因之一。来自光合作用的绿色非硫细菌的MCR作为微生物生产中的关键酶,其最佳酶活反应温度为57℃[32],而载体E.coli的最适生长温度为37℃,在37℃培养条件下MCR酶的活性仅能达到最大活性的60%,因此培养温度成为制约MCR活性的一个因素。此外,MCR活性受其生理特性的严格控制。MCR在E.coli中表达时,由于生理环境的变化,导致MCR酶活性可能进一步降低。
为了解决MCR催化活性低的问题,学者们对MCR功能域进行了详细分析。Liu等[33]认为,MCR酶分MCR-N(氨基酸1–549)和MCR-C(氨基酸550–1219)两个活性中心,且催化丙二酸单酰CoA合成3HP分两步:MCR-C先将丙二酸单酰CoA还原成游离的中间体丙二酸半醛,再由MCR-N将其催化为3HP(图1)。Liu等[34]对该路径中关键酶的活性分析后发现,MCR-C活性比MCR-N低4−5倍,即MCR酶活性不均衡限制下游产物高效积累。分别对MCR-C和MCR-N进行定向诱变来调控两者的表达速率,同时优化发酵条件,P3HP前体物3-HP的产量最高可达到40.6 g/L。
Yang等[35]认为丙二酸单酰辅酶A代谢不平衡限制下游产物合成,采用反义RNA技术下调丙二酸单酰辅酶A合成脂肪酸通路,并在E.coli中实现富集,当fabD基因表达被抑制时细胞内丙二酸单酰辅酶A浓度增加4.5倍。Yuzawa等[36]在研究丙二酸单酰辅酶A经过3-HP途径积累聚酮化合物的过程中也发现,当胞内提供充足丙二酸单酰辅酶A时,下游产物的合成能力提高100倍。进而Zhang等[37]提出设计丙二酸单酰辅酶A动态调节系统,以便提高丙二酸单酰辅酶A合成与转化速率,从而提高终产物的产量。
1.3 β-丙氨酸 (β-alanine)途径
前期研究发现,在甘油途径中,虽然能够提高最终产物P3HP的产量,但维持甘油脱水酶的活性需要外源供应维生素B12,导致生产成本高;而丙二酸单酰辅酶A途径中,以葡萄糖作为碳源合成P3HP,其产量偏低,不能够有效应用于大规模生产。
为了解决上述问题,Wang等[38]在重组E.coli中开发了一种从廉价碳源出发由β-丙氨酸作为中间体合成P3HP的新途径 (图1)。经过一系列系统优化后,克隆E.coli的L-天冬氨酸脱羧酶基因panDEc及其成熟因子panMEc、3-羟基酸脱氢酶基因ydfG和丙酰辅酶A合成酶基因prpEEc,同时扩增P.putida的β-丙氨酸-丙酮酸转氨酶基因pp0596以及R.eutropha的PHA聚合酶基因phaC1Re,并将上述全部基因在E.coli中表达。以甘油和葡萄糖为碳源,摇瓶培养重组菌株产生的P3HP含量为0.5 g/L,高达细胞干重的10.2%。虽然P3HP的含量不高,但该途径比其他报道途径的优势在于氧化还原中性,不需要添加任何辅酶及昂贵的前体,可以利用广泛的碳源等,以上优势也值得科研工作者进一步研究与开发。
Lacmata等[39]在以β-丙氨酸为中间体的P3HP合成途径中发现,由天冬氨酸生物合成途径产生的L-天冬氨酸可利用E.coli的L-天冬氨酸-α-脱羧酶转化为β-丙氨酸,中间产物β-丙氨酸由P.putida的β-丙氨酸-丙酮酸转氨酶转化成丙二酸半醛,然后丙二酸半醛由3-羟基酸脱氢酶从E.coli还原为3-HP作为P3HP的前体 (图1)。实验过程发现,β-丙氨酸供应不足限制了P3HP的生物合成,可能是由于L-天冬氨酸-α-脱羧酶活性低或胞内L-天冬氨酸浓度不高所引起的。L-天冬氨酸-α-脱羧酶是β-丙氨酸通路中的限速酶,可通过转入E.coli或谷氨酸棒杆Corynebacterium glutamicum的L-天冬氨酸-α-脱羧酶提高合成效率,以便生成足量的β-丙氨酸。但实验结果显示,L-天冬氨酸浓度的增高并未有效转化合成β-丙氨酸。最终实验表明,适宜条件下的重组E.coli分别在烧瓶培养和补料分批发酵中合成0.98 g/L和10.2 g/L P3HP。
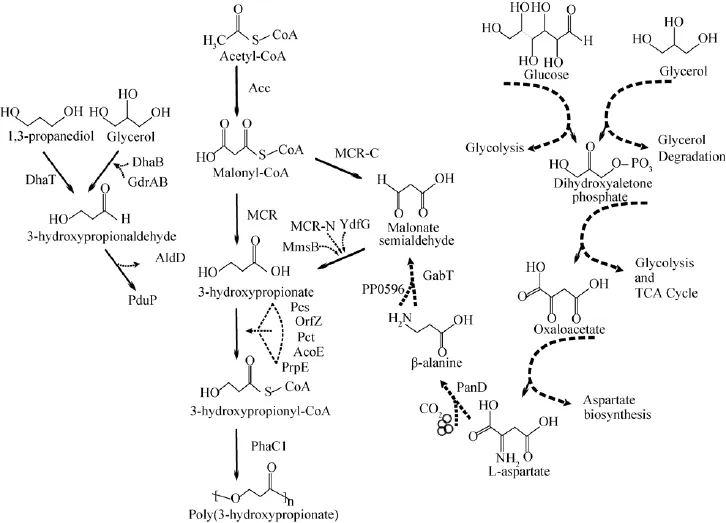
图1 P3HP生物合成途径[40]Fig.1 P3HP biosynthetic pathway[40].Acc:acetyl-CoA carboxylase from E.coli;AcoE:acetyl-CoA synthase from R.eutropha;AldD:aldehyde dehydrogenase from P.putida;DhaB12:glycerol dehydratase from C.butyricum;DhaB123:glycerol dehydratase from K.pneumoniae;GdrAB:glycerol dehydration enzyme co-factor from K.pneumoniae;DhaT:1,3-propanediol oxidoreductase from P.putida or K.pneumonia;MCR:malonyl-coenzyme A(CoA)reductase from C.aurantiacus;MCR-C:malonyl-coenzyme A(CoA)reductase from C.aurantiacus;MCR-N:malonyl-coenzyme A(CoA)reductase from C.aurantiacus;OrfZ:coenzyme A(CoA)transferase from C.kluyveri;Pcs’:coenzyme A(CoA)ligase domain from C.aurantiacus;PctCp:propionyl-CoA transferasefrom C.propionicum;PduP:propionaldehyde dehydrogenase from S.typhimurium;PhaC1:PHA synthase from R.eutropha;PrpE:propionyl-CoA synthase from E.coli or S.typhimurium;ACS:3-hydroxypropinyl-CoA synthase from C.aurantiacus;YdfG:3-hydroxyacid dehydrogenase from E.coli;MmsB:3-hydroxyisobutyrate dehydrogenase from P.putida;PanD:L-aspartate decarboxylase from E.coli;PP0596:b-alanine-pyruvate transaminase from P.putida;GabT:4-Aminobutyrate transaminase from C.acetobutylicum.
为了释放胞内聚羟基脂肪酸酯,提高最终产物产量,Lacmata等[41]同时建立了一种利用镁严格控制的新型自溶系统,应用于工程化E.coli中P3HP的生产。通过启动子PmgtA后面的5′非翻译区 (5′UTR)插入到过表达的裂解基因 (E.coli的S、R和Rz)中构建自溶系统。在含有裂解基因和P3HP生物合成基因的双重质粒的P3HP表达系统中,自溶系统功能良好 (裂解效率超过90%),而P3HP生产由于质粒损失而降低。将自溶基因和P3HP生物合成基因整合到一个质粒中,在启动子PmgtA-UTR的菌株Q2646中实现了P3HP含量为72.7%(比对照提高 2.4倍)及质粒稳定性为79.8%±3.1%。然而,在含有启动子PmgtA的菌株Q2647中,由于细胞快速裂解而不能高效合成P3HP。在Mg2+剥离条件下活化的新型自溶体系证明了在聚羟基脂肪酸酯生产中应用的可行性,其可能对其他胞内产物的合成具有很大的应用潜力。
2 结论与展望
本综述旨在总结近年来P3HP生物合成的研究进展。近几年,研究者通过基因工程技术构建有效的P3HP生物合成途径:其中,丙二酸单酰辅酶A途径和甘油途径经过改造可以利用丰富而廉价的碳源,在一定程度上提高P3HP的合成效率;而新型的β-丙氨酸途径经过优化也可以降低生产成本,目前也成为生物合成中的热门话题。但迄今为止,P3HP生物合成技术依然存在以下问题:1)添加相关辅酶及P3HP结构类似前体增加生产成本。2)基因工程菌株中的质粒丢失致使最终P3HP产量偏低。3)在P3HP生物合成途径中,相关中间产物浓度过高造成细胞毒性;部分酶活性低;氧化还原反应不平衡。以上问题都尚待解决。
随着基因编辑技术与表达修饰技术的成熟与发展,现逐步应用在医药、化工等诸多领域,因而:1)正如Gao等[29]在2014年的报道中利用基因组整合技术有效增加了甘油途径中P3HP的产量,可以将基因组的改造运用到丙二酸单酰辅酶A生产途径中;2)可依据Zhang课题组研发的生物传感器的负反馈调控机制[13],寻找MCR酶活控制的关键因子,并设计负反馈调节通路,将MCR的酶活性与细胞增殖能力调控在较高水平上;3)利用基因敲除手段减少与终产物无关的代谢产物的生成,最终构建出不需要额外添加辅酶及前体,通过丙二酸单酰辅酶A合成途径,仅利用可再生、廉价碳源即可高效合成P3HP的稳定遗传背景的E.coli株系,推进廉价、大规模生产P3HP的工业化进程。
[1]Chen GQ.Recent progress in application of microbial polyhydroxyalkanoates.Mater China,2012,31(2):7–15(in Chinese).陈国强.微生物聚羟基脂肪酸酯的应用新进展.中国材料进展,2012,31(2):7–15.
[2]Lemoigne M. Produits de dehydration et de polymerisation de l’acide beta-oxybutyrique.Bull Soc Chim Biol,1926,8:770–782.
[3]Steinbüchel A,Lütke-Eversloh T.Metabolic engineering and pathway construction for biotechnological production of relevant polyhydroxyalkanoates in microorganisms.Biochem Eng J,2003,16(2):81–96.
[4]Andreeßen B,Lange AB,Robenek H,et al.Conversion of glycerol to poly(3-hydroxypropionate)in recombinantEscherichia coli.Appl Environ Microbiol,2010,76(2):622–626.
[5]Gresham TL,Jansen JE,Shaver FW.β-Propiolactone.I.polymerization reactions.J Am Chem Soc,1948,70(3):998–999.
[6]Yamashita M, Takemoto Y, Ihara E, et al.Organolanthanide-initiated living polymerizationsof ε-caprolactone, δ-valerolactone,and β-propiolactone.Macromolecules,1996,29(5):1798–1806.
[7]Nanba T,Ito H,Kobayashi H,et al.Production process of poly(hydroxyalkanoate):JP,JPH06329774.1994-11-29.
[8]Zhang DH,Hillmyer MA,Tolman WB.A new synthetic route to poly[3-hydroxypropionic acid] (P[3-HP]):ring-opening polymerization of 3-HP macrocyclic esters.Macromolecules,2004,37(22):8198–8200.
[9]Fang XB,Tao YL,Xu KT,et al.Catalytic synthesis of poly(3-hydroxypropionic acid).Chin J Synth Chem,2007,15(4):452–453(in Chinese).方孝斌,陶玉伦,许开天,等.铪催化合成聚3-羟基丙酸.合成化学,2007,15(4):452–453.
[10]Valentin HE,Mitsky TA,Mahadeo DA,etal.Application of a propionyl coenzyme a synthetase for poly(3-hydroxypropionate-co-3-hydroxybutyrate)accumulation in recombinantEscherichia coli.Appl Environ Microbiol,2000,66(12):5253–5258.
[11]Zhou Q,Shi ZY,Meng DC,et al.Production of 3-hydroxypropionate homopolymer and poly(3-hydroxypropionate-co-4-hydroxybutyrate)copolymer by recombinantEscherichia coli.Metab Eng,2011,13(6):777–785.
[12]Wang Q,Liu CS,Xian M,et al.Biosynthetic pathway for poly(3-hydroxypropionate) in recombinantEscherichia coli.J Microbiol,2012,50(4):693–697.
[13]Liu D,Xiao Y,Evans BS,et al.Negative feedback regulation of fatty acid production based on a malonyl-CoA sensor-actuator.ACS Synth Biol,2015,4(2):132–140.
[14]Yazdani SS,Gonzalez R.EngineeringEscherichia colifor the efficient conversion of glycerol to ethanol and co-products.Metab Eng,2008,10(6):340–351.
[15]Johnson DT,Taconi KA.The glycerin glut:options for the value-added conversion of crude glycerol resulting from biodiesel production.Environ Prog,2007,26(4):338–348.
[16]Quispe CAG,Coronado CJR,Carvalho Jr JA.Glycerol:production,consumption,prices,characterization and new trends in combustion.Renew Sust Energy Rev,2013,27:475–493.
[17]Wang Q,Yang P,Liu CS,et al.Biosynthesis of poly(3-hydroxypropionate) from glycerol by recombinantEscherichia coli.Bioresour Technol,2013,131:548–551.
[18]Heinrich D,Andreessen B,Madkour MH,et al.From waste to plastic:synthesis of poly(3-hydroxypropionate)inShimwellia blattae.Appl Environ Microbiol,2013,79(12):3582–3589.
[19]Andreeßen B, Taylor N, Steinbüchel A. Poly(3-hydroxypropionate):a promising alternative to fossil fuel-based materials.Appl Environ Microbiol,2014,80(21):6574–6582.
[20]Feng XJ,Xian M,Liu W,et al.Biosynthesis of poly(3-hydroxypropionate) from glycerol using engineeredKlebsiellapneumoniaestrain without vitamin B12.Bioengineered,2015,6(2):77–81.
[21]Fukui T,Suzuki M,Tsuge T,et al.Microbial synthesis of poly ((R)-3-hydroxybutyrate-co-3-hydroxypropionate)from unrelated carbon sources by engineeredCupriavidus necator.Biomacromolecules,2009,10(4):700–706.
[22]Lee SK,Newman JD,Keasling JD.Catabolite repression of the propionate catabolic genes inEscherichia coliandSalmonella enterica:evidence for involvement of the cyclic AMP receptor protein.J Bacteriol,2005,187(8):2793–2800.
[23]Lim HN,Lee Y,Hussein R.Fundamental relationship between operon organization and gene expression.Proc NatlAcad Sci USA,2011,108(26):10626–10631.
[24]Sim SJ,Snell KD,Kim BW,et al.Increased poly-βhydroxybutyrate(PHB)chain length by the modulation of PHA synthase activity in recombinantEscherichia coli.Biotechnol Lett,2001,23(24):2057–2061.
[25]Hiroe A,Tsuge K,Nomura CT,et al.Rearrangement of gene order in thephaCABoperon leads to effective production of ultrahigh-molecular-weight poly[(R)-3-hydroxybutyrate]in genetically engineeredEscherichia coli.Appl Environ Microbiol,2012,78(9):3177–3184.
[26]Andreeßen B,Johanningmeier B,Burbank J,et al.Influence of the operon structure on poly(3-hydroxypropionate)synthesis inShimwellia blattae.Appl Microbiol Biotechnol,2014,98(17):7409–7422.
[27]Yang P,Wang Q,Xian M,et al.The production of poly(3-hydroxypropionate)by recombinantEscherichia colifrom glycerol.Microbiol China,2014,41(10):1961–1968(in Chinese).杨鹏,王琦,咸漠,等.以甘油为底物利用重组大肠杆菌生产聚3-羟基丙酸.微生物学通报,2014,41(10):1961–1968.
[28]Yang P.The production of poly(3-hydroxypropionate)and 1,3-PDO by biosynthesis from glycerol[D].Dalian:Dalian Polytechnic University,2014(in Chinese).杨鹏.从甘油途径生物法合成P3HP和1,3-PDO[D].大连:大连工业大学,2014.
[29]Gao YQ,Liu CS,Ding YM,et al.Development of genetically stableEscherichiacolistrains for poly(3-hydroxypropionate) production.PLoS ONE,2014,9(5):e97845.
[30]Wójcik K,Wieckiewicz J,Kuczma M,et al.Instability of hybrid plasmids inBacillus subtilis.Acta Microbiol Pol,1993,42(2):127–136.
[31]Friehs K. Plasmid copy number and plasmid stability//Scheper T.New Trends and Developments in Biochemical Engineering.Berlin Heidelberg:Springer,2004:47–82.
[32]Hügler M,Menendez C,Schägger H,et al.Malonylcoenzyme a reductase fromChloroflexus aurantiacus,a key enzymeofthe3-hydroxypropionatecycle for autotrophic CO2fixation.J Bacteriol,2002,184(9):2404–2410.
[33]LiuCS,WangQ,XianM,etal.Dissectionof malonyl-coenzyme A reductase ofChloroflexus aurantiacusresults in enzyme activity improvement.PLoS ONE,2013,8(9):e75554.
[34]Liu CS,Ding YM,Zhang RB,et al.Functional balance between enzymes in malonyl-CoA pathway for 3-hydroxypropionate biosynthesis.Metab Eng,2016,34:104–111.
[35]Yang YP,Lin YH,Li LY,et al.Regulating malonyl-CoA metabolism via synthetic antisense RNAs for enhanced biosynthesis of natural products.Metab Eng,2015,29:217–226.
[36]Yuzawa S,Chiba N,Katz L,et al.Construction of a part of a 3-hydroxypropionate cycle for heterologous polyketide biosynthesis inEscherichiacoli.Biochemistry,2012,51(49):9779–9781.
[37]Zhang FZ,Carothers JM,Keasling JD.Design of a dynamic sensor-regulatorsystem forproduction of chemicals and fuels derived from fatty acids.Nat Biotechnol,2012,30(4):354–359.
[38]Wang Q,Yang P,Xian M,et al.Metabolic engineering ofEscherichia colifor poly(3-hydroxypropionate)production from glycerol and glucose.Biotechnol Lett,2014,36(11):2257–2262.
[39]Lacmata ST,Kuiate JR,Ding YM,et al.Enhanced poly(3-hydroxypropionate) production via β-alanine pathway in recombinantEscherichia coli.PLoS ONE,2017,12(3):e0173150.
[40]Yang P,Wang Q,Xian M,et al.Biosynthesis of poly(3-hydroxypropionate)and its copolymers.Chin Sci Bull:Chin Ver,2014,59:2137–2144(in Chinese).杨鹏,王琦,咸漠,等.聚3-羟基丙酸及其共聚物的生物合成.科学通报,2014,59:2137–2144.
[41]Lacmata ST,Yao L,Xian M,et al.A novel autolysis system controlled by magnesium and its application to poly(3-hydroxypropionate)production in engineeredEscherichiacoli. Bioengineered, 2017, doi:10.1080/21655979.2017.1286432.

