一例鸡传染性囊病的诊断及病毒分离鉴定
杨瑞梅,由 艺,秦志华,单 虎
(青岛农业大学动物科技学院,山东 青岛 266109)
鸡传染性囊病(IBD)是由传染性囊病病毒引起的主要危害雏鸡的急性传染病[1]。该病毒主要侵害禽类的免疫中枢-腔上囊,腔上囊的损害使淋巴细胞大量减少,导致免疫抑制[2-3],从而对各种病原体易感性升高造成经济损失,因此给家禽养殖业带来的危害不容小觑。传染性囊病病毒分为I、II型两个血清型,血清I型为鸡源性,是导致发生IBD的主要血清型,血清I型病毒还可进一步分为不同的亚型,各亚型之间抗原相关性差异明显,为10%~70%,这也是造成临床上免疫失败的重要原因之一[4-6]。病毒在感染宿主体内主要分布于腔上囊和脾脏。传染性囊病病毒本身的致死率并不特别高,但其能破坏患病动物的免疫系统,近年来传染性囊病临床病例减少,但因该病腔上囊受损而引起禽流感、新城疫、支原体等病增多,因此从根本上仍需加强对IBD的防制。本试验分离获得了2017年山东青岛地区的IBD分离株,为该病流行病学和防制奠定基础。
1 材料与方法
1.1 主要试剂 TRIZol裂解液、dNTP、反转录酶(MLV)、Ex Taq酶、DL-2 000 Marker等,购自宝生物工程(大连)有限公司。
鸡传染性囊病琼脂扩散试验阳性血清、鸡传染性囊病琼脂扩散标准抗原,购自青岛易邦生物工程有限公司,生产批号:20170103。
1.2 方法
1.2.1 临床症状 2017年5月山东青岛市即墨某蛋鸡散养户共养500只38日龄蛋鸡,病鸡精神委靡,被毛蓬松,闭眼嗜睡,挤堆,不时排出白色水样稀粪,病程长者,死亡鸡爪干枯,发病率26%,死亡率4.2%。该鸡14日龄免疫传染性囊病弱毒疫苗。
1.2.2 病理变化 剖检9只濒死鸡及死亡鸡,病理变化:胸肌、腿肌有片状出血;腔上囊肿大,个别肿大2~3倍,囊腔内液体增多,黏膜上有点状或片状出血;肾脏呈花斑肾,输尿管增粗充满尿酸盐。
1.2.3 琼脂糖免疫扩散试验 制备1%琼脂糖凝胶板:称取1.0 g 琼脂糖、8 g NaCl和 0.01 g 硫柳汞(防腐),煮沸,倒平板、打孔、封底、加样,在中央孔加IBDV标准阳性血清,周围孔加待检病鸡腔上囊研磨液上清,同时用标准腔上囊抗原设阳性对照。置湿盒37℃恒温箱中培养24~48 h观察结果[7]。
1.2.4 病毒的鸡胚培养 (1)样品组织的处理将病变腔上囊剪碎并充分进行研磨成匀浆,以1∶4比例加入生理盐水混匀,反复冻融3次后加入10%双抗(青霉素和链霉素,1 000 IU),4℃冰箱内过夜,冻存备用;(2)病毒的鸡胚接种9日龄SPF鸡胚绒毛尿囊膜接种,将0.2 mL处理好的病料上清液缓缓注射到人造气室中,用生物膜和石蜡封孔。人造气室向上37℃恒温保湿箱内,每12小时观察1次,培养3-5 d。淘汰掉24 h内死亡的鸡胚;(3)病毒的收集取病变绒毛尿囊膜和病变胚体,匀浆,盲传4代做检测。
1.3 RT-PCR 检测
1.3.1 引物设计与合成 根据GenBank发表的IBDV的基因组片段,参照Zierenberg等的研究报道[8],利用Premier 5.0软件设计一对针对VP2基因的特异性PCR引物,扩增大小为750 bp目的片段,引物序列如表1。
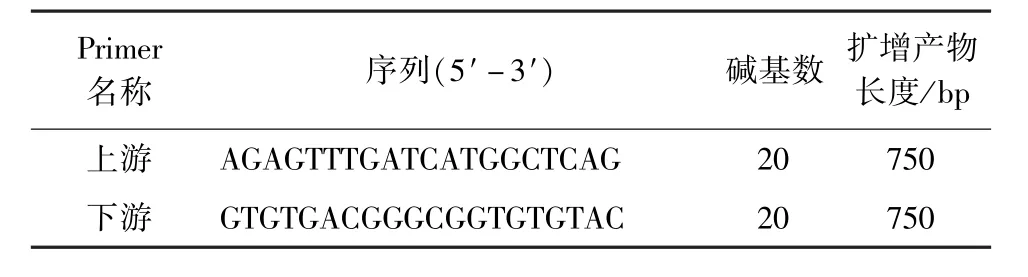
表1 VP2基因的特异性引物
1.3.2 病毒核酸的扩增 TRIZol裂解法提取鸡胚盲传4代病毒,反转录后进行PCR。PCR扩增反应体系:ddH2O 16 μL,10 × Ex Taq Buffer 2.5 μL,10 mmol/L dNTP 2 μL,上下游引物各 1 μL,cDNA 2 μL,Ex Taq 酶 0.5 μL。
在PCR扩增条件:98℃ 2 min;98℃10 s,55℃ 30 s,72℃ 45 s,循环30次,72℃ 10 min。电泳观察结果。
1.3.3 PCR产物测序和序列比对 将PCR产物胶回收后,送上海生工生物工程技术服务有限公司测序,对测序结果进行GenBank Blast分析。
1.4 动物试验及检测 将鸡胚分离病毒1∶5倍稀释,用滴鼻方式接种12只30日龄SPF雏鸡,150 μL/只,对照组雏鸡用同样方法接种等量生理盐水。连续观察记录5~8 d,对死亡鸡进行剖检。
取攻毒病死鸡腔上囊研磨,反复冻融后,取上清做琼脂糖免疫扩散试验。
2 结果
2.1 琼脂糖免疫扩散试验诊断结果 用发病鸡场病死鸡腔上囊研磨液做琼扩,24 h后出现明显沉淀线,见封三彩版图1。结合临床症状、病理变化及琼扩结果,判定该鸡场发生了IBD。
综上所述,编纂书目索引、发表学术论文、出版学术专著,都是以文献工作为起点,对文献进行收集、整理和利用,形成系统性的揭示与研究。这既是图书馆文献整理与服务工作的重要内容,也是从事学术研究最基础的工作,并使青年编纂群体的工作与治学呈现出相互融合与促进的特点。
2.2 病毒的鸡胚培养结果 10日龄SPF鸡胚第一代接种后3~4 d出现死亡,绒毛尿囊膜水肿增厚,尿囊液澄清透明;胚体全身水肿充血,躯干末端有出血点,肾脏充血,肝脏有出血点。连续传4代,增殖病毒。
2.3 RT-PCR试验结果 取第4代鸡胚绒毛尿囊膜和胚体研磨物进行PCR扩增,在750 bp处出现一特异、明显的条带,与预期IBDV的片段大小相符。PCR产物测序结果在GenBank Blast中比对,与腔上囊病中国强毒株NB(AY319768)的同源性最高,为99.3%。表明鸡胚盲传4代产物中获得了IBDV。见图2。
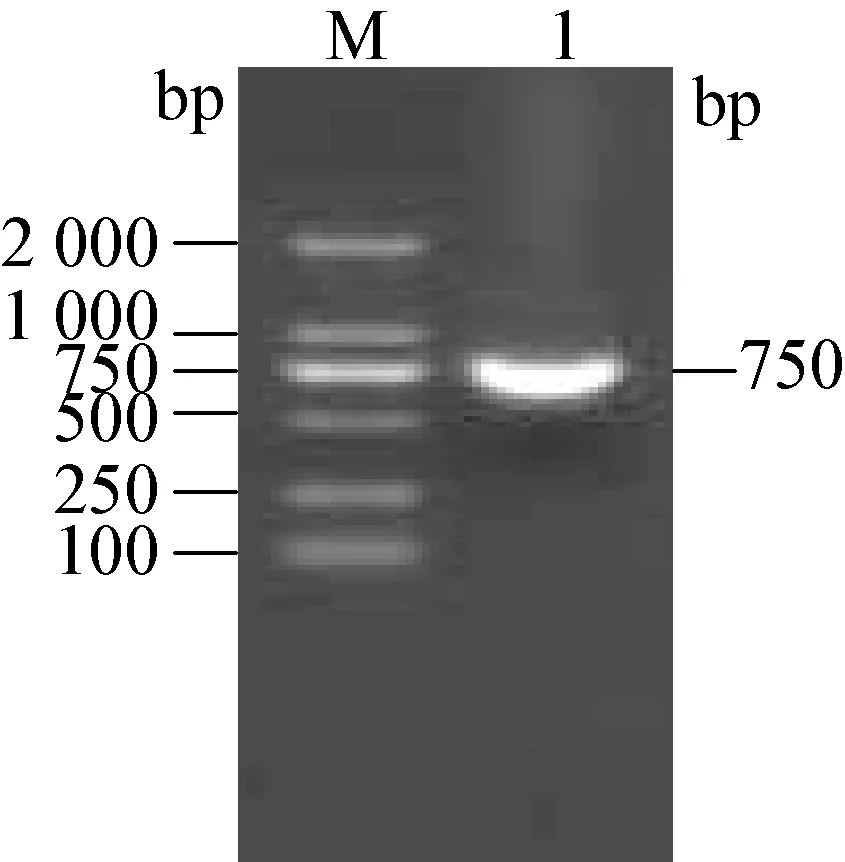
图2 RT-PCR法检测分离病毒
2.4 动物试验结果 将盲传4代鸡胚毒150 μL/只滴鼻接种SPF雏鸡,接毒后第3天出现精神沉郁、缩头不动、排白色稀粪的现象,第5~6天出现死亡,生理盐水对照雏鸡一直状态良好。病理变化:尸体脱水;腿肌有点状到片状出血;肾脏水肿,呈“花斑肾”外观;腔上囊肿胀,周围有一些淡黄色胶胨样物,腔上囊黏膜有出血点,囊腔内有黄色黏液;直肠膨大,颜色苍白,内部充满黄白色稀粪(见封三彩版图3、图4)。
攻毒后发病鸡腔上囊研磨液做琼扩,有致密明显的白色沉淀线,为强阳性。表明攻毒病死鸡腔上囊的组织中含有大量IBDV。
3 讨论
3.1 IBDV培养方法 用鸡胚绒毛尿囊膜增殖IBDV,是IBDV分离培养的良好方法。如果病料少,可先在30日龄SPF鸡中增殖病毒,取攻毒鸡病变腔上囊,再进行鸡胚接种[9]。本研究通过以上方法获得了一株山东青岛地区IBDV分离株。鸡胚绒毛尿囊膜接种可用天然气室法和人造气室法,天然气室法操作简单,但需揭开壳膜就会形成较大的与外界接触的创面,鸡胚被污染的几率增高。人造气室法形成的创面非常小,只有一个针头大小,但是这种方法操作难度比较高,需很大耐心和细心,且耗时。建议用三角形细铁丝等专用工具能使接种便利。
3.2 IBD的防控 目前,传染性囊病的流行出现了一些新特点,发病日龄范围扩大,发病率和死亡率增加,发病的表现不明显,病程延长,造成免疫极易失败,且出现了免疫抑制。本次发病鸡尽管14日龄免疫传染性囊病弱毒疫苗,可能因为环境中有野毒,且毒力较强,未能保护该鸡群发病。另外,育雏室彻底消毒很关键。本次发病由于育雏室在放入雏鸡前虽已消毒,但不彻底,地面仍可见粪便干涸物,对该病的发生有直接影响。搞好育雏舍消毒是防制该病的重要环节,严格消毒,可大大降低发病率[10]。在本研究中分离得到了IBDV,但其毒力仍未用试验检测,下一步将进行这方面工作。
总之,通过临床症状、病理变化和实验室检验对1例传染性囊病病例进行了确诊,并通过SPF鸡胚、SPF鸡接种,培养获得了传染性囊病病毒,为该病流行病学和防制研究奠定基础。
[1] 罗满林.动物传染病学[M].北京:中国林业出版社,2013:368-371.
[2] Le Nouёn C,Rivallan G,Toquin D,et al.Very virulent infectious bursal disease virus:reduced pathogenicity in Very virulent a rare natural segment-B-reassorted isolate[J].J Gen Virol,2006,87(Pt 1):209-216.
[3] Letzel T,Coulibaly F,Rey F A,et al.Molecular and structural bases for the antigenicity of VP2 of infectious bursal disease virus[J].J Virol,2007,81(23):12 827-12 835.
[4] Islam M R,Zierenberg K,Müller H.The genome segment B encoding the RNA-dependent RNA polymerase protein VP1 of veryvirulent infectious bursal disease virus(IBDV)is phylogenetically distinct from that of all other IBDV strains[J].Arch Virol,2001,146(12):2 481-2 492.
[5] Berg T P.Acute infectious bursal disease in Poultry:a review[J].Avian Pathol,2000,29(3):175-194.
[6] Jackwood D J,Sommer-Wagner S E.Amino acids contributing to antigenic drift in the infectious bursal disease Birnavirus(IBDV)[J].Virology,2011,409(1):33-37.
[7] 郭鑫.动物免疫学实验教程[M].北京:中国农业大学出版社,2007:71-74.
[8] Zierenberg K,Raue R,Muller H.Rapid identification of“very virulent”strains of infectious bursal disease virus by reversetranscription-polymerase chain reaction combined with restriction enzyme analysis[J].Avian Pathol,2001,30(1):55-62.
[9] Hitchner S B.Infectivity of infectious bursal disease virus for embryonating eggs[J].Poult Sci,1970,49(2):511-516.
[10] Mahgoub H A 1,Bailey M,Kaiser P.An overview of infectious bursal disease[J].Arch Virol,2012,157(11):2 047-2 057.

