新疆南疆牛冠状病毒BCV-Aks-01株分离及基因型鉴定
张莹钰,张迎春,王青青,胡建军,王 娜,彭安业,张婉琪,崔 鑫
(1.塔里木大学生命科学学院,新疆 阿拉尔 843300;2.新疆生产建设兵团第一师畜牧兽医工作站,新疆 阿拉尔 843300;3.塔里木大学动物科学学院,新疆 阿拉尔 843300)
牛冠状病毒(Bovine coronavirus,BCoV)引起成年牛冬痢、新生犊牛腹泻和呼吸道疾病的主要病原。成年牛冬季严重水样腹泻,发病率高、死亡率低,而犊牛感染多见于1周龄内,腹泻常发生于7~10日龄,以水样性腹泻为主要表现,严重影响犊牛生长性能。牛冠状病毒与轮状病毒感染相似,且两者容易混合发生,进而导致死亡率升高。感染冠状病毒的患畜可通过粪便向环境排毒,即使症状恢复后18个月的时间里,仍可排出具有侵袭力的病毒[1],给养牛业可持续健康发展带来严重影响。
近年来,随着新疆养牛业不断发展,犊牛腹泻发病率呈上升趋势,该病已经成为危害养牛业的主要传染病之一。因此,开展犊牛腹泻病原鉴定对疫病防控具有重要意义。本研究采用HCT-8细胞系,从新疆南疆某规模牛场疑似感染BCoV的犊牛粪便样品中分离到1株病毒,依据冠状病毒基因组中高度保守N基因作为基因分型基础设计特异性引物,运用RT-PCR进行基因分型鉴定,为该病的诊断、防治提供参考。
1 材料与方法
1.1 病料来源 新疆南疆某规模化牛场,犊牛春、冬季出现严重性腹泻、脱水,呈淡黄色或灰白色水样性粪便,并混有肠黏膜。病理剖检,肠黏膜脱落、肠系膜淋巴结肿大。发病犊牛经抗生素治疗无效。无菌采集病死犊牛肠系膜淋巴结、肠内容物等样品,保存备用。
1.2 主要试剂 病毒检测用RNA提取试剂盒、DNA凝胶回收试剂盒、pGM-T克隆试剂盒、质粒小提试剂盒等,购自天根生化科技(北京)有限公司;GoTap Green Master Mix,购自Promega生物技术有限公司;RevertAid First Stand cDNA Synthesis Kit,购自Thermo科技有限公司;HCT-8细胞,购自武汉博士德生物工程有限公司;胰蛋白酶、胎牛血清、1640营养液、PBS等,购自美国HyClone公司。
1.3 冠状病毒参考毒株 文章中涉及的冠状病毒参考株均下载于NCBI中GenBank。
1.4 样品处理 无菌取腹泻犊牛肠道内容物,PBS处理成10%悬液,经4 000 r/min(4℃)离心10 min取上清,通过 0.22 μm的滤膜过滤两次。储存于-80℃备用。
1.5 病毒分离培养 HCT-8细胞复苏并传至形态稳定,且细胞密度约80%左右时弃去营养液,PBS清洗2次,弃去清洗液。取1.5 mL处理后的样品于无菌离心管中加1.5 μL胰蛋白酶,CO2培养箱中37℃培养1 h,再接种于HCT-8细胞上,CO2培养箱中37℃作用2 h,期间每隔20 min轻轻摇晃1次,最后向细胞瓶加入10 mL维持液,置于CO2培养箱37℃培养。每隔12 h观察1次。72 h收获培养液。收获液反复冻融3次,再接种于HCT-8细胞,连续盲传4~5代。每12 h镜检观察细胞病变(Cytopathic Effect,CPE),待细胞病变后脱落面积达到50%左右收毒,-80℃保存备用。
1.6 样品RNA的提取 取病毒CPE培养液,-80℃反复冻融3次,参照“病毒检测用RNA提取试剂盒”说明书操作提取RNA,于-80℃保存备用。
1.7 cDNA第一链的合成 取模板RNA 2 μL加入离心管中,oligo(dT)18引物 1 μL、无核酸酶的ddH2O至12 μL,65℃孵育5 min,冰上冷却,离心。按照顺序加入:5X Reaction Buffer 4 μL、RiboLockTMRNA 酶抑制剂 (20 U/μL)1 μL、10 mmol/L dNTP Mix 2 μL、RevertAidTMM-MuLV 逆转录酶(200 U/μL)1 μL,总体积 20 μL。 42 ℃孵育 60 min,70 ℃加热5 min终止反应。
1.8 引物 根据GenBank上BCoV U00735 Mebus参考毒株,利用DNA Star和Prime 5.0设计1对针对BCoV高度保守基因N基因的特异性引物,序列如下:BCV-P1:5′-GAGCGTCCTTTGGAAATCGT-3′;BCV-P1:5′-GCTTAGTTACTTGCTGTGGC-3′,预计扩增片段为730 bp,引物序列由上海先工生物工程技术服务有限公司合成。
1.9 RT-PCR反应扩增体系 以 BCV-P1、BCV-P2引物进行PCR反应,采用50 μL反应体系:Go Tap Green Master Mix 25 μL,引物 P1、P2 各1 μL,模板 cDNA5 μL,ddH2O18 μL 混匀后瞬时离心。PCR反应条件:94℃预变性5 min;95℃变性50 s,56℃退火45 s,72℃延伸50 s,30个循环;72℃延伸10 min。取5 μL PCR扩增产物经1%琼脂糖凝胶电泳检测,凝胶成像仪中观察,确定所扩增片段大小。
1.10 PCR产物纯化回收、克隆及测序 取PCR扩增产物电泳切胶后,按照DNA凝胶回收试剂盒回收PCR产物。取胶回收RT-PCR产物连接到pGEMT载体上,再转化至DH5α大肠杆菌感受态细胞中得到重组菌,挑取白色单菌落,进行PCR鉴定,阳性菌落摇菌,提取质粒。样品送北京金锘锐杰基因科技有限公司测序。
1.11 序列分析 测序结果在NCBI中进行Blastn,利用DNAStar软件对BCV-Aks-01株与GenBank参考株N基因的核苷酸及氨基酸同源性进行比较分析,并绘制N基因遗传进化树。
2 结果与分析
2.1 临床症状、病理变化 病牛表现体弱消瘦,初期有轻度发热,后期体温变低。厌食,精神沉郁,水样腹泻,粪便为淡黄色或乳白色带有黏液。病理剖检,可见肠系膜淋巴结肿大,肠道黏膜脱落。抗生素治疗无效,严重者出生一周内死亡。
2.2 病毒分离结果 病毒接种于HCT-8细胞第1代未出现CPE变化,第4代后开始出现单层细胞大小不一的空洞,细胞变圆呈拉网状,形成漂流体(图1,a),而对照组则无CPE出现(图1,b)。
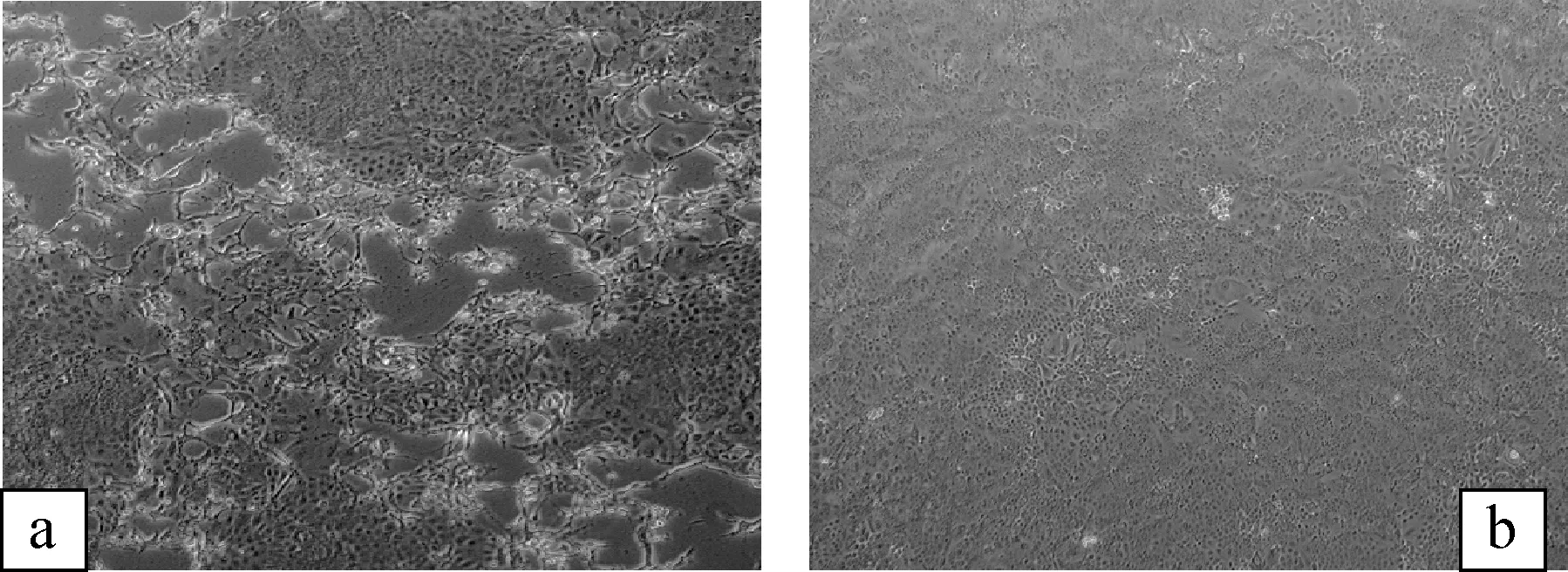
图1 BCV分离培养
2.3 RT-PCR扩增结果 出现CPE的细胞培养物经提取RNA,采用冠状病毒N基因特异性引物(BCVP1/BCVP2),RT-PCR扩增,电泳得到730 bp大小的片段,与预期的目的片段大小相符(图2)。
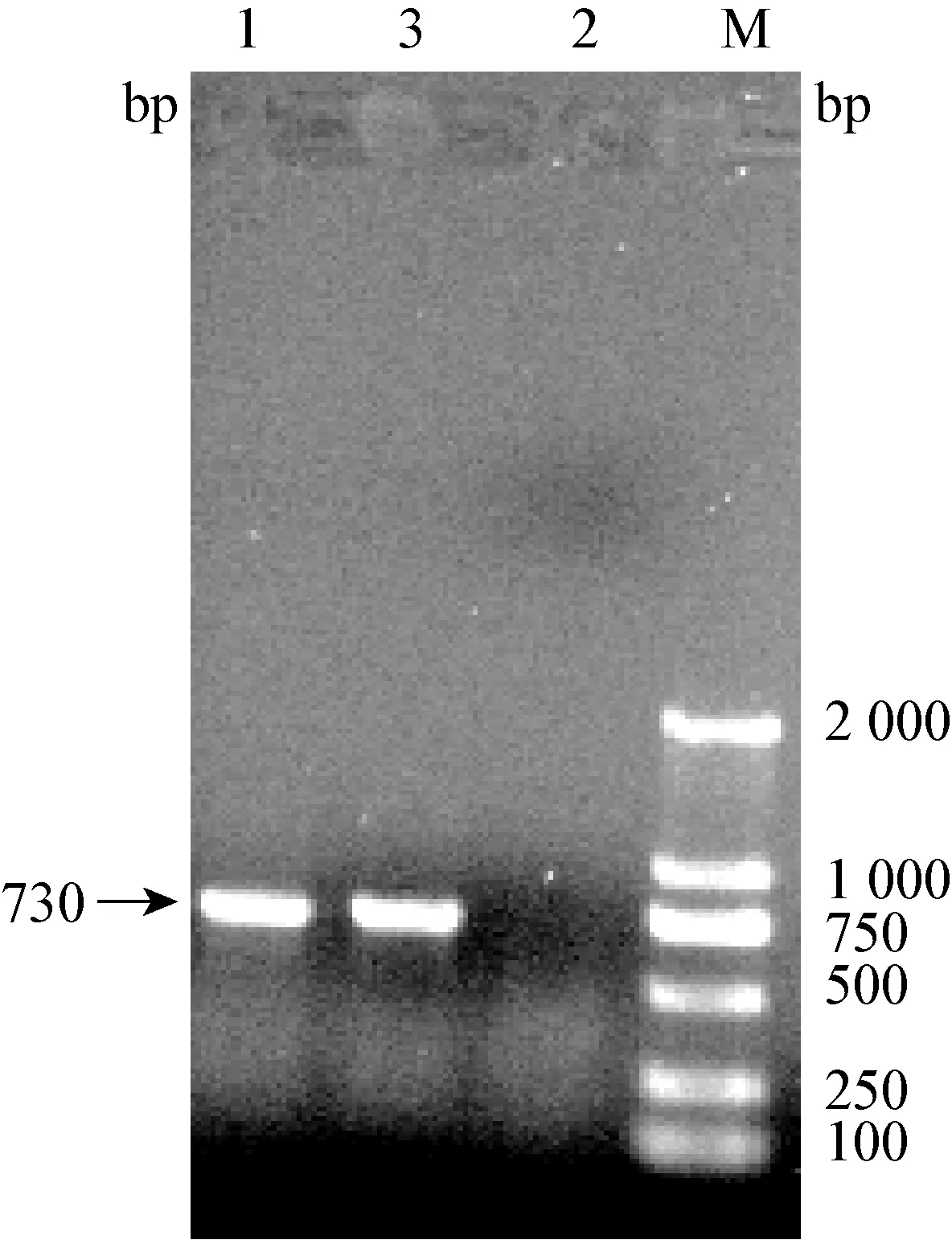
图2 BCV-Aks-01株的RT-PCR鉴定
2.4 BCV-Aks-01株N基因核苷酸同源性分析 应用DNAStar软件,将下载的15个冠状病毒科参考株N基因与BCV-Aks-01株的N基因片段进行核苷酸同源性比较(见表1)。结果显示,BCV-Aks-01片段与下载BCoV毒株的N基因核苷酸同源性为97.5%~98.6%,同BCoV参考毒株 Mebus同源性为97.8%,与国内 BCoV-YC(中国/2006,牛,FJ556872.1)、BCoVHLJ14(中国/2014,牛,KM985634.1)核苷酸同源性分别为97.5%、97.9%。而与其他参考序列相比,核苷酸同源性不足50%。将本试验所得测序序列提交到NCBI中 GenBank,获得登录号:KT247647.1,命名为BCV-Aks-01。
2.5 BCV-Aks-1N基因遗传进化树分析 根据冠状病毒N基因序列核苷酸同源性比较分析,构建BCVAks-1株与冠状病毒科参考株N基因遗传进化树,如封二彩版图3所示。BCV-Aks-1与BCoV-YC、BCoVHLJ14、BCoV-F04(法国/2008,牛,KT318086.1)、BCoV-V270(德国/2006,牛,EF193074.1)、BCoVMebus(Mebus/2003,牛,U00735.2)、BCoV-Quebec(加拿大/1999,牛,AF220295.1)、BCoV-0502(韩国/2008,牛,EU401981.1)、BCoV-DB2(美国/1983,牛,DQ811784.2)毒株亲缘关系均较近,属于Betacoronavirus;而 MCoV-HKU13(中国香港/2015,文鸟,NC011550.1), 属于 Deltacoronavirus;IBVBeaudette(英国/2002,鸡蛋,M95169.1)、TCoV-ATCC(美国/2008,鸡蛋,EU022526.1)、BWCoV-SW1(美国/2008,白鲸,EU111742.1),属于 Gammacoronavirus;FCoVVR2202(美国/1979,猫,DQ010921.1)、TGV-MAD(美国/2005,猪,AJ271965.2)、CCoV-NTU336(中国台湾/2010,犬,GQ477367.1),属于 Alphacoronavirus。
3 讨论
牛冠状病毒是致犊牛腹泻的主要病原之一,呈世界性分布。1972年美国的Mebus等[2]在新生犊牛腹泻粪便中首次检出BCoV。国内学者亦报道我国有BCoV的存在。1985年宋广林[3]等采用电镜在犊牛腹泻样本中检测到BCoV存在。姚火春[4]等(1990)在我国牛群中使用血凝抑制试验检测牛冠状病毒杭体,阳性率为80.2%,BCoV在我国普遍存在,同时也证实新疆 BCoV也存在。胡传伟[5]等(2006)在东北三省进行冠状病毒血清学调查,BCoV抗体阳性率100%。
新疆南疆某规模牛场新生犊牛出现水样性腹泻为主的症状,本研究结合新疆南疆某牛场犊牛腹泻发病情况、发病特征、病理变化,对腹泻死亡犊牛的肠内容物采用HCT-8细胞上盲传4代后出现细胞病变,收获细胞培养物。以冠状病毒N基因设计特异性引物,RT-PCR检测,证实该牛场犊牛存在牛冠状病毒感染。由于该病毒的样本来源于病死犊牛的肠内容,牛轮状病毒与冠状病毒常混合感染。为了鉴别诊断牛冠状病毒是否与其他病毒混合感染,本研究同时应用了牛轮状病毒、牛病毒性腹泻-黏膜病毒的特异性引物进行了RT-PCR鉴别诊断,未获得目的片段。说明该病死犊牛感染冠状病毒,而未有牛轮状病毒、牛病毒性腹泻-黏膜病毒混合感染的现象。张坤[6]等(2015)开展的新疆北疆部分地区规模化奶牛场致犊牛腹泻冠状病毒的分子流行病学调查,也证实北疆地区规模牛场腹泻犊牛存在牛冠状病毒感染。上述分析说明在新疆地区规模牛场存在牛冠状病毒感染的情况。
根据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)第九次报告中确立的冠状病毒分类地位,冠状病毒为套式病毒目(Nidovirales),冠状病毒科(Coronaviridae)。该科下又分为冠状病毒亚科(Coronavirinae)和环曲病毒亚科(Torovirinae)。冠状病毒亚科进一步分为Alpha-、Beta-、Gamma-以及新假定的属Deltacoronavirus共4大类[7]。通过对冠状病毒N基因核苷酸同源性、遗传进化树的比较及分析,BCV-Aks-01株与参考毒株 BCoV-YC、BCoV-HLJ14、BCoVF04(法国/2008,牛,KT318086.1)、BCoV-V270(德国/2006,牛,EF193074.1)、BCoV-Mebus(Mebus/2003,牛,U00735.2)、BCoV-Quebec(加拿大/1999,牛,AF220295.1)、BCoV-0502(韩 国/2008,牛,EU401981.1)、BCoV-DB2(美国/1983,牛,DQ811784.2)均属于Betacoronavirus。
本研究在病毒分离的基础上[8],采用RT-PCR方法进行病毒检测,提高了鉴定的准确性。为新疆南疆地区规模牛场感染牛冠状病毒病综合防控的制定提供了重要参考依据,也丰富了新疆牛冠状病毒分子流行病学资料。
参考文献:
[1] Woods R D,Wesley R D.Transmissible gastroenteritis coronavirus carrier sow[J].Adv Ecp Med Biol,1998,440:641-647.
[2] Mebu s C A,St air E L,Rhodes M B.Pathology of neon at al cal f diar rhea induced by a coron aviru s-l ike agent[J].Vet Pathol,1973,10:45-64.
[3] 宋广林,董惠兰,滕庆,等.犊牛流行性腹泻病原研究[J].畜牧兽医学报,1985,16(2):121-122.
[4] 姚火春,杜念兴,徐为燕,等.牛冠状病毒的血清流行病学调查[J].南京农业大学学报,1990,13(2):117-121.
[5] 胡传伟,贾赟,简中友,等.东北三省冠状病毒流行病学调查[J].黑龙江畜牧兽医,2006,12:88-89.
[6] 张坤,剡根强,王静梅,等.新疆北疆部分地区致犊牛腹泻冠状病毒的分子流行病学调查[J].中国兽医科学,2015,45(12):1 270-1 276.
[7] Virus taxonomy,classification and nomenclature of viruses:ninth report of the International Committee on Taxonomy of Viruses.San Diego,CA:Academic Press,2012.
[8] 关新,朴范泽,侯喜林.牛冠状病毒的分离鉴定[J].黑龙江八一农垦大学学报,2007,19(2):55-58.

