超声波协同酶解法提取啤酒花黄酮类的工艺优化及其抗氧化试验
王如意,李 根,姜 柳,乔 桢,倪 萍,舒 刚
(四川农业大学动物医学院,四川 成都 611130)
啤酒花俗称蛇麻花,是一种多年生草本蔓性植物,主要分布于北纬32°、60°之间的区域,在欧洲、亚洲和北美的分布较为集中[1]。目前已从啤酒花中分离、鉴定了400多种化合物,其中主要成分包括:α-酸、β-酸、啤酒花精油、总树脂、多酚类以及黄酮类等化合物[2]。
黄酮类化合物是一种具有多种生理功能的生物活性物质,具有抑菌、消炎、抗过敏、抗肿瘤、抗氧化[2]等作用,能够在一定程度上增强机体的免疫能力,抑制肿瘤细胞的扩散,延缓机体抗氧化、抗衰老,消除机体炎症,增强心血管的功能等[3]。因此对黄酮类化合物的研究已成为当今天然植物药物中的研究热点。
酶解法是用酶类对植物的细胞壁进行水解,破坏植物的细胞壁结构,减少提取阻力从而提高黄酮类化合物的提取率。王晓[13]等用果胶酶和纤维素混合酶对山楂叶进行酶解后再提取,总黄酮产量提高了16.9%。目前利用超声波法协同酶解法应用于啤酒花总黄酮的提取研究尚未见报道,本文探究了啤酒花总黄酮的超声波法协同酶解法提取工艺,同时测定提取出的啤酒花总黄酮的抗氧化性,以期为该资源的进一步开发提供科学依据。
1 材料与方法
1.1 试验试剂与仪器 啤酒花,氧化钠,纤维素酶140万U/g,DPPH,维生素C。
1.2 试验仪器 UY-2000型紫外可见分光光度计,JJ224BC型精密天平,4型电热鼓风干燥机,HH-4型数显恒温水浴锅,PB-10型酸度计,PSG60型超声波清理器,SC-3614型低速离心机。
1.3 方法
1.3.1 试验样品处理方法 将啤酒花放置在50℃烘箱中烘烤3 h,待干燥后再将药材放入配制好的乙醇溶液中浸泡。
1.3.2 样品中总黄酮含量及黄酮提取率的测定方法 采用亚硝酸钠-硝酸铝比色法。
1.3.3 酶解协同超声波法提取啤酒花黄酮工艺设计 将啤酒花放入1∶25的60%乙醇中浸泡,并添加纤维素酶2 mg/g进行酶解2 h,经40 kHz的超声波处理30 min,静止30 min后进行抽滤,为不影响吸光度法的应用,将滤液以3 000 r/min离心15 min,最后再测其黄酮含量。
1.4 提取啤酒花黄酮条件的优化 通过设计正交试验对提取条件进行优化研究,确定最佳工艺条件和最佳得率。每个处理需要重复几次,取其平均值进行分析。
1.5 啤酒花黄酮抗氧化性指标的检测
1.5.1 啤酒花黄酮对二苯代苦味酰基自由基(DPPH)自由基的清除作用 采用DPPH清除法,对啤酒花黄酮的抗氧化性进行测定。
1.5.2 啤酒花黄酮对·OH自由基的清除作用采用·OH自由基清除法,对啤酒花黄酮的抗氧化性进行测定。
2 结果与分析
2.1 以吸光度值(A)为纵坐标,芦丁浓度(C)为横坐标,绘制标准曲线,得回归方程:y=0.0108x+0.0104(R2=0.9961),表明芦丁浓度与吸光度有良好的线性关系,并用亚硝酸钠-硝酸铝比色法测定啤酒花黄酮的含量,进而计算啤酒花总黄酮得率。
以酶解时间(1.5 h、2 h、2.5 h),酶解温度(40 ℃、45 ℃、50 ℃),酶解 pH 值(3.5、4.0、4.5)为三因素正交试验设计,试验结果表1。
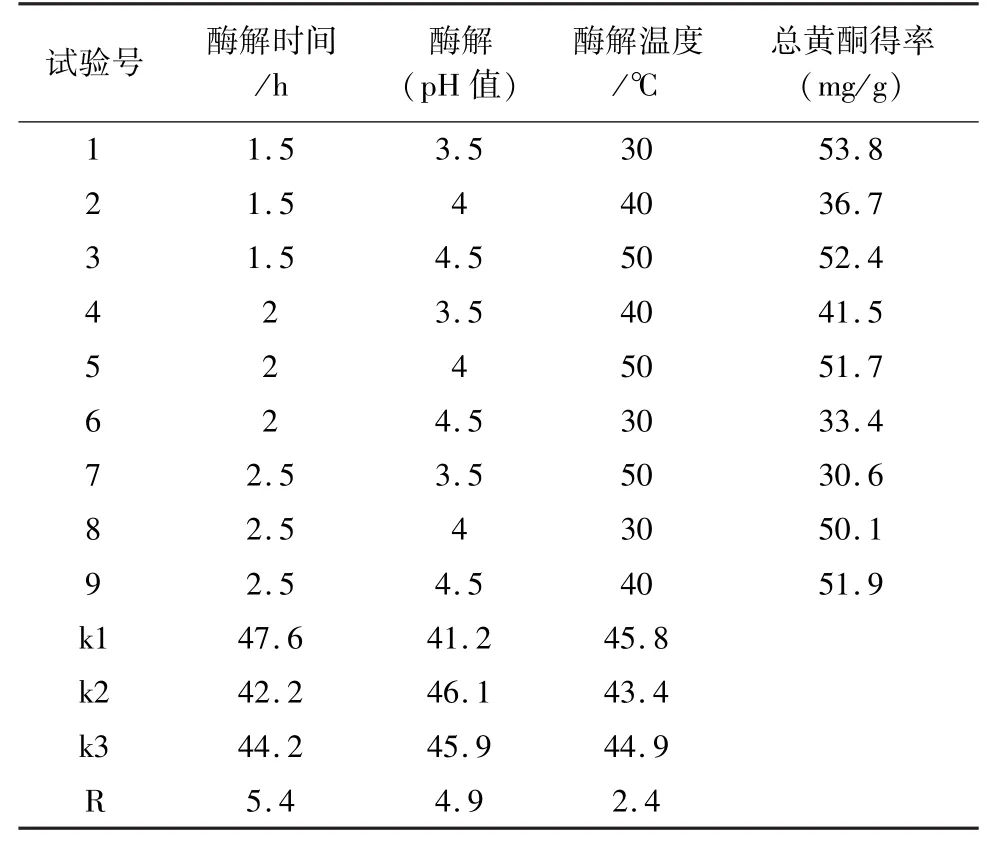
表1 正交实验结果
将最佳工艺重复3次提取啤酒花黄酮,总黄酮最高总得率为55.7(mg/g),超声波协同酶解法可以有效地提取啤酒花中的黄酮类物质,由正交试验设计结果可知,影响黄酮提取效果的3种因素中,其对得率的影响因素大小排序依次为酶解时间>酶解pH值>酶解温度。最佳的提取工艺为在pH值为4,酶解温度为30℃的情况下酶解时间1.5 h,最高的总黄酮得率为55.7(mg/g)。
2.2 抗氧化活性测定 随着啤酒花总黄酮浓度的提高,对DPPH清除效果明显提高。当质量浓度为2 mg/mL时,清除率达94.3%。啤酒花总黄酮对·OH有较好的清除能力。在质量浓度为2 mg/mL时,其对·OH的清除率可达89.3%。
3 结论与讨论
本试验着眼于啤酒花中黄酮类化合物提取工艺的优化,首次利用超声波协同酶解法提取啤酒花中黄酮类物质,相比于传统的有机溶剂浸渍法,例如用乙醇提取啤酒花黄酮可达38.5 mg/g,本研究中建立的方法大大的提高了黄酮类物质的提取率,总黄酮得最高的率可达55.7 mg/g。因超声波协同酶的作用更易将细胞内物质释放出来,提高了有效成分的得率,所以此类方法亦可应用于植物中其他化合物的提取,提高提取效果。
在本试验中,当啤酒花总黄酮质量浓度为2.0 mg/mL时,对·OH和DPPH清除效果较好,分别为89.3%和94.3%,抗氧化性与维生素C接近。
在本试验中只是提取工艺以及抗氧化活性初步研究[11],啤酒花的其他部位包括叶及其枝蔓有效成分的活性有待开发和研究。随着医学的不断创新和发展,学者们对啤酒花的研究也越来越深入[14],其良好的药理功能也逐渐被人们了解。我们将进一步探究将啤酒花黄酮加入油脂后的抗氧化功效,试图将其应用为一种新型的天然油脂抗氧化剂,为啤酒花黄酮类化合物的开发利用提供了理论依据,预示着黄酮类化合物必将成为啤酒花领域的研究热点。
参考文献:
[1] 陈旭健,张原琪.红菇多糖的提取及其降血糖、血脂的作用研究[J].食品科学,2010,31(9):255-258.
[2] 刘玉梅.啤酒花的分析评价及六氢蛇麻酮类的合成与应用[D].江苏,江南大学,2007.
[3] 周娟,邹翔,季于彬,啤酒花有效成分及活性研究[J].食品科学,2009,30(3):521.
[4] 刘玉梅,唐坚,刘奎钫.啤酒花的化学研究及其和啤酒酿造的关系[J].酿酒科技,2006,14(2):71.
[5] 肖小年,吴凌伟,范青生.啤酒花浸膏及其异构化衍生物抗食品腐败的初步研究[J].天然产物研究与开发,2001,13(4):47-50.
[6] 胡春.黄酮类化合物抗氧化活性[J].中国油脂,1996,21(4):18.
[7] 汪秋安.天然黄酮类化合物的生理功能及其应用[J].香料香精化妆品,1999(1):28-33.
[8] 李莉,刘成梅,田建文,等.现代提取分析技术在黄酮类化合物中的应用[J].江西食品工业,2006(4):42-44.
[9] 高文秀,祝波,王亚红.酶解法协同超声波法提取山楂中总黄酮的工艺条件优化[J].江苏农业科学,2013,14(3):252.
[10] 郭鑫磊.啤酒花黄酮类化合物提取及其抗辐射活性研究[J].天津科技大学学报,2009,7(12):25.
[11] 雷静.啤酒花黄酮的提取、浓缩及储藏性研究[D].乌鲁木齐:新疆农业大学2010.
[12] 舒翔,雷静,李永春,等.啤酒花黄酮抗氧化活性的提取工艺研[J].中国食品添加剂,2011(02):198.
[13] 李姣娟,戴瑜,周尽花,等.川桂叶总黄酮对油脂抗氧化作用的研究[J].中南林业科技大学学报2011,31(10):134.
[14] 穆同娜,张惠,景全荣.油脂的氧化机理及天然抗氧化物的简介[J].食品科学,2004,25(24):241-244.

