肾周脂肪对微创肾部分切除术影响的新认识
李松 常泰浩 张瑞珊 陈仕洋 乔宝民△
1天津医科大学第二医院泌尿外科 300211 天津 2天津市儿童医院小儿外科 △审校者
1 引言
临床上对肾肿瘤直径<4 cm的患者行肾部分切除术(partial nephrectomy, PN)已经成为其首选的手术方法[1]。随着微创技术的发展,后腹腔镜肾部分切除术(retroperitoneal laparoscopic nephrectomy, RLPN)或机器人辅助腹腔镜肾部分切除术(robot-assisted partial nephrectomy, RAPN)已成为推荐的手术方式,被我国泌尿外科医生广泛接受。国外学者以肿瘤的解剖特点为基础,提出了许多评分系统来预测手术难度,如R.E.N.A.L.评分及PADUA 评分等[2, 3]。然而这些评分系统仅仅考虑了肿瘤特异性因素,未涉及患者相关因素,如肾周脂肪情况, 但是我们不能忽视患者肾周脂肪对肾部分切除术术中及术后相关指标的影响。肾周脂肪厚度和肾周粘连脂肪(adherent perinephric fat, APF)极大地影响了肾部分切除术过程中肾肿瘤的暴露,因此根据这两方面特征指标,Davidiuk 等[4]2014年提出了一种科学的肾周脂肪评估系统, 并命名为MAP评分系统。本文结合国内外相关文献,现根据肾周脂肪厚度、肾周脂肪粘连及MAP评分系统对微创肾部分切除术的影响进行系统综述。
2 腹内脂肪影响因素
随着肥胖患者数量的不断增加,了解肥胖与手术复杂性及手术并发症的关系是非常重要的。BMI是最常用的指标,在临床实践中,BMI通常用作来预测手术并发症风险的一项粗略指标。过高的BMI与较长的手术时间(P=0.051)和转为开放或肾切除术风险(P=0.030)相关[5]。然而,多项研究 表明BMI与微创肾部分切除术的复杂性不相关[6, 7]。虽然BMI是对人体肥胖可量化的指标,但是它不是测量人体脂肪的理想指标。Park等[8]研究指出BMI并不与内脏脂肪分布相关,因此把肥胖划分为躯干、皮下及内脏的分布可以更好地评估人体脂肪组织对微创肾部分手术的影响。与单纯的BMI测量相比,内脏脂肪的分布可能是预测并发症的重要因素,这种假说已经在普通外科文献中得到了证实,并且报道腹腔内脂肪(intra-abdominal fat, IAF)是独立于BMI和外腹部脂肪(out-abdominal fat, OAF)的预测手术并发症的指标[8]。
3 肾周脂肪因素
3.1 肾周脂肪厚度因素
肾周脂肪被称作腹内脂肪,在微创肾部分切除术中,特别是在游离肾门、切除肿瘤及止血等关键过程中,过多的肾周脂肪往往导致手术视野暴露不佳,使术中出血、假性动脉瘤的形成和尿渗漏等手术特异性并发症的风险增加[9]。与BMI、腹外脂肪相比,腹内脂肪是一个预测PN手术复杂程度的一个独立影响因素,在相关的研究中,腹内脂肪的指标是可以通过测量肾周脂肪厚度将其量化,这是一个优于腹外脂肪和BMI的指标[10~12]。腹内脂肪使外科手术难度增加,影响手术预后,在普通外科领域于2008年已有报道,House等[13]在Memorial Sloan-Kettering癌症中心发现20 mm的IAF与较长的胰腺切除术手术时间和术后并发症(51%vs. 31%,P<0.001)有关;另外,Morris等[14]在最近的一项研究中发现IAF可预测肝脏术后住院天数(系数0.01,95%CI 0.005~0.02,P=0.001)、Ⅲ级或更高的并发症(OR 1.05,95%CI 1.02~1.07,P<0.001)和30 d死亡率(OR 1.09,95%CI 1.03~1.16,P=0.004);在泌尿外科领域,2008年Anderson等[15]报道在肾移植供体肾切除术中肾周脂肪厚度与手术时间存在关联。
随着腹腔镜技术的飞速发展,RLPN术已成为治疗早期肾肿瘤的标准手术方法。由于RLPN术中花费大部分时间游离肾门血管,暴露肿瘤,而切除肿瘤(即热缺血时间)时间占手术时间比例较小,故肾周脂肪厚度成为了影响手术时间的主要影响因素。国内一项回顾性研究分析了84例由同一位外科医生完成的RLPN患者,平均手术时间为(143.93±60.11)min,平均热缺血时间为(24.44±7.68)min,84例中23例(27.4%)在术后30 d内出现了不同程度的并发症,其中ClaveinⅠ~Ⅱ级并发症共17例0.7%),6例(6.7%)为Ⅲ~Ⅳ级并发症;肾周脂肪厚度是手术时间的独立影响因素(P<0.001)[16]。另外,肾周脂肪厚度对于热缺血时间价值有限,主要由于阻断肾动脉和切除肿瘤前,大多数外科医生都已尽可能地游离肾周脂肪以达到较好的手术视野,故在热缺血时间方面,肾周脂肪厚度对于手术的影响较小。
与普通后腹腔镜手术相比,RAPN是一种安全、有效的治疗局限性肾肿瘤的术式,肾周脂肪厚度可以作为RAPN手术复杂性的重要预测因子。Mcleodl等[12]指出在接受RAPN的53例患者中,肾周脂肪厚度与增加估计失血量(estimated blood loss, EBL)和手术时间独立相关,对于内侧肾周脂肪每增加1 mm,EBL增加24 ml(95%CI 13~34 ml),手术时间增加3.3 min(95%CI 1.0~5.7 min),对于后肾周脂肪每增加1 mm,估计的失血EBL和手术时间增加为19 ml(95%CI 8.1~30 ml)和3.3 min(95%CI 1.0~5.6 min),而腹壁脂肪与手术时间或EBL不相关。在Michael等[9]对257名接受了RAPN患者的研究中,共有52例(26.7%)患者在手术30 d内出现Clavien Ⅰ~Ⅳ级并发症,其中18例(34.6%)为Ⅲ~Ⅳ级,在多变量分析中, IAF的增多(OR 1.05 [95%CI 1.02~1.09],P=0.005)与Ⅰ~Ⅳ级并发症和高级并发症相关,而IAF(OR 1.05 [95%CI 1.00~1.10] 04)和中度至高度肿瘤复杂性(OR 5.31 [95%CI 1.47~19.17],P=0.01)与Ⅲ~Ⅳ期并发症相关,当与RENAL评分联合使用时,IAF可能会对R.E.N.A.L.的预测价值进行补充;另外,肾周脂肪厚度对于 RLPN热缺血时间和术后并发症发生率以及严重程度的预测作用有限,需要结合肾周脂肪黏稠程度进一步研究。
3.2 肾周脂肪粘连因素
APF可以被定义为粘附于肾实质周围的炎性脂肪。关于APF的发病机制尚不清楚,纤维化、自身免疫及炎症反应等因素可能参与了上述过程[12, 17]。随着肾周脂肪研究的深入,国内外许多研究不仅仅探讨肾周脂肪厚度,还进一步探讨了肾周脂肪粘连程度。Davidiuk等[4]提出肾周粘连脂肪概念,并给出梅奥粘连评分可用于预测肾周脂肪粘连程度。Zheng等[18]研究表明在腹腔镜肾部分切除术中,影响剥除肾周脂肪时间的因素包括肾周脂肪厚度和粘连程度,肾周脂肪粘连不仅仅影响 LPNH和RPN手术中暴露肿瘤、游离肾门血管的时间,也会在剥除中损伤肾包膜或附近血管,影响手术预后。所以对肾周脂肪粘连进行术前评估是 RLPN和RAPN关于肾周脂肪相关研究中的一个新的方向。
在RLPN和RAPN术中,如果存在APF,游离肾脏并暴露肿瘤和肾血管是具有挑战性的[19]。然而,微创手术固有的技术复杂性所带来的并发症风险也很高[20],特别是RAPN在技术上要求苛刻,所以术前预测APF的存在是有价值的。一些研究结果表明[21]肾周脂肪粘连多见于高龄、男性,且合并高血压、糖尿病的患者;相对于无粘连组,粘连组手术时间更长 [(146.08± 45.45)vs.(119.32±28.83)min,P=0.017],术中出血量更多 [(82.92±45.73)vs.(51.79±25.10)ml,P=0.005]。实际上,由于APF存在导致血管损伤和肿瘤暴露的困难,外科医生不得不转为开放手术以获得更好的手术视野暴露,肾周脂肪粘连严重甚至行根治性肾切除术。分析其原因可能为:①硬化、粘连的肾周脂肪较难分离,找寻肿瘤及辨认肿瘤边界所需时间较长,从肾实质上游离紧实厚密的肾周脂肪粘连导致较多的被膜剥脱 ;②肾周脂肪内有较多微小血管,具有易出血的特点,当其周围一些血管发生炎性反应,在肿瘤暴露时引起继发性出血[9]。
Zine-Eddine等[22]为了评估APF对机器人辅助部分肾切除术(RPN)的技术难度的影响,分析了202例接受RAPN治疗肾肿瘤的患者的临床数据,其中有80例患者被发现有APF(39.6%),与非APF组相比,APF组手术时间延长40 min(188.5vs. 147.9 min,P<0.000 1),失血量高两倍,输血在APF组中更常见(694对330 ml,P<0.000 1和19对5.8%,P=0.003);在多变量分析中,男性、肥胖、高血压和MAP评分是APF的重要预测因素。另外,该研究结果还表明术中转换为开放性手术(11.2%vs. 0%,P=0.000 2)或根治性肾切除术(6.2%vs. 0.8%,P= 0.03)的风险增加。与Zine-Eddine等研究的结果相似,Neil等[23]在研究了245名进行微创肾部分切除(RLPN和RAPN)的患者后指出, APF与围手术预后相关,这其中包括更长的手术时间(P= 0.005)和更大的预计失血量(EBL;P=0.025),预测APF的因素包括年龄(P=0.001)、男性(P= 0.045)、肾周脂肪粘连(P=0.002)、脂肪厚度(P<0.001)和MAP评分(P<0.001)。虽然APF患者的EBL较大,约为50 ml,如果由经验较少的外科医生或在教学机构接受培训的外科医生执行,则术中额外失血风险将大大增加,而术中出血增加可能会混淆手术视野,导致手术解剖平面不清晰,进一步延长手术时间;另外,APF也与RCC恶性肿瘤组织学有关,其机制尚不清楚,但某些RCC恶性肿瘤可能会引起肾周脂肪发生炎症变化[22]。
4 MAP评分系统的建立
为了客观准确地预测肾部分切除术中APF的存在,提高机器人辅助肾部分切除术(RNPN)手术难度的可预测性, Mayo医学中心Davidiuk 等[4]进行了一项前瞻性研究,单因素分析结果表明:性别、BMI、肾周脂肪厚度、肾周脂肪纤维条索状改变与肾周脂肪粘连相关;进一步多因素统计分析得出: 肾脏后侧脂肪厚度和肾周脂肪在影像学上的条索状改变两个因素能很好地预测肾周脂肪情况,因此,作者制定了一个全新的基于影像学的评分系统即(Mayo Adhesive Probability, MAP) 评分系统。它包含两个方面 ,①肾周脂肪厚度: 肾脏后侧脂肪厚度是根据Eisner等[24]研究的方法测得的,为影像学上患肾肾静脉水平,肾包膜到腹腔后壁的直线距离(图1)。具体评分为:<1.0 cm为 0分;1.0~1.9 cm 为1分;≥2.0 cm为2分。有研究表明,IAF可以通过测量肾周脂肪厚度将其量化, 这是一个优于腹外脂肪和BMI的指标,也是MAP评分中将肾周脂肪厚度列入评分标准的理论基础[5~7]。 ②肾周脂肪在影像学上的条索状改变: 肾周脂肪在影像学上的条索状改变是根据 Kim等[25]最早研究出的方法测得的,肾周脂肪受累情况即肾周脂肪在影像学上的条索状改变,可以分为三度(图2):无条索状改变评分为0分;中度(1型)为肾周脂肪存在条索状改变,但没有较粗、 较杂乱的条索状改变, 评分为 2 分 ; 重度(2型)为肾周脂肪存在粗大、杂乱的条索状改变,评分为3分。MAP最终评分是把上述两项相加得来。多项研究表明 MAP评分能有效的预测 PN 中肾周脂肪粘连的可能性 ,从而对微创PN的复杂程度进行评价,这具有重要的临床指导意义。Davidiuk等[4]研究对100例行RAPNs进行了一项回顾性研究指出,为预测APF的存在,把MAP分值分为0~5,我们在MAP评分为0的患者中观察到6%的患者存在APF, 1分的概率为16%,2分为31分,3~4分为73分,5分为100%。MAP评分是APF的一个量化指标,与既往评分相比,一是它能够用现有的影像学资料简单测量出来,并且易于计算;二是它仅仅应用两个影像学指标就能够完成评估。
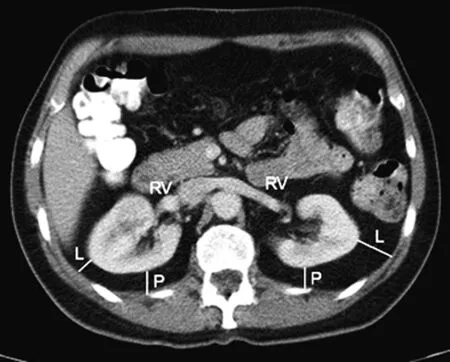
RV:肾静脉;L:肾外侧脂肪;P:肾后侧脂肪。
图1肾周脂肪厚度的测量
MAP评分可以评估肾周脂肪粘连,有助于预测手术难度及围手术期并发症,另外,约有30%的行RAPN的患者存在APF[22]。Martin等[26]进行的一项回顾分析表明:对于放射学检查的单变量分析来看,侧向和后部脂肪厚度、P<80 HU脂肪面积和MAP分数是APF的预测因素;但是, 在多变量分析中,只有年龄和MAP分数具有统计学意义(OR:1.060[1.005,1.118],P=0.03;和OR:1.560[1.137,2.139],P=0.0058);肾周脂肪粘连和脂肪厚度是APF的半定量预测因子,但是将这两个变量组合而成MAP分数系统更进一步增加了评估APF的准确性。蔡超等[1]研究了78例行后腹腔镜肾部分切除术患者,通过所有患者术前的CT结果给予MAP评分,根据该评分分为MAP低评分组(0~1分)、MAP中评分组(2~3 分)、MAP高评分组(4~5分)。对MAP评分和手术相关临床指标及术后相关并发症相关性进行研究,该结果表明:在后腹腔镜下肾部分切除术中,MAP评分与手术时间、术中出血、住院时间和术后并发症相关,而与肾热缺血时间、肿瘤大小无明显相关性。
此外,MAP评分与局部肾癌无进展生存相关,David等[27]进行的一项前瞻性研究表明证实肾周炎症(肾周脂肪粘连)与肾细胞癌患者预后相关,与MAP分值较低(0~3)的患者相比,高MAP评分(4~5)可能降低局部RCC术后的PFS, RCC侵袭性可能与肾周脂肪厚度和脂肪粘连有关,该研究认为大量肾周脂肪可诱导慢性炎症,具体表现为肾周脂肪粘连,并进而会使癌症患者的预后较差。另外,脂肪组织是体内最大的内分泌器官,内脏脂肪可分泌的众多细胞因子和生物活性分子,如IL-6和血管内皮生长因子[8, 28~30],并且在诱导炎症和血管生成中发挥重要作用[8, 31, 32],过高的内脏脂肪与代谢活性较低的脂联素相关,而脂联素代谢活性较高,与乳腺癌、前列腺癌及肾脏肿瘤的发病率呈负相关[28, 33, 34]。虽然有关癌症侵袭性相关的肾周脂肪或内脏脂肪肥胖的直接机制仍不明确,但是人体内许多循环炎症标志物,如中性粒细胞淋巴细胞比率、C-反应蛋白和血浆纤维蛋白原,被反复报道与肾癌患者预后不良有关[35]。
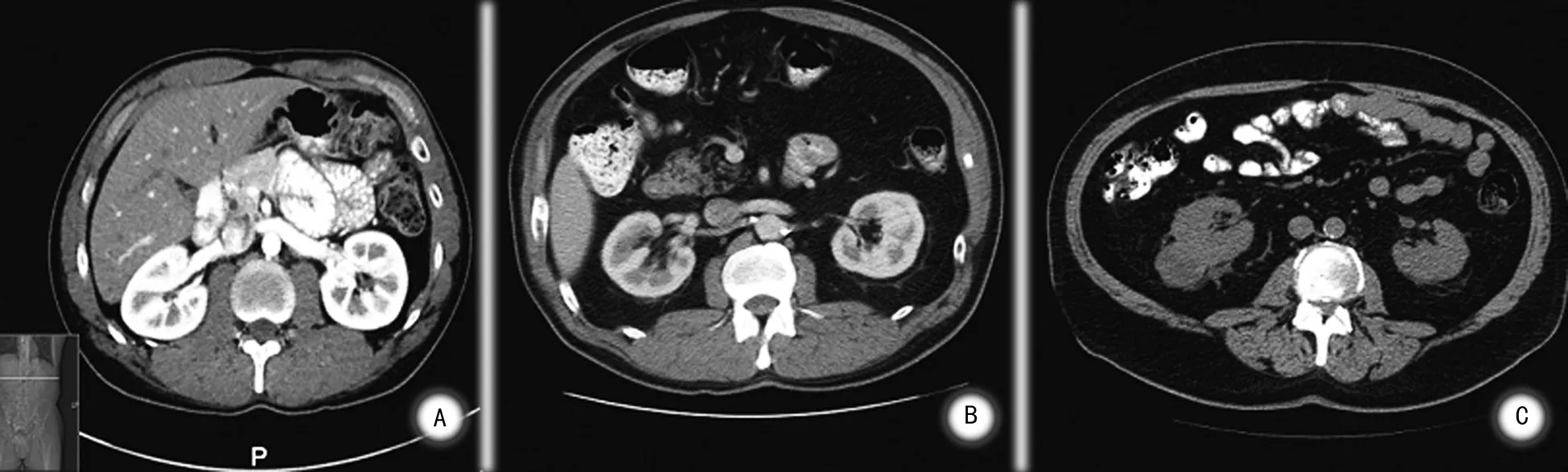
A: 无受累 0分 ;B: 中度 (1型) 2分 ; C:重度 (2型) 3分。
图2肾周脂肪在影像学上的条索状改变的分度
5 总结与展望
相对于BMI,肾周脂肪是对人体内脏肥胖可量化的指标,由于肾周脂肪厚度和粘连,在微创肾部分切除术中,使得肾脏的游离和肿瘤的暴露变得更加困难,增加手术操作难度,影响围手术期预后。根据肾周脂肪厚度和粘连两方面特征指标所提出的MAP评分系统是其量化的指标,MAP评分能有效的预测RLPN和RAPN中肾周脂肪粘连情况,从而对微创肾部分切除术的复杂程度进行评价,具有重要的临床指导意义。另外,是否需要将 MAP评分进行改良,形成一个更适合于中国国情的MAP评分亦有待进一步研究证实。
[参考文献]
[1] 蔡超,钟缔,龙其成,等.MAP肾周脂肪评分在肾部分切除手术中的运用. 实用医学杂志,2015,31(24):4037-4040.
[2] Ficarra V, Novara G, Secco S, et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur Urol, 2009,56(5):786-793.
[3] Long JA, Arnoux V, Fiard GA, et al. External validation of the RENAL nephrometry score in renal tumours treated by partial nephrectomy. BJU Int, 2013,111(2):233-239.
[4] Davidiuk AJ, Parker AS, Thomas CS, et al. Mayo adhesive probability score: an accurate image-based scoring system to predict adherent perinephric fat in partial nephrectomy. Eur Urol, 2014,66(6):1165-1171.
[5] Davidiuk AJ, Parker AS, Thomas CS, et al. Prospective evaluation of the association of adherent perinephric fat with perioperative outcomes of robotic-assisted partial nephrectomy. Urology, 2015,85(4):836-842.
[6] Ioffe E, Hakimi AA, Oh SK, et al. Effect of visceral obesity on minimally invasive partial nephrectomy. Urology, 2013,82(3):612-618.
[7] Dariane C, Le Guilchet T, Hurel S, et al. Prospective assessment and histological analysis of adherent perinephric fat in partial nephrectomies. Urol Oncol, 2017,35(2):39.e9-39.e17.
[8] Park YH, Lee JK, Kim KM, et al. Visceral obesity in predicting oncologic outcomes of localized renal cell carcinoma. J Urol, 2014,192(4):1043-1049.
[9] Gorin MA, Mullins JK, Pierorazio PM, et al. Increased intra-abdominal fat predicts perioperative complications following minimally invasive partial nephrectomy. Urology, 2013,81(6):1225-1230.
[10] Isac WE, Autorino R, White M, et al. The impact of body mass index on surgical outcomes of robotic partial nephrectomy. BJU Int, 2012,110(11 Pt C):E997-E1002.
[11] Naeem N, Petros F, Sukumar S, et al. Robot-assisted partial nephrectomy in obese patients. J Endourol, 2011,25(1):101-105.
[12] Macleod LC, Hsi RS, Gore JL, et al. Perinephric fat thickness is an independent predictor of operative complexity during robot-assisted partial nephrectomy. J Endourol, 2014,28(5):587-591.
[13] House MG, Fong Y, Arnaoutakis DJ, et al. Preoperative predictors for complications after pancreaticoduodenectomy: Impact of BMI and body fat distribution. J Gastrointest Surg, 2008,12(2):270-278.
[14] Morris K, Tuorto S, Goenen M, et al. Simple measurement of intra-abdominal fat for abdominal surgery outcome prediction. Arch Surg, 2010,145(11):1069-1073.
[15] Anderson KM, Lindler TU, Lamberton GR, et al. Laparoscopic donor nephrectomy: effect of perirenal fat upon donor operative time. J Endourol, 2008,22(10):2269-2274.
[16] 杜柘彬,张进,孔文,等.肾周脂肪厚度对预测腹腔镜肾部分切除术手术相关因素价值的研究.现代泌尿生殖肿瘤杂志,2016.8(6):341-344.
[17] Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update. Eur Urol, 2015,67(5):913-924.
[18] Zheng Y, Espiritu P, Hakky T, et al. Predicting ease of perinephric fat dissection at time of open partial nephrectomy using preoperative fat density characteristics. BJU Int, 2014,114(6):872-880.
[19] Haseebuddin M, Benway BM, Cabello JM, et al. Robot-asisted partial nephrectomy: evaluation of learning curve for an experienced renal surgeon. J Endourol, 2010,24(1):57-61.
[20] Nisen H, Ruutu M, Glucker E, et al. Renal tumour invasion index as a novel anatomical classification predicting urological complications after partial nephrectomy. Scand J Urol, 2014,48(1):41-51.
[21] 谷军飞,任立新,张勇,等.肾周脂肪粘连对后腹腔镜肾部分切除术的影响.中国内镜杂志,2017,23(5):19-22.
[22] Khene ZE, Peyronnet B, Mathieu RA, et al. Analysis of the impact of adherent perirenal fat on peri-operative outcomes of robotic partial nephrectomy. World J Urol, 2015,33(11):1801-1806.
[23] Kocher NJ, Kunchala S, Reynolds CA, et al. Adherent perinephric fat at minimally invasive partial nephrectomy is associated with adverse peri-operative outcomes and malignant renal histology. BJU Int, 2016,117(4):636-641.
[24] Eisner BH, Zargooshi J, Berger AD, et al. Gender differences in subcutaneous and perirenal fat distribution. Surg Radiol Anat, 2010,32(9):879-882.
[25] Kim S, Choi SK, Lee SM, et al. Predictive value of preoperative unenhanced computed tomography during ureteroscopic lithotripsy: a single institute's experience. Korean J Urol, 2013,54(11):772-777.
[26] Martin L, Rouviere O, Bezza R, et al. Mayo adhesive probability score is an independent computed tomography scan predictor of adherent perinephric fat in open partial nephrectomy. Urology, 2017,103:124-128.
[27] Thiel DD, Davidiuk AJ, Meschia C, et al. Mayo adhesive probability score is associated with localized renal cell carcinoma progression-free survival. Urology, 2016,89:54-60.
[28] Keehn A, Srivastava A, Maiman R, et al. The relationship between visceral obesity and the clinicopathologic features of patients with small renal masses. J Endourol, 2015,29(3):372-376.
[29] Wang Y, Lam KS, Xu JY, et al. Adiponectin inhibits cell proliferation by interacting with several growth factors in an oligomerization-dependent manner. J Biol Chem, 2005,280(18):18341-18347.
[30] Chandran M, Phillips SA, Ciaraldi T, et al. Adiponectin: more than just another fat cell hormone? Diabetes Care, 2003,26(8):2442-2450.
[31] Hanks LJ, Casazza K, Judd SE, et al. Associations of fibroblast growthfactor-23 with markers of inflammation, insulin resistance and obesity in adults. PLoS One, 2015,10(3):e0122885.
[32] Lemoine AY, Ledoux S, Larger E. Adipose tissue angiogenesis in obesity. Thromb Haemost, 2013,110(4):661-668.
[33] Pinthus JH, Kleinmann N, Tisdale B, et al. Lower plasma adiponectin levels are associated with larger tumor size and metastasis in clear-cell carcinoma of the kidney. Eur Urol, 2008,54(4):866-873.
[34] Goktas S, Yilmaz M, Caglar K, et al. Prostate cancer and adiponectin. Urology, 2005,65(6):1168-1172.
[35] Fox P, Hudson M, Brown C, et al. Markers of systemic inflammation predict survival in patients with advanced renal cell cancer. Br J Cancer, 2013, 109(1):147-153.

