金纳米簇增强的化学发光反应及在葡萄糖检测中的应用
孔亚访, 樊爱萍*
(天津大学药物科学与技术学院,天津 300072)
化学发光(Chemiluminescence,CL)分析法是近年来非常活跃的一个研究领域,该方法具有仪器设备简单、操作简便、检测灵敏度高等优点[1]。鲁米诺(Luminol)-H2O2是应用最为广泛的CL体系之一。但在没有催化剂存在下,它们之间的反应缓慢,产生的CL信号较弱。很多物质能催化Luminol-H2O2化学发光反应,包括金属离子[2 - 3]和酶[4]等,但以辣根过氧化物酶(HRP)的应用最为广泛。HRP已被广泛用于H2O2和葡萄糖的检测[5],也被用于构建化学发光免疫分析方法[6]。天然的酶具有分离提纯困难、易失活等缺点。近年来,陆续发现很多纳米微粒具有拟过氧化物酶的活性,如Au纳米微粒[7]、CuO纳米微粒[8]、Co3O4纳米微粒[9]、Ag纳米微粒[10]等都能催化Luminol-H2O2反应。纳米微粒与天然酶相比,具有价格便宜、性质稳定的特点。研究表明,纳米微粒拟过氧化物酶的催化活性受其尺寸大小、结构、形貌和表面修饰等因素影响,粒径小的纳米粒子表面具有更多的活性催化位点,因而具有更高的催化活性。
金属纳米簇是在一定分子层的保护下,由几个到几百个金、银和铂等金属原子所组成的相对稳定的聚集体,其粒径一般小于2 nm,尺寸接近金属电子的费米波长,被认为是连接金属原子和纳米颗粒的桥梁。在研究中,我们发现金纳米簇(Au NCs)能催化Luminol-H2O2化学发光反应,得到增强的CL信号。Au NCs 与其它纳米微粒催化的Luminol-H2O2反应相比,催化Luminol-H2O2产生的是慢化学发光信号。基于此反应,本文发展了简单、方便的化学发光测定H2O2的新方法,并将其应用于葡萄糖的检测。
1 实验部分
1.1 主要仪器与试剂
BPCL微弱化学发光测定仪(中国科学院物理研究所);Carry-100 VARIAN紫外-可见分光光度计(美国,瓦里安公司);F-7000荧光分光光度计(日本,日立公司);H-800透射电镜(日本,日立公司);Zetasizer Nano ZSP粒度分析仪(英国,马尔文)。
牛血清白蛋白(BSA)购自北京鼎国昌盛生物技术有限责任公司,HAuCl4购自天津希恩思生化科技有限公司,葡萄糖氧化酶(GOx,100~250 U/mg)购自上海源叶生物科技有限公司,D -葡萄糖、乳糖、木糖和甘露糖购自北京索莱宝科技有限公司,Luminol购自阿法埃莎(中国)化学有限公司。NaOH、HCl、Na2HPO4·12H2O、NaH2PO4·2H2O、NaCl等试剂均为分析纯,购自天津江天化工试剂有限公司。30%H2O2购自国药集团化学试剂有限公司,三羟甲基氨基甲烷(Tris)购自天津市光复精细化工研究所。磷酸盐缓冲溶液(PBS)(10 mmol/L,pH=7.4):分别称取0.4 g NaH2PO4·2H2O,6 g Na2HPO4·12H2O和9 g NaCl,加水溶解后,定容至1 000 mL。Tris-HCl缓冲溶液(0.1 mol/L):称取1.2114 g Tris,用50 mL超纯水溶解后,用1 mol/L HCl调至所需pH,最后用超纯水定容至100 mL。去离子水由Milli-XQ纯水仪制备。
1.2 Au NCs的制备
采用文献报道的方法[11],制备BSA稳定的Au NCs。将一定体积50 mg/mL BSA和10 mmol/L HAuCl4分别在37 ℃水浴中孵育至恒温后,取2 mL HAuCl4溶液,于磁力搅拌下加入2 mL BSA溶液中,于37 ℃ 搅拌2 min后,加入200 μL 1 mol/L的NaOH溶液,继续搅拌反应24 h,溶液颜色由无色转变为深褐色,则表明形成了Au NCs。得到的产物采用截留分子量为10 000的超滤管超滤至滤液显中性,除去NaOH和未反应的HAuCl4。最终产物,分别采用紫外-可见分光光度法、荧光分光光度法和透射电镜进行表征。为方便计算将其浓度计为1×BSA-Au NCs。于4 ℃冰箱中储存备用。
1.3 H2O2的测定
将50 μL 2.5 mmol/L Luminol溶液(pH=9.0的Tris-HCl缓冲溶液稀释)与50 μL不同浓度H2O2溶液(pH=7.4的PBS稀释)在测量杯中混匀,再向其加入100 μL 1/3×BSA-Au NCs(pH=9.0的Tris-HCl缓冲溶液稀释),同时通过化学发光仪收集并记录反应产生的光强度信号。化学发光仪的测量高压设定为-850 V,测量间隔设定为10 s。
1.4 葡萄糖的测定
在25 μL不同浓度的葡萄糖溶液(pH=7.4 PBS稀释)中,加入25 μL 0.1 U/μL的GOx(pH=7.4 PBS稀释),混匀后37 ℃孵育5 min。将所得溶液与50 μL 2.5 mmol/L Luminol溶液(pH=9.0 Tris-HCl缓冲溶液稀释)在测量杯中混匀,再向其加入100 μL 1/3×BSA-Au NCs(pH=9.0 Tris-HCl缓冲溶液稀释),同时通过化学发光仪收集并记录反应产生的光强度信号。参数设定同1.3节。
2 结果与讨论
2.1 Au NCs的表征
图1是所制备Au NCs的紫外-可见和荧光光谱表征结果。用紫外-可见分光光度计扫描Au NCs在250~700 nm范围内的吸收光谱,Au NCs在280 nm处有一强宽峰,归属于BSA的酪氨酸残基和色氨酸残基[12],并无表面等离子体共振吸收峰,表明产物中不含有粒径大于2 nm的较大粒径的金纳米微粒。采用荧光分光光度计测定了Au NCs的荧光光谱(图1)。激发波长为360 nm,测定波长范围为550~700 nm,结果表明所制得的Au NCs在650 nm处有一较宽的荧光发射峰,此峰为Au NCs的特征峰,与文献报道[13]一致。采用透射电镜(TEM)对Au NCs进行了表征(图2),所制得的Au NCs分散良好,粒径均一,平均粒径为1.85±0.32 nm。

图1 Au NCs的吸收光谱和荧光光谱(激发波长为360 nm)Fig.1 Absorption spectra and fluorescence spectra(excitation wavelength is 360 nm) of Au NCs

图2 Au NCs的透射电镜(TEM)图Fig.2 TEM image of Au NCs
2.2 Au NCs催化Luminol反应的动力学曲线

图3 不同反应条件下鲁米诺化学发光反应的动力学曲线Fig.3 Kinetic curve of luminol CL reaction under different experimental conditionsExperimental conditions:) 2.5 mmol/L Luminol+1 mmol/L H2O2;) 2.5 mmol/L Luminol+400 μmol/L H2O2+1/3×Au NCs;) 2.5 mmol/L Luminol+1 mmol/L H2O2+1/3×Au NCs.
图3为各种实验条件下Luminol化学发光反应的动力学曲线。由图可见,Luminol在碱性条件下虽被H2O2氧化,但得到的CL信号非常弱。在相同实验条件下加入3倍稀释的Au NCs后,CL信号得到了显著增强,表明Au NCs 对Luminol-H2O2化学发光反应有增强作用,且化学发光动力学曲线显示其为慢化学发光,测定10 min其化学发光信号仍未衰减。Zhang等[7]曾报道了金纳米微粒能催化Luminol-H2O2化学发光反应。为了比较Au纳米微粒与Au NCs在Luminol-H2O2体系中的催化性质,我们采用柠檬酸三钠还原法制备了Au纳米微粒,动态光散射法测定其粒径为14±1.2 nm。与文献报道一致,Au纳米微粒能催化Luminol-H2O2体系产生快化学发光信号,其信号在15 s内约衰减70%。Au NCs与Au纳米微粒相比,催化Luminol-H2O2产生慢化学发光,其信号在10 min 内仍无衰减。推测可能是Au NCs的粒径非常小,导致与较大粒径的Au纳米微粒有不同的催化活性。在本研究中,我们还发现Au NCs-Luminol-H2O2的CL信号强度也与H2O2的浓度相关。因此,基于Au NCs增强的Luminol-H2O2体系,本研究发展了H2O2的化学发光检测方法,并将其应用于葡萄糖的检测。
2.3 H2O2检测条件优化
首先,对Luminol和Au NCs稀释液Tris-HCl的pH进行了优化。当Tris-HCl的pH<8.0时,体系的化学发光信号弱;当Tris-HCl的pH=8.0~9.0时,体系的化学发光信号显著增强。这是因为碱性条件有利于Luminol的化学发光反应;当Tris-HCl的pH>9.0时,虽然体系的化学发光信号强度仍有缓慢上升,但信噪比显著下降。因此,Tris-HCl的pH选定为9.0。之后,考察了Au NCs稀释倍数对H2O2测定的影响。Au NCs稀释倍数为3、6、12及24倍时,体系的化学发光信号随的稀释倍数增大而减小。结果表明,较大浓度的Au NCs有利于H2O2的测定,实验选定稀释倍数为3倍。最后,在0.01~2.5 mmol/L范围内考察了Luminol浓度对H2O2测定的影响。结果表明,体系的化学发光信号随Luminol浓度的增大显著增强,空白信号虽然也会在0.01~2.5 mmol/L范围内,体系的信噪比随浓度的增大而增大。选择Luminol的浓度为2.5 mmol/L。
2.4 检测H2O2的工作曲线及重现性
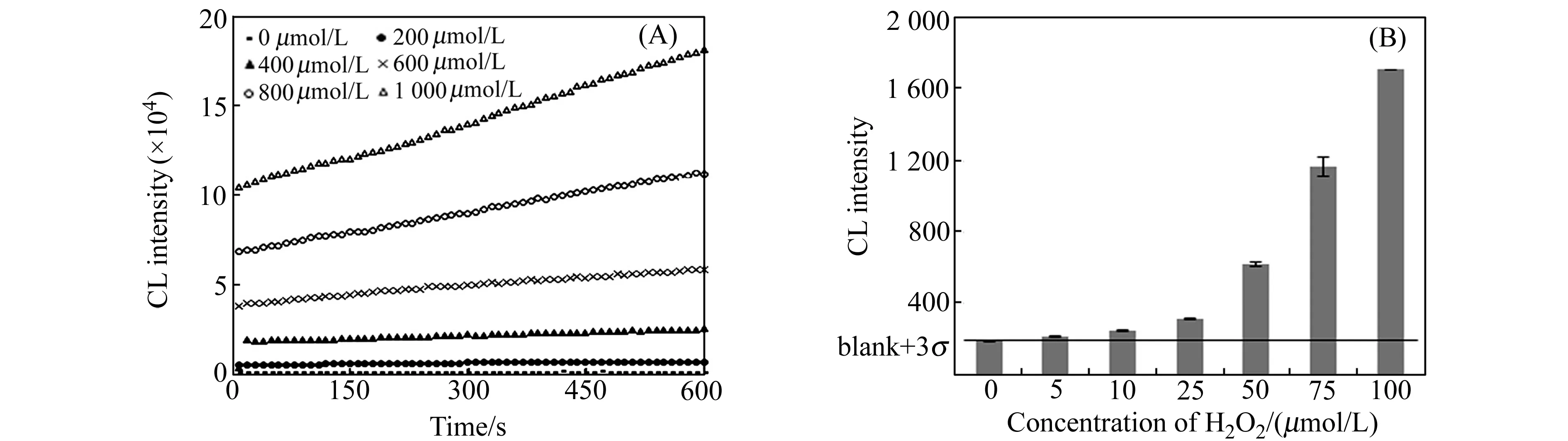
图4 (A)不同H2O2浓度下的化学发光动力学曲线;(B)H2O2浓度为5~100 μmol/L时体系化学发光强度的柱形图Fig.4 (A) Kinetic curves of the different concentrations of H2O2;(B) Histogram of CL intensity vs concentration of H2O2Experimental conditions were the same as described in section 1.3.
在以上优化的实验条件下,对H2O2测定的线性范围、灵敏度和重现性进行了考察。图4(A)为H2O2浓度在200~1 000 μmol/L范围内,体系的化学发光动力学曲线。结果表明,随着H2O2浓度的增加,体系的化学发光信号逐渐增强,并且均显示为慢化学发光反应,其信号在10 min内均无衰减(H2O2浓度小于200 μmol/L的动力学曲线图中未显示)。图4(B) 为H2O2浓度在5~100 μmol/L范围内体系化学发光信号强度的柱形图,其信号也是随H2O2浓度的增加而增强。通过分析,发现H2O2的测定信号呈分段线性关系。H2O2浓度在10~100 μmol/L范围内,其线性方程为:ICL=14.908c-127.16,R2=0.9533;H2O2浓度在100~1 000 μmol/L范围内,线性方程为:ICL=161.23c-28820,R2=0.9439。采用3σ法计算,H2O2的检测限为10 μmol/L。对200 μmol/L H2O2重复测定7次,其相对标准偏差(RSD)为5.93%,表明所建立的方法重现性良好。
2.5 在葡萄糖检测中的应用

图5 葡萄糖测定的化学发光信号响应Fig.5 CL response of glucose detectionExperimental conditions were the same as described in section 1.4.
H2O2是葡萄糖氧化酶(GOx)在O2条件下与葡萄糖反应的主要产物。因此,可将以上方法应用于葡萄糖的化学发光检测。测定包含两步:第一步,GOx催化葡萄糖与O2反应生成葡萄糖酸和H2O2;第二步,生成的H2O2与Au CNs 和Luminol反应产生化学发光。图5为在PBS中测定葡萄糖所得信号的柱形图,在10~1 000 μmol/L范围内葡萄糖浓度与化学发光信号的线性关系良好,回归方程为:ICL=33.43c-2125.5,R2=0.95,检测限为10 μmol/L。
之后,对此方法的选择性进行了考察。在优化的实验条件下,分别考察了其他糖类如乳糖、木糖和甘露糖的CL信号响应。实验结果表明只有葡萄糖能产生很强的CL信号响应,而乳糖、木糖和甘露糖的CL信号均与空白信号类似。本方法测定葡萄糖的选择性良好,这源自于GOx催化葡萄糖与O2反应生成H2O2具有高度的专一性。
最后,将所建立方法用于了人血清中葡萄糖含量的测定。将人血清样品采用pH=7.4的PBS稀释10倍后,按1.4所述方法进行检测,结果分别为3.12±0.39、5.87±0.62、2.22±0.14 mmol/L;采用血糖仪测定的结果分别为2.9、6.0、2.3 mmol/L。说明所建立的方法可用于血清中葡萄糖含量的测定。
3 结论
本文发展了简单、方便的化学发光测定H2O2的方法。在优化的实验条件下,测定H2O2的检测限为10 μmol/L。之后将此方法应用于葡萄糖的检测,测定葡萄糖的线性范围为10~1 000 μmol/L,检测限为10 μmol/L。该方法可用于血清中葡萄糖含量的测定。目前一些重要的生物分子如尿酸和乳酸等均能与相关酶反应生成H2O2,本方法也能进一步拓宽至这些生物分子的检测。除此之外,金纳米簇催化的Luminol-H2O2的化学发光反应为慢化学发光,其信号能在10 min内保持稳定,本课题组将致力于将其应用于化学发光成像分析领域。
参考文献:
[1] Zhang Z,Zhang S,Zhang X.Analytica Chimica Acta,2005,541(1):37.
[2] Qin W,Zhang Z J,Wang F C.Fresenius J Analytical Chemistry,1998,360(1):130.
[3] Chaichi M J,Ehsani M,Khajvand T,Golchoubian H,Rezaee E.Spectrochimica Acta Part A,2014,122:405.
[4] Chen L L,Zhang Z J,Zhang X M,Fu A H,Xue P,Yan R F.Food Chemistry,2012,135(1):208.
[5] Wang K M,Li J,Yang X H,Shen F L,Wang X.Sensors & Actuators B -Chemical,2000,65(1-3):239.
[6] Luo J X,Yang X C.Analytica Chimica Acta,2003,485(1):57.
[7] Zhang Z F,Cui H,Lai C Z,Liu L.Analytical Chemistry,2005,77(10):3324.
[8] Chen W,Hong L,Liu A L,Liu J Q,Lin X H,Xia X H.Talanta,2012,99:643.
[9] Xie J X,Huang Y M.Analytical Methods,2011,3(5):1149.
[10] Guo J Z,Cui H,Zhou W,Wang W J.Journal of Photochemistry and Photobiology A-Chemistry,2008,193(2-3):89.
[11] Wang X X,Wu Q,Shan Z,Huang Q M.Biosensors and Bioelectronics,2011,26(8):3614.
[12] Chen P C,Chiang C K,Chang H T.Journal of Nanoparticle Research,2013,15(1):1336.
[13] Patel A S,Mohanty T.The Journal of Materials Science,2014,49(5):2136.

