基于水溶性硅量子点的汞离子荧光传感器
郑爱华, 王佳慧, 吉邢虎, 何治柯*
(1.湖北医药学院药学院,湖北十堰 442000;2.生物医学分析化学教育部重点实验室,武汉大学化学与分子科学学院,湖北武汉 430072)
汞是一种有毒的重金属元素,对动植物和人体的健康危害极大。因此,Hg2+的检测在生命科学、化学、环境科学和医学等领域起着极其重要的作用。目前,Hg2+检测的方法主要有原子吸收光谱法[1]、电感耦合等离子体质谱法[2]、电化学法[3]及原子发射光谱法[4]等。然而,这些方法通常需要较为昂贵的仪器,制约了其应用。因此,开发简单、快捷、高效的Hg2+检测技术仍然具有重要意义。近年来,基于纳米材料的Hg2+检测方法受到研究工作者的关注。Guo等[5]报道了一种基于寡核苷酸稳定的Ag纳米簇的Hg2+荧光探针;Lee等[6]和王丽华等[7]分别将巯基修饰的DNA序列(poly-T)共价连接在Au纳米颗粒表面,借助DNA巯基与Hg2+特异性结合的方式构成纳米捕获探针。硅量子点(Si QDs)是荧光纳米材料领域的一个新的研究热点,与常用的CdS、CdTe等量子点相比,具有水溶性好、无毒、生物相容性好等特点[8 - 11],为其在高性能硅基功能化纳米探针及纳米传感器等方面的应用提供了有利条件。
本文实验发现,Hg2+能够与Si QDs表面的氨基结合,使其荧光猝灭,据此建立了一种Hg2+检测的新方法。二巯基丙磺酸钠(Dimercaptosulphonate Sodium,DMPS)是一种常用的治疗汞、铜、砷、铬、铋、锑等重金属中毒的解毒药,但其自身也具有一定的毒性,故解毒时使用浓度也有严格限制[12 - 13]。因此,建立DMPS的定量检测方法,将为其合理使用提供理论依据。当在Hg2+猝灭Si QDs荧光体系中加入DMPS时,由于巯基与Hg2+的结合力比氨基与Hg2+的结合力大,DMPS可夺取Si QDs表面氨基结合的Hg2+,释放出量子点使其荧光恢复,达到定量检测DMPS的目的。
1 实验部分
1.1 仪器及试剂
RF-5301型荧光光谱仪(日本,岛津公司);PB-10 酸度计(北京赛多利斯科学仪器有限公司);BS110S电子分析天平(北京赛多利斯科学仪器有限公司);Milli-Q 超纯水处理器(美国,Millipore公司)。
3-氨丙基三甲氧基硅烷((3-Aminopropyl)trimethoxysilane,APTMS)购于阿拉丁化学试剂有限公司;二水合柠檬酸三钠、DMPS均为Sigma-Aldrich公司产品;HgCl2购于国药集团化学试剂有限公司;其余试剂均为国产分析纯试剂。所用透析袋(MWCO:1 000)购于上海源叶有限公司。实验用水为超纯水。
1.2 实验方法
1.2.1水溶性荧光SiQDs的制备水溶性荧光Si QDs的合成参照实验室已建立的方法[13]:在25 mL三口烧瓶中加入超纯水,通入氮气除氧30 min后,加入柠檬酸三钠(浓度为0.125 mol/L),继续通入氮气并加入APTMS,使其终浓度为1.127 mol/L。该混合溶液在氮气保护下搅拌均匀后,转入反应釜中升温至200 ℃反应120 min,冷却后得到Si QDs溶液。将所得量子点溶液置于透析袋中进行纯化,得到无色透明溶液,置于4 ℃冷藏,待用。
1.2.2实验原理本实验的检测原理如图1所示。Si QDs表面带有氨基,呈蓝色荧光。当加入Hg2+时,量子点表面的氨基与Hg2+形成配合物,使量子点的荧光猝灭。根据量子点的荧光猝灭程度可测定Hg2+的浓度。在该体系中加入DMPS时,由于DMPS分子中有两个巯基,与Hg2+结合力更强,能夺取Si QDs 表面氨基结合的Hg2+,形成稳定的水溶性配合物,释放出量子点而使其荧光恢复。根据量子点荧光回升程度可测定DMPS的浓度。

图1 基于Si QDs的Hg2+荧光传感器检测原理示意图Fig.1 Schematic illustration of fluorescence sensor based on Si QDs and Hg2+
1.2.3检测方法在100 μL Si QDs溶液中,加入HAc-NaAc缓冲溶液,再加入不同浓度的Hg2+溶液,混合后反应体积保持400 μL,静置15 min后,测量体系的荧光强度值。以未加入Hg2+时Si QDs的荧光强度为F0,加入Hg2+后的荧光强度为F。实验中以荧光强度变化率(F0-F)/F0为考察指标优化实验条件,以相对荧光强度(F0-F)绘制标准工作曲线。
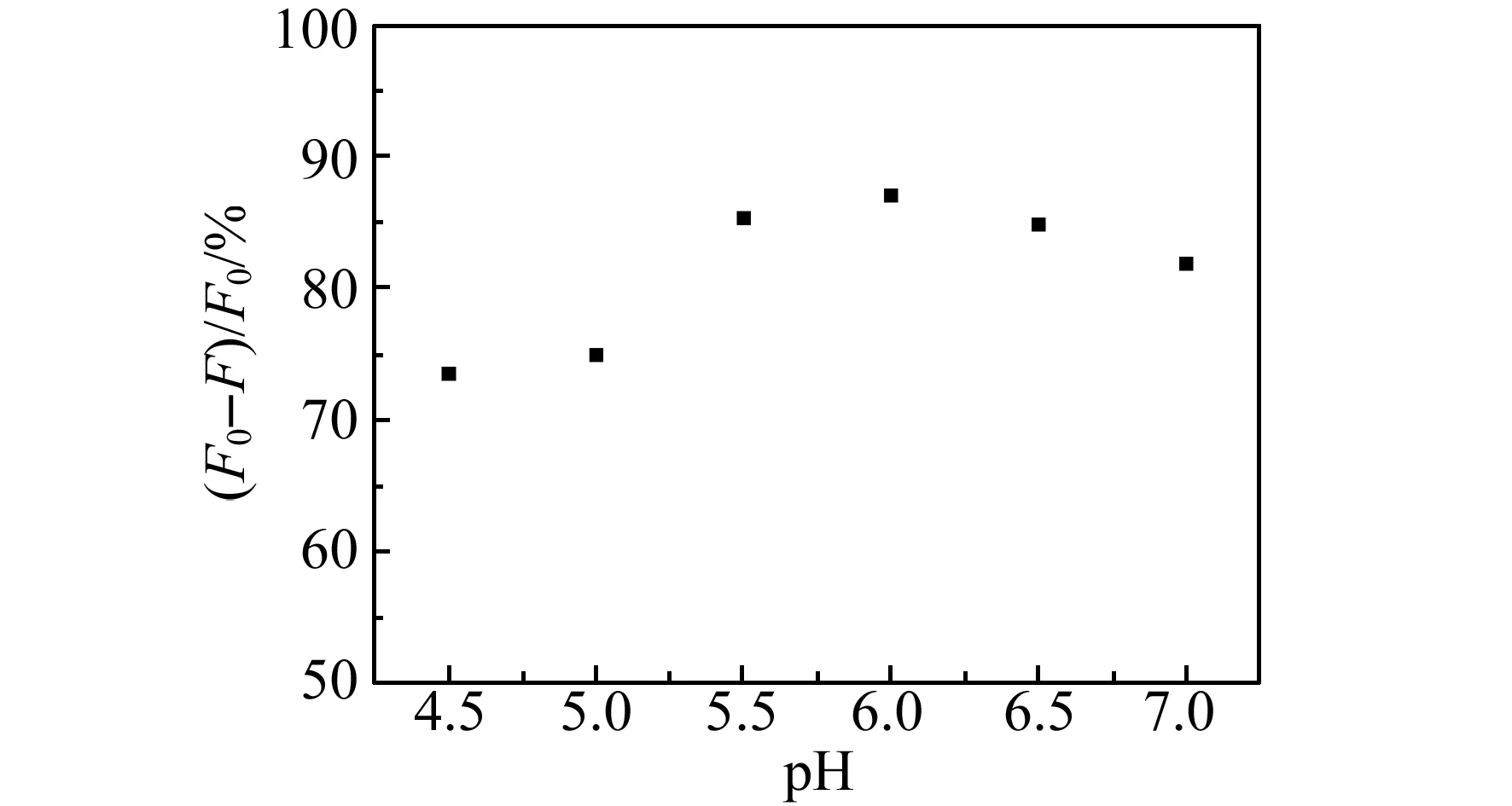
图2 pH对体系荧光强度的影响Fig.2 Influence of pH on the fluorescence intensity of Hg2+ sensing system
2 结果与讨论
2.1 实验条件优化
2.1.1pH的优化水溶性Si QDs的荧光对强酸及强碱范围的pH较敏感,但在pH=4.5~7.0范围内荧光相对稳定,实验选取不同pH的HAc-NaAc缓冲溶液进行了pH的优化,结果如图2所示。当pH为6.0时,荧光强度变化最小,Hg2+检测体系最稳定。因此,检测条件选择pH=6.0的缓冲体系。
2.1.2缓冲溶液种类的优化考察了不同种类缓冲体系对Si QDs检测Hg2+的影响。实验分别选择了HAc-NaAc、NaH2PO4-NaOH、邻苯二甲酸纳-NaOH和六次甲基四胺-HCl 4种缓冲溶液(浓度均为20 mmol/L)进行考察,实验结果如图3所示。HAc-NaAc缓冲体系的荧光猝灭最小,表明该缓冲体系对Hg2+检测的影响最小。因此,实验选用HAc-NaAc缓冲体系。


图3 缓冲溶液种类对体系荧光强度的影响Fig.3 Influence of different buffer solution at pH=6.0 on the fluorescence intensity of Hg2+ sensing system
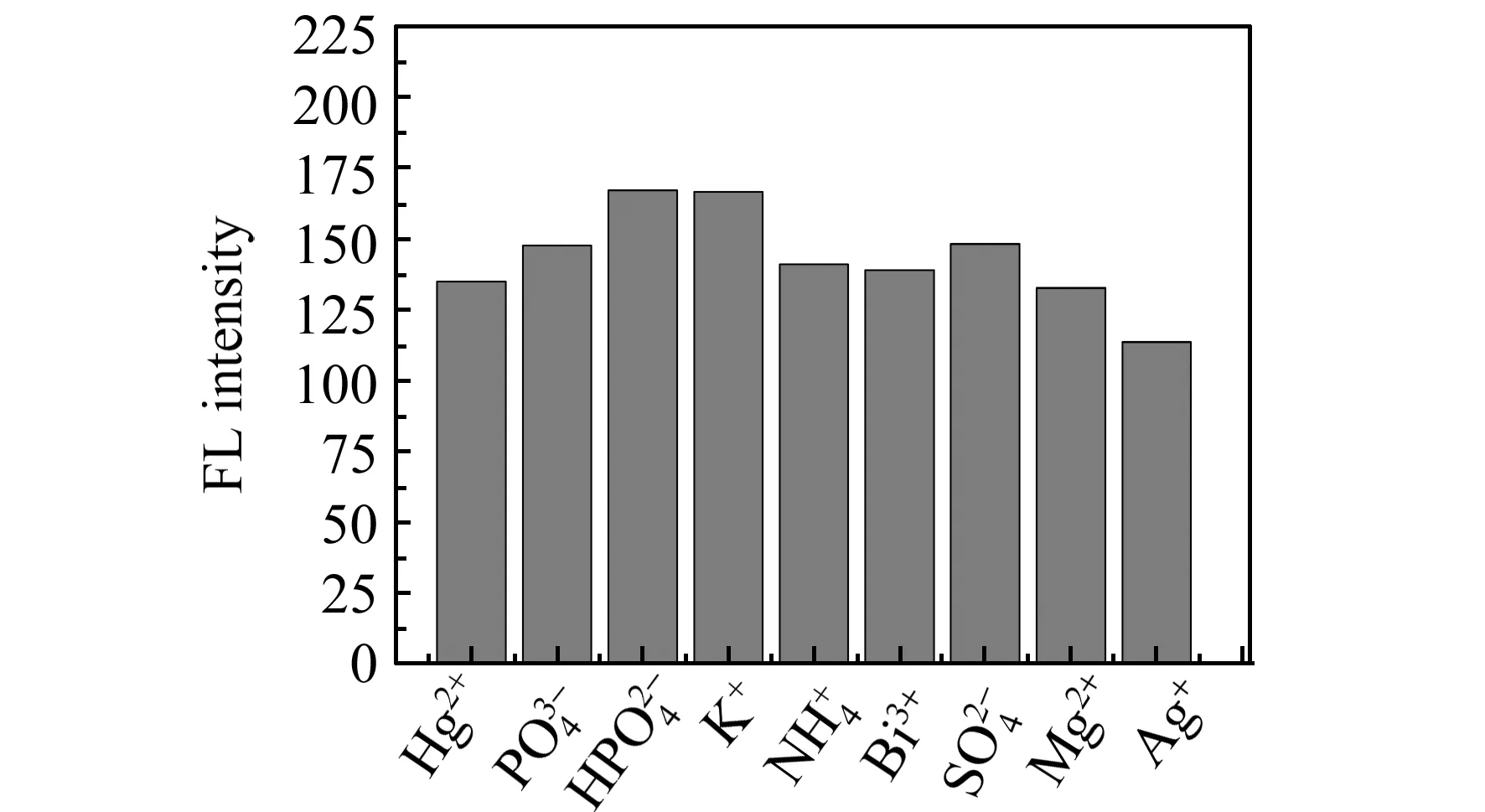
图4 不同离子对体系荧光强度的影响Fig.4 Influence of different ions on the fluorescence intensity of Hg2+ sensing system
2.2 分析性能
在100 μL Si QDs溶液中,加入20 mmol/L HAc-NaAc缓冲溶液(pH=6.0),再加入一定浓度的Hg2+溶液,使最终待测液体积为 400 μL。涡旋混匀,静置15 min后,荧光检测结果如图5(A)所示。从图中可以看出,随着Hg2+浓度的增加,荧光猝灭程度不断增强。以F0-F为纵坐标(y),cHg2+为横坐标(x)作图得到标准曲线(图5(B))。线性范围为5.0×10-8~1.0×10-6mol/L,线性方程式为:y=134.8x+19.96(R2=0.9978),检出限(3σ)为2.2×10-8mol/L。

图5 (A)Si QDs对Hg2+的荧光响应光谱图;(B)检测Hg2+校准曲线Fig.5 (A) Fluorescence spectra of the sensing system in response to the different concentrations of Hg2+;(B) Calibration curve for the detection of Hg2+

图6 (A) 检测体系对DMPS的荧光光谱图;(B)检测DMPS的校准曲线Fig.6 (A) Fluorescence spectra of the sensing system in response to the different concentrations of DMPS;(B) Calibration curve for the detection of DMPS
2.3 二巯基丙磺酸钠的检测
DMPS是常用于治疗汞、铬、铜、砷等重金属离子中毒的特效药,由于其结构中含有可以与Hg2+相结合的巯基,从而可以有效夺取已被络合的Hg2+。在上述测定Hg2+的体系中,加入不同浓度DMPS溶液,涡旋混匀,静置15 min后,测定体系荧光强度(图6(A))。随着DMPS浓度的增加,Si QDs的荧光强度逐渐增强,当其浓度为1.200 μmol/L,Si QDs的荧光强度基本上能够得到完全回升。在2.5×10-8~4.0×10-7mol/L浓度范围内,荧光强度恢复值F-F0(y)与DMPS浓度(x)呈线性关系,线性方程式为:y=245.5x+136.8(R2=0.9976)(图6(B))。
3 结论
本文利用表面带氨基的水溶性荧光Si QDs与Hg2+的相互作用,建立了一种操作简单、方便快捷的Hg2+检测方法。与基于纳米金、碳点、碳纳米管等纳米材料的Hg2+传感器相比,本文所提出的传感器具有分析速度快、灵敏度高等优势。在此基础上,借助巯基比氨基与Hg2+具有更强的亲和力的策略,建立了一种检测DMPS的新方法。当DMPS加入Si QDs检测Hg2+的反应体系,可夺取已与量子点表面氨基相结合的Hg2+,释放出自由的量子点,使其荧光强度恢复,从而实现DMPS的检测。
参考文献:
[1] Gao Y,Shi Z M,Long Z,et al.Microchemical Journal,2012,103:1.
[2] Duodu G O,Goonetilleke A,Allen C,et al.Analytica Chimica Acta,2015,898:19.
[3] Bui M P N,Brockgreitens J,Ahmed S,et al.Biosensors and Bioelectronics,2016,85:280.
[4] Zhang R X,Peng M T,Zheng C B,et al.Microchemical Journal,2016,127:62.
[5] Guo W,Yuan J,Wang E.Chemical Communications,2009,11:3395.
[6] Jae -Seung L,Min S H,Chad A,et al.Angewandte Chemie International Edition,2007,46:4093.
[7] LIU X F,WU H P,LI Y L,et al.Nuclear Techniques(刘兴奋,武海萍,李玉兰,等.核技术),2007,30:467.
[8] Zhang J,Yu S H.Nanoscale,2014,6:4096.
[9] Feng Y,Liu Y,Su C,et al.Sensors and Actuators B:Chemical,2014,203:795.
[10] Freeman R,Finder T,Willner I.Angewandte Chemie International Edition,2009,48:7818.
[11] Cai Z X,Yang H,Zhang Y,et al.Analytica Chimica Acta,2006,559:234.
[12] TIAN F,PENG X B.Disaster Medicine and Rescue(Electronic Edition)(田飞,彭晓波.灾害医学与救援(电子版)),2015,4:250.
[13] ZHOU T.Occupational Health and Emergency Rescue(周婷.职业卫生与应急救援),2014,32:32.

