高效液相色谱法分析新型细菌多糖中单糖和糖醛酸组成
王凤芹, 张 林, 路则庆, 汪以真*
(浙江大学饲料科学研究所,农业部华东动物营养与饲料重点实验室,浙江省饲料及动物营养研究实验室,浙江杭州 310058)
多糖的生物活性与其结构密切相关,因此了解多糖的结构有助于更好地利用和开发多糖。完整的多糖结构分析是在将多糖进行提取、分离、纯化获得均一性组分后,进行包括分子量范围、单糖的组成、连接类型、单糖和糖苷键的构型及重复单元等的分析[1]。细菌多糖通常是由双糖至八糖形成的规则的重复单位构成,而这些重复单位则是由2~4种单糖所组成,其中许多糖链上又携带有乙酰、丙酮酸、糖醛酸等特征基团[2]。在多糖的结构研究中,单糖组成分析是必不可少的环节。糖类物质在紫外区无吸收,采用示差折光检测的灵敏度低且不利于梯度洗脱。为此,在进行高效液相色谱(HPLC)分析时,常采用衍生化处理,将糖类组分转变为带发色基团的分子[3 - 4],主要的衍生化试剂有1-苯基-3-甲基-5-吡唑啉酮(PMP)[5 - 6]、1-(2-萘基)-3-甲基-5-吡唑啉酮(NMP)[7]、对氨基苯甲酸(p-AMBA)。衍生化后的产物经HPLC分离、紫外检测器检测[4 - 6]。
本研究在文献报道方法的基础上,对PMP衍生单糖和糖醛酸进行了系统研究,分别考察了不同pH值、不同的检测时间以及不同的反应时间对于单糖和糖醛酸衍生反应物的影响,并利用优化的方法测定了细菌多糖中的单糖和糖醛酸组成。为进一步对细菌多糖的生理活性研究提供理论依据。
1 实验部分
1.1 仪器与试剂
Waters Alliance 2695高效液相色谱系统(美国,Waters公司),含Waters 2998二极管阵列检测器和Empower 3色谱工作站;集热式恒温加热磁力搅拌器(杭州惠创仪器设备有限公司)。
1-苯基-3-甲基-5-吡唑啉酮(PMP)、D -甘露糖、D -葡萄糖醛酸、D -葡萄糖、D -半乳糖、D -木糖、D -岩藻糖和乙腈均为色谱纯,购于Sigma公司;KH2PO4、HCl、NaOH、三氯甲烷均为分析纯,购于国药集团化学试剂有限公司。实验用水为超纯水。
细菌多糖样品:EnterobactercloacaeZ0206细菌由本课题组分离、驯化、鉴定并保存[8]。该细菌分泌的多糖经过醇沉烘干为该研究所用的样品。
1.2 实验方法
1.2.1单糖和糖醛酸衍生物的制备精确称取20 mg左右甘露糖、葡萄糖醛酸、葡萄糖、半乳糖和岩藻糖,溶解于水中并定容,配制成甘露糖浓度为1 mmol/L,葡萄糖醛酸浓度为0.5 mmol/L,葡萄糖浓度为2 mmol/L,半乳糖浓度为2 mmol/L,岩藻糖浓度为1 mmol/L的混合标样。取10~200 μL混合标样于2 mL 离心管中,用水补足至200 μL,每支离心管中再加入50 μL 1 mmol/L木糖。依次加入50 μL 0.5 mol/L PMP甲醇溶液和50 μL 0.3 mol/L NaOH溶液,盖上盖子,70 ℃水浴反应60 min,冷却后加入50 μL 0.3 mol/L HCl中和。先用0.5 mL三氯甲烷萃取两次(用移液枪从底部取出三氯甲烷,弃去),再用1 mL三氯甲烷萃取1次,8 000 r/min离心5 min,取上清液进行HPLC分析。以葡萄糖为例,单糖与PMP衍生的反应方程式[9]如图1所示。
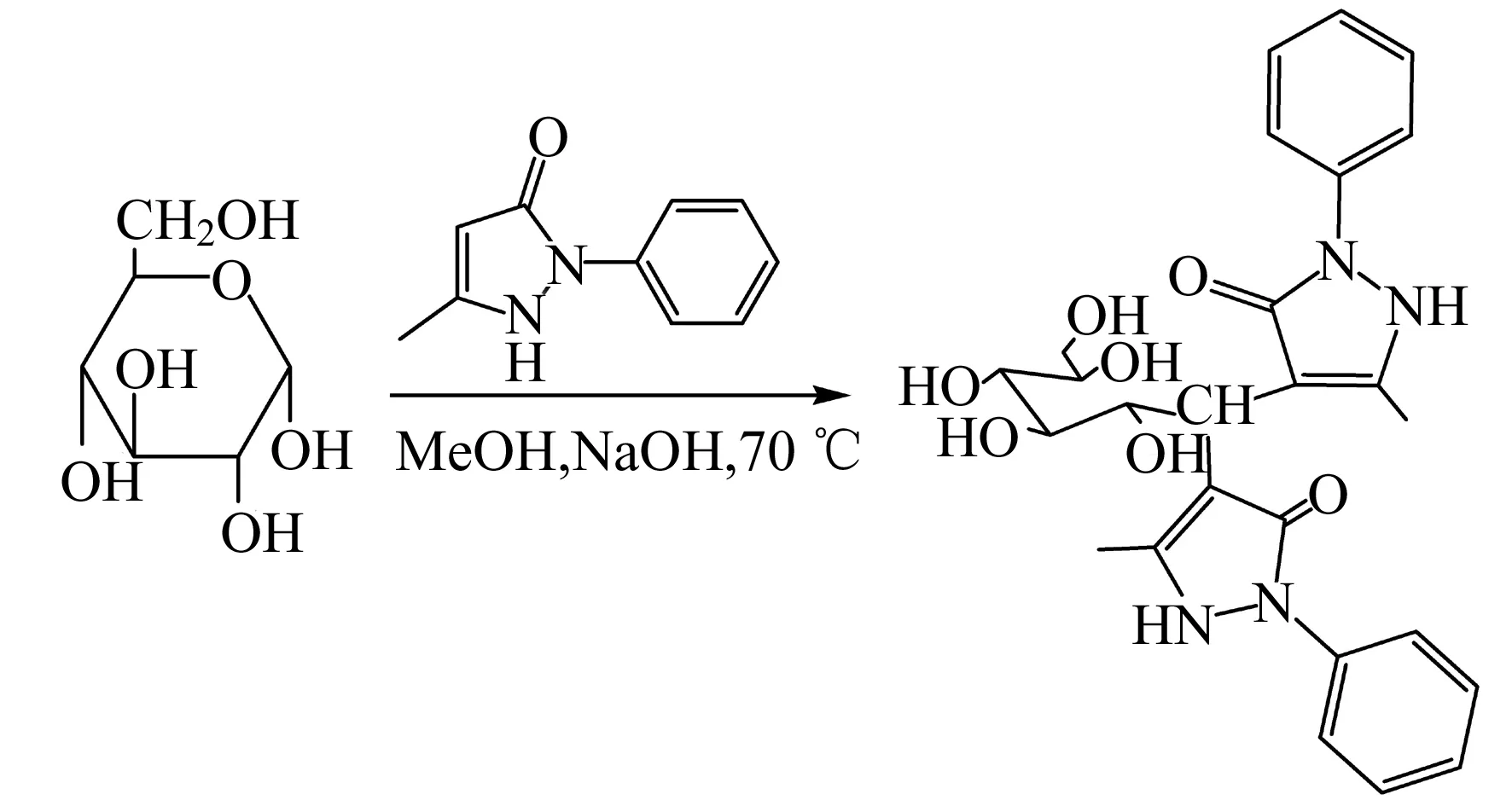
图1 葡萄糖与PMP的反应方程式Fig.1 Labeling reaction of glucose with PMP
1.2.2细菌多糖的水解精确称取25 mg左右细菌多糖样品于水解管中,加入4 mL 3 mol/L三氟乙酸,再加入625 μL 10 mmol/L木糖溶液。封管,并在120 ℃烘箱中水解1 h。之后取出冷却至室温,调节pH值略偏碱性(用pH=1~12试纸比对),并用水定容至25 mL。衍生反应:取定容后的样品溶液200 μL,之后操作同标准样品。
1.2.3色谱条件色谱柱:XBridgeTMC18柱(250×4.6 mm,5 μm);流动相:50 mmol/L KH2PO4溶液(pH=5.5)-乙腈(体积比78∶22);检测波长:245 nm;流速:1 mL/min;进样体积:10 μL。
2 结果与讨论
2.1 细菌多糖水解条件的优化
文献报道样品水解时间通常选择为2 h[10 - 11]或者8 h[12]。在本研究中对样品水解时间进行了考察,当水解温度设定为120 ℃,用3 mol/L 三氟乙酸分别水解样品1 h和2 h,发现其色谱峰面积没有太大的变化。最终,选择的样品水解时间为1 h。另外,为了避免三氟乙酸对分析结果的影响,文献一般采用氮吹的方法去除三氟乙酸[13 - 14]。而在本研究中,直接用NaOH溶液中和样品水解液中的三氟乙酸,调节pH至略偏碱性。本研究省略氮气吹干水解液步骤,直接中和,中和溶液直接进行PMP衍生化,这对于开发快速定量单糖组成很有意义。
2.2 衍生反应酸度的选择
文献报道[15],为降低糖的PMP衍生物在萃取溶剂三氯甲烷中的损失,需要将衍生反应体系的pH值调节成酸性,本研究调节pH值在2~11之间,以考察不同的衍生体系的pH值对萃取效果的影响,结果见图2。当pH值在2~8时,单糖-PMP衍生物的峰面积变化并不明显,此现象说明pH值在2~8之间,衍生物稳定存在,并且不会对三氯甲烷的萃取效果产生影响。并不需要用过量的酸使该体系的pH为3~4[16]或4~5[14]。但是当pH值继续升高时,葡萄糖、半乳糖和木糖三种糖衍生物的峰面积变小,此现象说明在较高pH值时,可能是由于部分单糖的PMP衍生物在三氯甲烷中有一定的溶解度造成在萃取过程中损失,这与文献报道[16]一致。因此,本研究确定调节pH值在2~8之间,扩大了pH的范围,以便于实际操作。
2.3 衍生反应时间的选择
参考文献方法[4],设定衍生温度为70 ℃,本研究考察了衍生时间对于各单糖和糖醛酸衍生化产率的影响。取甘露糖浓度为1 mmol/L,葡萄糖醛酸浓度为0.5 mmol/L,葡萄糖浓度为2 mmol/L,半乳糖浓度为2 mmol/L,岩藻糖浓度为1 mmol/L的混合标样160 μL。用水补足至200 μL,每支离心管中再加入50 μL 1 mmol/L木糖。依次加入50 μL 0.5 mol/L PMP甲醇溶液和50 μL 0.3 mol/L NaOH溶液,盖上盖子,设定温度为70 ℃分别衍生10、20、30、40、60和80 min。再按实验步骤进行处理,HPLC进行分析。实验结果表明:在反应初期随着反应时间的延长,各单糖和糖醛酸的PMP衍生物峰面积不断增加。当反应时间为60 min时,再增加反应时间,色谱峰面积与60 min时基本持平(图3)。因此,选择衍生时间为60 min,这与文献报道的趋势基本一致[4]。

图2 单糖和糖醛酸标准品PMP衍生物不同pH值下的峰面积Fig.2 Peak areas of PMP-labeled monosaccharides and galacturonic acid under different pH value
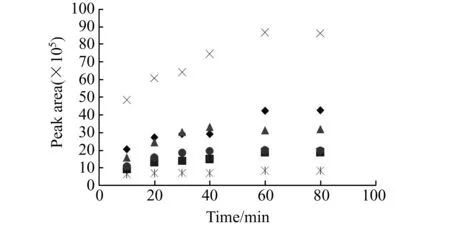
图3 反应时间对5种单糖和糖醛酸-PMP衍生物峰面积的影响Fig.3 Effect of reaction time on the peak area of PMP-labeled monosaccharides and galacturonic acid
2.4 衍生产物稳定性考察
为了考察5种单糖和葡萄糖醛酸的衍生产物的稳定性,本研究考察了衍生物日内和日间的保留时间以及峰面积的变化。实验结果表明,在反应结束后的48 h内单糖和糖醛酸的衍生物峰日内保留时间的相对标准偏差(RSD)≤0.32%,日内峰面积RSD≤2.96%,日间保留时间RSD≤0.47%,日间峰面积RSD≤2.58%。因此,在48 h内分析衍生物完全可以得到准确的实验结果,见表1。
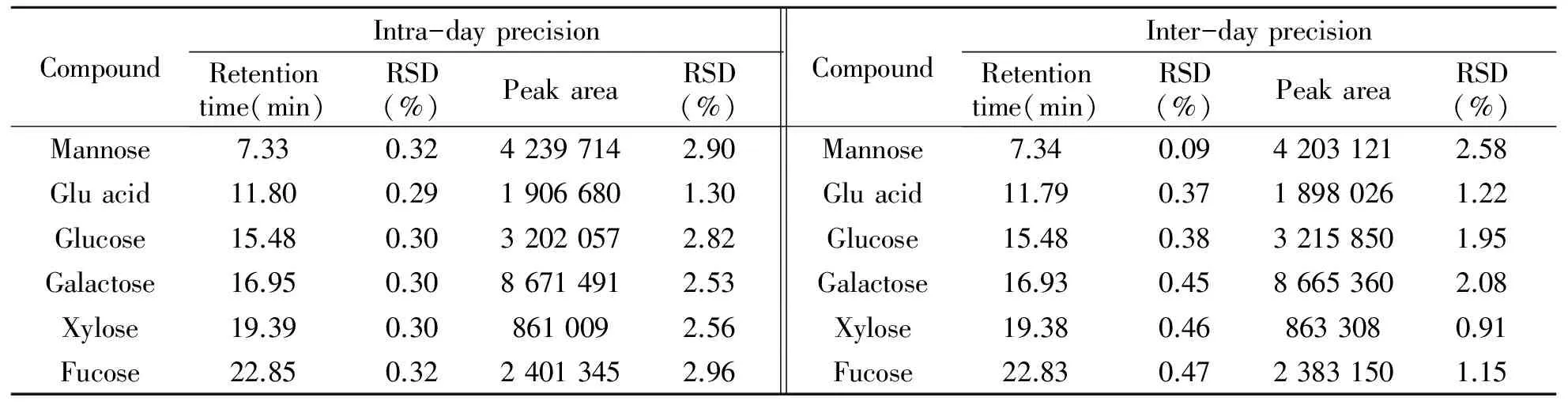
表1 单糖和糖醛酸标准品PMP衍生物分析的日内和日间精密度(n=6)Table 1 Precision for the analysis of PMP-labeled monosaccharides and galacturonic acid(n=6)
2.5 标准曲线及检出限

图4 5种单糖和1种糖醛酸-PMP衍生物的色谱图Fig.4 Chromatogram of PMP derivatives of 5 monosaccharides and galacturonic acid
分别取10、20、40、60、80、100、120、160及200 μL混合标样于2 mL离心管中,然后分别用水补足至200 μL,每支离心管中再加入50 μL 1 mmol/L木糖,再加入50 μL水。按实验方法进行衍生化并进行HPLC分析,色谱图见图4。
在系列浓度下,以单糖和糖醛酸浓度与木糖浓度比值为横坐标,以单糖和糖醛酸峰面积与木糖峰面积比值为纵坐标制作标准曲线,得线性方程与相关系数,以3倍信噪比计算得到4种单糖和糖醛酸的检出限,结果见表2。由此可见,本方法的线性范围宽,检测灵敏度较高。
2.6 单糖及糖醛酸的回收率分析
通过对细菌多糖样品水解产物进行衍生化,再对衍生物进行3次平行分析。得到甘露糖、葡萄糖醛酸、葡萄糖、半乳糖和岩藻糖含量比为:1.77∶0.44∶8.52∶1.32∶1.67,精密度分析范围为0.52%~3.12%(表3)。以细菌多糖为材料进行方法的加标回收率考察。混合标样分3个浓度梯度加入到样品中,进行测定,结果如表3所示。甘露糖、葡萄糖醛酸、葡萄糖、半乳糖和岩藻糖的平均加标回收率分别为88.0%、89.3%、100.3%、95.8%和94.7%,RSD分别为6.56%、6.67%、2.66%、7.42%和7.05%。表明方法的准确度和精密度可以满足细菌多糖中单糖和糖醛酸的测定要求。

表2 回归方程、线性范围及检出限Table 2 Calibration curves and detection limits of 4 monosaccharides and galacturonic acid
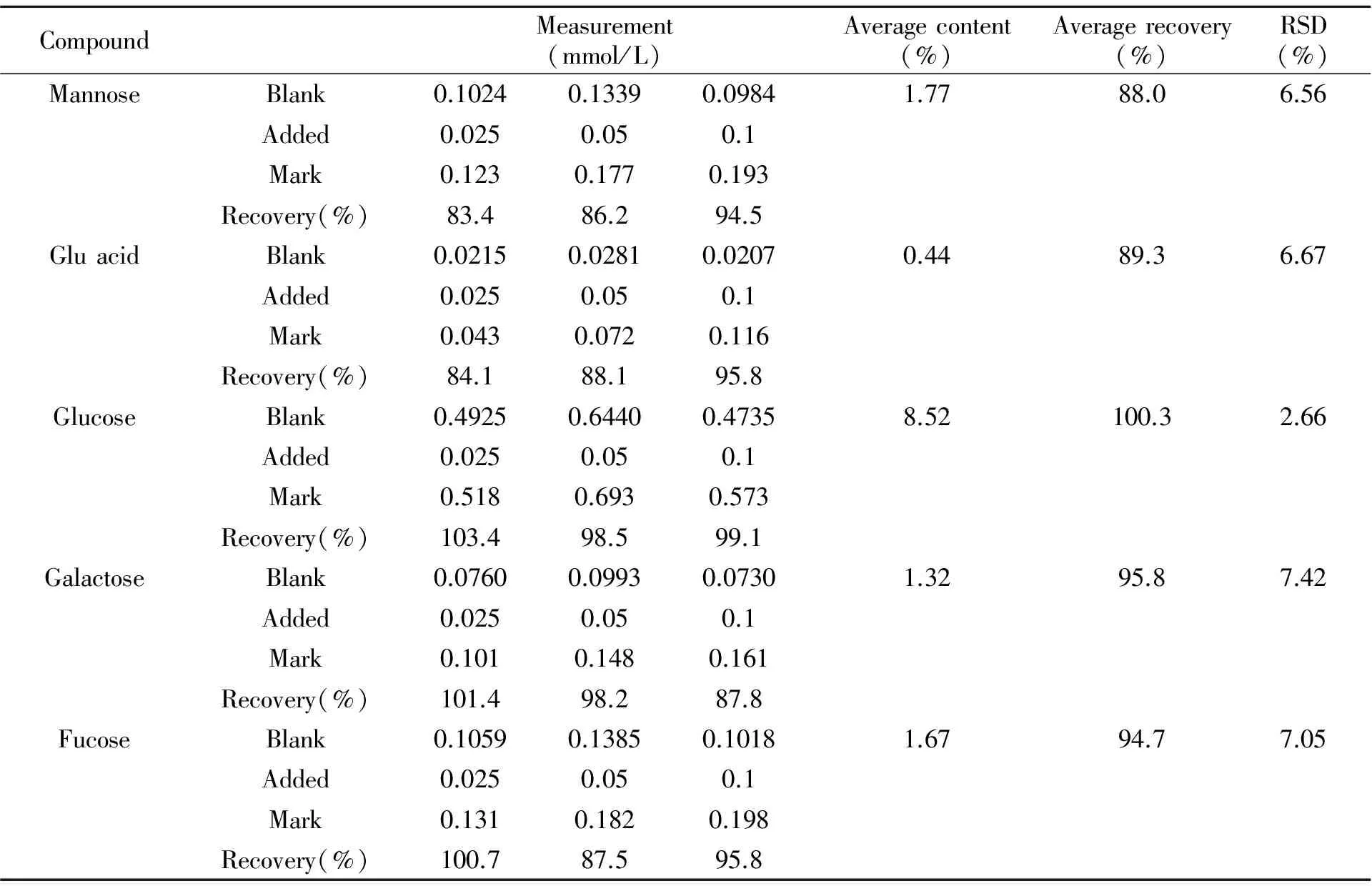
表3 方法的加标回收率与精密度(n=3)Table 3 The recoveries and RSD of present method(n=3)
3 结论
综上所述,本实验建立了细菌多糖中单糖和糖醛酸的PMP柱前衍生化-高效液相色谱测定法。实验优化了衍生条件,整个实验前处理步骤中避免了氮气吹干、水解产物干燥等过程,并且扩大了衍生化pH值范围。结果表明该方法准确、简单、快速,具有良好的重现性。应用该方法成功分离并定量分析了细菌多糖中4种单糖和1种糖醛酸。
参考文献:
[1] YU Y J.The Fermentation Dynamics,Purification and the Modification of Exopolysaccharides PS202.Nanning:Guangxi University(于亚静.可溶性胞外多糖PS202的发酵动力学、分离纯化及其结构修饰的研究.南宁:广西大学),2007:3.
[2] QIAO L Y.Chemical and Biological Properties on the Bacteriophage-borne Glycanase and Its Hydrolysates.Qingdao:Ocean University of China(乔来艳.噬菌体聚糖酶及其酶解产物的化学及生物学研究初探.青岛:中国海洋大学),2009:1.
[3] CHEN Y H,JIANG R Z,LUO H M.Chinese Journal of Pharmaceutical Analysis(陈英红,姜瑞芝,罗浩铭.药物分析杂志),2012,32(1):136.
[4] WANG Z W,LENG K L,SUN W H.Journal of Analytical Science(王泽文,冷凯良,孙伟红.分析科学学报),2011,27(1):26.
[5] GUO H Z,JIANG W Y,DU Z H.Chinese Journal of Chromatography(郭怀忠,姜文月,杜智昊.色谱),2011,29(3):254.
[6] XU J,ZHANG L Y,ZHANG Q H.Chinese Journal of Chromatography(徐瑾,张凌怡,张庆合.色谱),2003,21(4):363.
[7] SUN Z W,LIU L J,HU B J.Chinese Journal of Chromatography(孙志伟,刘凌君,户宝军.色谱),2008,26(2):200.
[8] WANG F Q,YANG H X,WANG Y Z.Carbohyd Polym,2013,92(1):503.
[9] Honda S,Akao E,Suzuki S,et al.Anal Biochem,1989,180:351.
[10] DAI J,WU Y,CHEN S.Carbohyd Polym,2010,82(3):629.
[11] ZHANG L,XU J,ZHANG L.J Chromatogr B,2003,793(1):159.
[12] LV Y,YANG X,ZHAO Y.Food Chemistry,2009,112(3):742.
[13] WU X,JIANG W,LU J.Food Chemistry,2014,145:976.
[14] FU D,O'NEILL R A.Anal Biochem,1995,227(2):377.
[15] DAI J,ZHU S,TANG J,et al.Journal of Instrumental Analysis(戴军,朱松,汤坚,等.分析测试学报),2007,26(2):206.
[16] STRYDOM D J.J Chromatogr A,1994,678(17):23.

