基于金属-有机骨架材料的分散固相萃取法测定果汁饮料中的5种植物生长调节剂含量
张珍珍, 刘晓梅, 车旦旦, 满 意, 梁 爱, 秦彬彬, 杨 珊, 刘二东, 孙志伟*
(曲阜师范大学化学与化工学院,山东曲阜 273165)
植物生长调节剂(Plant Growth Regulators,PGRs)又称外源植物激素,它是一种人工合成的与内源激素有相似生理作用的化合物。PGRs具有促进生根、防止落花落果、增加产量等作用,在农业上得到了广泛应用。但这些人工合成激素在农作物中的残留通过食物链进入人体后会造成一定危害,因此,有必要建立快速准确测定PGRs残留的方法[1]。目前,PGRs的检测方法主要有气相色谱法(GC)[2]、高效液相色谱法(HPLC)[3 - 4]以及液相色谱-串联质谱法(LC-MS/MS)[5 - 8]。由于样品中PGRs残留含量低且基质复杂,常需要分离富集或净化处理。张旭等[3]采用固相萃取结合HPLC法建立了橙汁中4种PGRs和杀菌剂残留的检测方法。分析工作者常采用分散固相萃取吸附剂对样品进行净化,以提高方法的选择性和准确度[4 - 8]。
金属-有机骨架(MOF)材料是近年来发展的一类有机-无机杂化材料,具有比表面积大、孔隙度高、结构多样性及孔道表面可修饰等特点,作为固相萃取吸附剂表现出优异的性能[9 - 10]。李攻科课题组采用MOF-5作为分散固相萃取吸附剂,用于赤霉素类植物激素的分离富集[11]。本实验室采用UiO-67 成功实现了7种PGRs的分离富集[12]。MOF材料可通过π-π和金属-羧基的作用高效吸附PGRs目标物,本工作以溶剂稳定性好的MIL-101作为分散固相萃取吸附剂,对3-吲哚乙酸(IAA)、3-吲哚丙酸(IPA)、3-吲哚丁酸(IBA)、1-萘乙酸(1-NAA)和1-萘氧基乙酸(1-NOA)进行萃取,采用针头式过滤器进行相分离,结合高效液相色谱-荧光检测法(HPLC-FLD)对果汁中5种PGRs的残留进行分析检测。
1 实验部分
1.1 仪器与试剂
Agilent1100型高效液相色谱仪(美国,安捷伦科技有限公司);JSM-6700F型冷场发射扫描电子显微镜(日本,JEOL);MiniFlex 600型X-射线衍射仪(日本,Rigaku);101型电热鼓风干燥箱(北京永光明医疗仪器有限公司);KQ220OE型超声波清洗器(舒美昆山市超声仪器有限公司);真空干燥箱(上海精密仪器仪表有限公司)。
3-吲哚乙酸(IAA)、3-吲哚丙酸(IPA)、3-吲哚丁酸(IBA)、1-萘乙酸(1-NAA)和1-萘氧基乙酸(1-NOA)对照品,均购自北京百灵威科技有限公司;色谱纯乙腈购自国药集团化学试剂有限公司;Cr(NO3)3·9H2O和对苯二甲酸均为分析纯,购自国药集团化学试剂有限公司;甲醇、丙酮和四氢呋喃均为分析纯试剂。实验用水为去离子水。
1.2 MIL-101的合成
采用文献报道的方法[13 - 14]制备MIL-101。取4 g Cr(NO3)3·9H2O,1.64 g对苯二甲酸,125 μL HF(40%),70 mL H2O,置于100 mL烧杯中,超声混合30 min。将混合液倒入100 mL反应釜并密封,再于220 ℃下反应8 h。冷却至室温后,将反应物经250目不锈钢过滤网过滤,离心后倒掉上清液,用去离子水洗涤沉淀物3次,于70 ℃下真空干燥24 h,得到绿色粉末状产品。
1.3 果汁样品的处理
将市售果汁饮料离心15 min(3 000 r/min)以除去其中的固体物,然后添加16%PbAc2溶液,离心5 min(15 000 r/min)除去果汁中的植物蛋白,上清液经过0.22 μm滤膜过滤,保存于4 ℃冰箱中,备用。
1.4 萃取过程

图1 基于MIL-101的分散固相萃取示意图Fig.1 Schematic diagram of MIL-101 based dispersive solid-phase extraction
在15 mL的离心管中,加入10 mL混合标准溶液或样品溶液,以及一定量MIL-101,分散均匀,超声6 min。吸入注射器中,用尼龙有机系针头式过滤器(0.22 μm,Ф25mm)将溶液滤出,MIL-101留在滤头上,用0.8 mL解吸溶剂清洗滤头,在55 ℃下用N2气将洗脱液吹干,再加入500 μL甲醇复溶进样。萃取过程见图1。
1.5 HPLC-FLD条件
色谱柱:Eclipse XDB-C8柱(150×4.6 mm,5 μm);流动相A:5%乙腈,流动相B:乙腈。梯度洗脱程序:0→5 min,40%→50%B,保持5 min。流速:1 mL/min;检测波长:λex/λem=280/340 nm;柱温:30 ℃;进样量:10 μL。
2 结果与讨论
2.1 MIL-101表征
通过扫描电镜(SEM)观察MIL-101的形貌,结果见图2。由图2(A)可见,粒子分散性较好,其半径约为250~300 nm。X-射线粉末衍射(XRD)分析结果见图2(B),结果显示本实验所制备的MIL-101具有较高的结晶度,特征衍射峰与文献报道[13 - 14]一致。

图2 MIL-101的扫描电镜图(A)和X-射线粉末衍射图(B)Fig.2 Scanning electron microscopy(A) and X-ray powder diffraction diagram(B) of MIL-101
2.2 萃取条件优化
2.2.1基质pH的影响5种PGRs为羧酸类化合物,溶液pH会影响分析物的存在状态,并进一步影响萃取效果。配制pH分别为3~9的缓冲溶液,考察pH值对萃取效果的影响。由图3(A)可知,在pH=6的条件下,可获得最佳萃取效率。本研究选择基质pH值为6。
2.2.2吸附剂用量的影响考察了吸附剂用量为3、5、10、15、20、25和30 mg时的萃取效果,如图3(B)。由图可见,随着MIL-101用量的增加,萃取效率开始增幅明显,5 mg以后开始趋于稳定。综合考虑吸附能力和滤头空间限制,本实验中MIL-101用量选取10 mg。
2.2.3萃取时间的影响考察了萃取时间分别为2、4、6、8、10、12和14 min时的萃取效果,如图3(C)。结果表明,随着萃取时间的增加,萃取效率显著增大,在6 min时可达到平衡。本研究选取6 min作为萃取时间。
2.2.4解吸溶剂种类与用量的影响考察了甲醇、丙酮、乙腈和四氢呋喃的解吸效果,由图3(D)可以看出甲醇表现出最高的解吸效率。考察了甲醇体积为0.2、0.4、0.6、0.8、1.0和1.2 mL时的解吸效果,如图3(E)。当萃取体积增加至0.8 mL后,萃取效率趋于稳定。本研究中选取0.8 mL甲醇作为解吸溶剂。
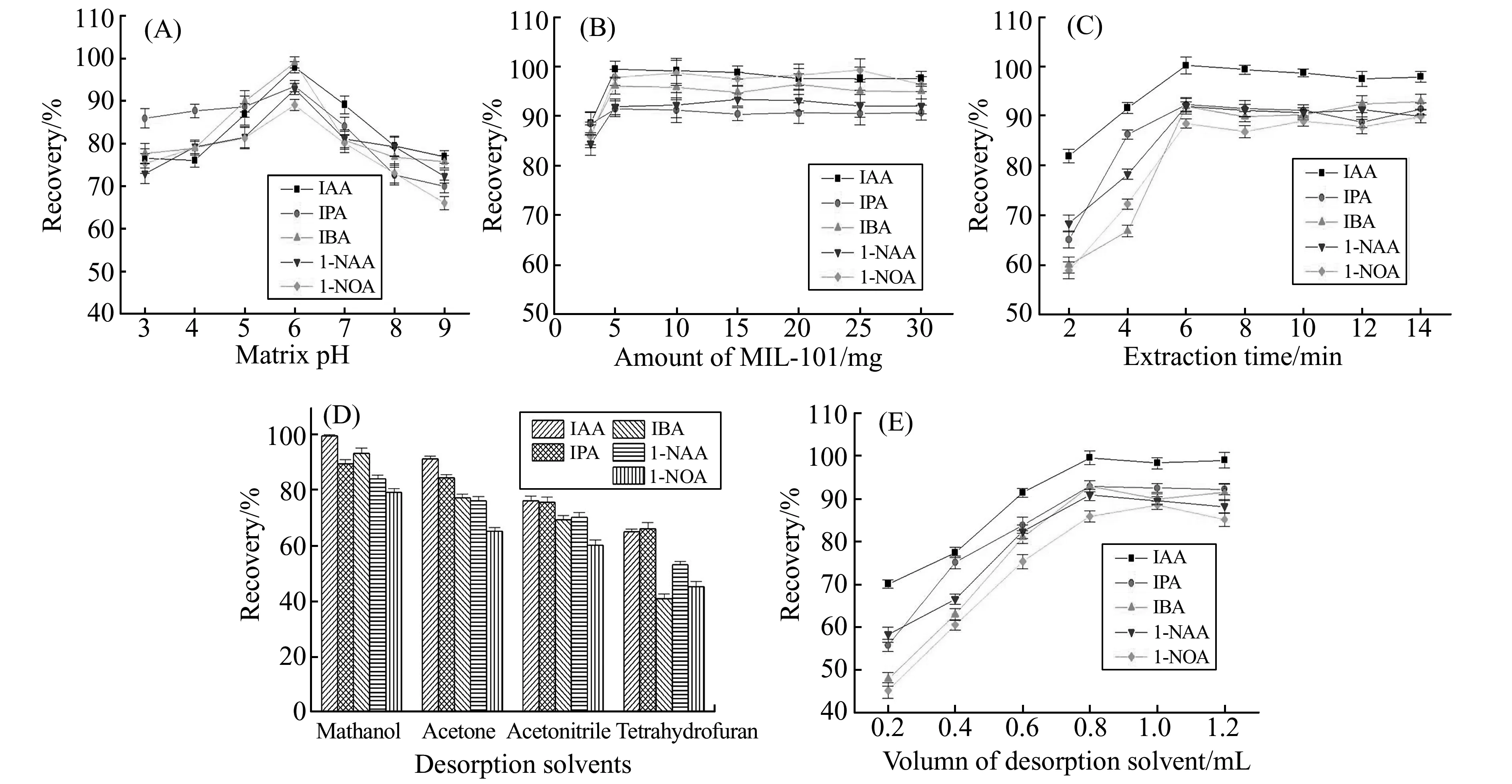
图3 分散固相萃取条件优化Fig.3 Optimization of extraction conditions(A)matrix pH;(B)amount of MIL-101;(C)extraction time;(D)desorption solvent;(E)desorption volume.
2.3 标准曲线、回收率和检出限
采用空白基质配制1、2、5、10、20、50、100 μg/L的系列混合标准溶液,在最优条件下富集和测定,以目标物浓度(x)为横坐标、色谱峰面积(y)为纵坐标绘制标准曲线,结果表明在1~100 μg/L范围内,各标准品浓度与峰面积值均有良好的线性关系,见表1。分别在10、50、100 μg/L 3个添加水平下进行加标回收试验,每个水平重复5次,回收率和相对标准偏差(RSDs)见表2。结果表明,在3个加标水平下,5种PGRs回收率为88.4%~103.8%,RSDs为2.7%~5.1%,检出限(信噪比S/N)≥3为0.07~0.25 μg/L,定量限(信噪比S/N≥10)为0.25~0.80 μg/L。

表1 5种PGRs的标准曲线、相关系数、检出限(LODs)Table 1 Calibration curves,correlation coefficients(r),limits of detection(LOD) and limits of quantitation(LQD) of 5 PGRs
ay:peak area;x:concentration(μg/L).
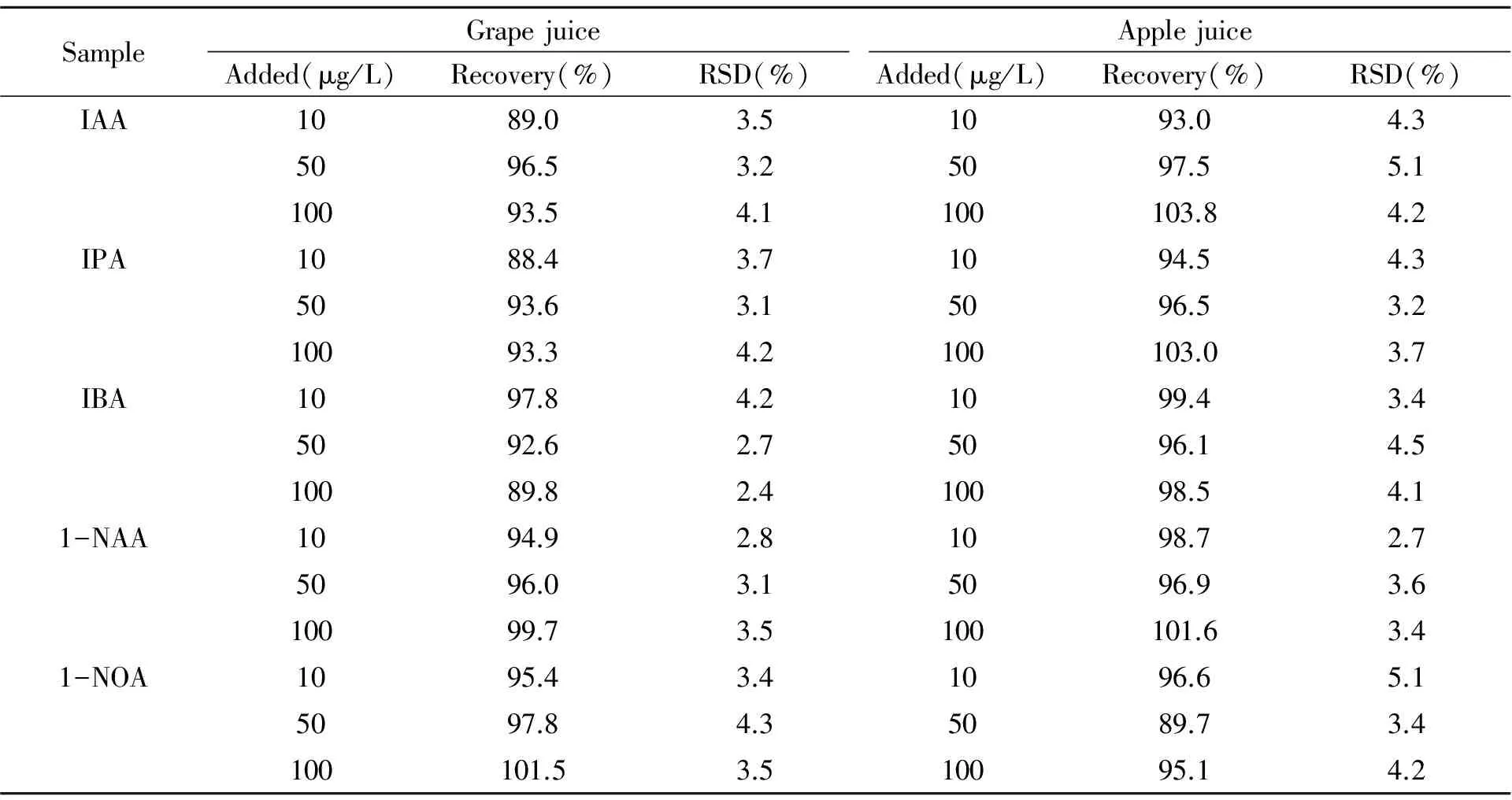
表2 5种PRGs的回收率和相对标准偏差(n=5)Table 2 Recoveries and relative standard deviations of 5 PGRs(n=5)
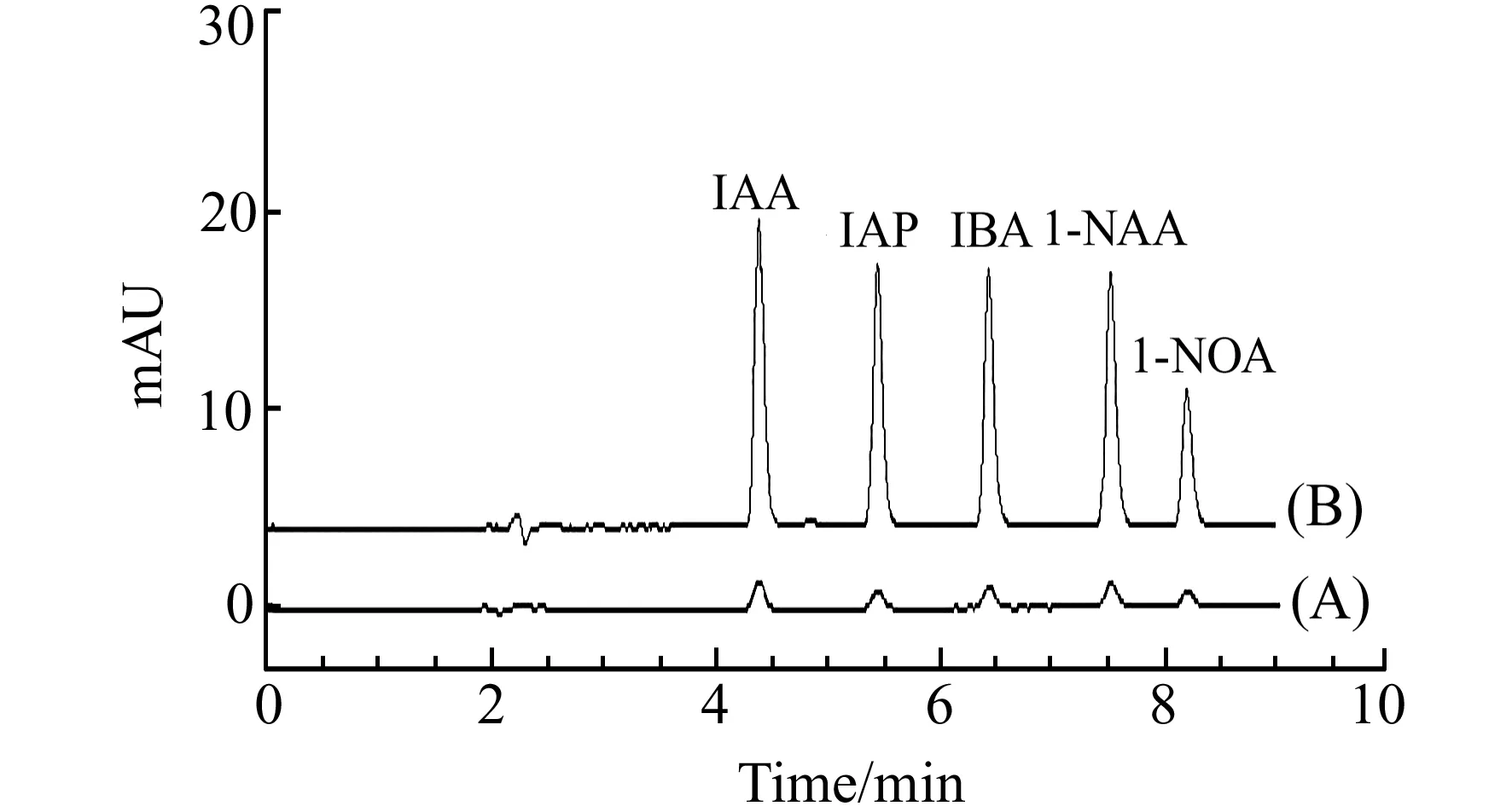
图4 果汁样品加标1 μg/L色谱图Fig.4 The chromatograms of spiked 1 μg/L samples(A) directly injected to HPLC;(B) analyzed after MIL-101 based SPE.
2.4 样品分析
在最优条件下,按1.4和1.5节所述方法对市售果汁样品进行提取并测定,均未发现目标分析物。加标样品色谱分离图如图4所示,5种PGRs得到充分分离,基线平稳且谱图干净,表明该方法具有较好的选择性。
3 结论
本文采用基于金属-有机骨架材料MIL-101的分散固相萃取法,并结合高效液相色谱-荧光检测技术,建立了一种同时检测果汁饮料中5种PGRs的分析方法。该方法选择性好,检测限低、回收率高、重复性好,可满足果汁等饮料样品中目标物的分析。
参考文献:
[1] CAI Y P,SUN Z W,WANG X Y,et al.Chinese Journal of Analytical Chemistry(蔡轶平,孙志伟,王小艳,等.分析化学),2015,43(3):419.
[2] WU P G,TAN Y,ZHANG J,et al.Chinese Journal of Analytical Chemistry(吴平谷,谭莹,张晶,等.分析化学),2014,42(6):866.
[3] ZHANG X,WANG G Q,YU X F,et al.Physical Testing and Chemical Analysis Part B:Chemical Analysis(张旭,王国琴,余晓峰,等.理化检验-化学分册),2013,49(5):559.
[4] ZHONG L L,LEI S R,GUO L A,et al.Chinese Journal of Analysis Laboratory(仲伶俐,雷绍荣,郭灵安,等.分析试验室),2016,35(1):51.
[5] XING L J,WANG Y,XIANG X L,et al.Anhui Agricultural Science Bulletin(邢丽杰,王远,向晓黎,等.安徽农学通报),2015,21(10):33.
[6] MOU Y L,GUO D H,DING Z P.Chinese Journal of Chromatography(牟艳莉,郭德华,丁卓平.色谱),2013,31(10):1016.
[7] SHI J L,KONG G H,PANG T,et al.Journal of Analytical Science(师君丽,孔光辉,逄涛,等.分析科学学报),2016,32(4):510.
[8] GONG M X,WANG R S,HE L F,et al.Journal of Analytical Science(龚明霞,王日升,何龙飞,等.分析科学学报),2016,32(6):789.
[9] FU Y Y,YAN X P.Pogress in Chemistry(付艳艳,严秀平.化学进展),2013,25(2):221.
[10] Rocío-Bautista P,Pacheco-Fernández I,Pasán J,Pino V.Analytica Chimica Acta,2016,939:26.
[11] Hu Y,Huang Z,Liao J,Li G.Analytical Chemistry,2013,85(14):6885.
[12] Liu L,Xia L,Wu C,Qu F,Li G,Sun Z,You J.Talanta,2016,154:23.
[13] Huo S H,Yan X P.Analyst,2012,137:3445.
[14] Huang Z,Lee H K.Journal of Chromatography A,2015,1401:9.

