一种建立小鼠2型糖尿病心肌病模型的方法*
王金鑫, 段 鹏, 朱庆磊△
(1解放军总医院心内科,北京 100853; 2解放军371医院心内科,河南 新乡 453000)
糖尿病是导致糖尿病心肌病的重要原因,糖尿病心肌病严重威胁糖尿病患者的生命健康。自Hayat等[1]首次提出糖尿病心肌病概念以来,国内外众多学者对其机制进行了研究,但其中仍有许多未知因素,其防治也未得到根本性改善[2]。因此,我们需要建立糖尿病心肌病的动物模型以明确糖尿病心肌病的发病机制。
当前,糖尿病心肌病的动物模型有:(1)自发性模型,如ob/ob小鼠、db/db小鼠、GK大鼠和OLETF大鼠等;(2)诱发性模型,如单纯高糖高脂饮食(high-fat diet,HFD)、一次大剂量腹腔注射链脲佐菌素(streptozotocin,STZ)、多次小剂量腹腔注射STZ和HFD结合腹腔注射STZ等[3-4]。虽然动物模型有多种,但大都存在一些缺点,如自发性模型的费用较高,且此类基因突变的动物模型不适宜评价药物疗效;单纯HFD诱导动物模型的造模时间较长;腹腔注射大剂量STZ造成动物死亡率增高;多次小剂量腹腔注射STZ操作较为繁琐等。而采用HFD结合腹腔注射STZ建立2型糖尿病心肌病小鼠模型相比而言具有诸多优势。目前,国内外在采用连续HFD结合STZ建立2型糖尿病心肌病大鼠模型的研究较多[5-7],但以此方法制备小鼠模型的文献则较为罕见。由于小鼠模型存在世代周期短、操作方便和遗传修饰研究相对成熟等优势,所以建立2型糖尿病心肌病小鼠模型有利于深入研究2型糖尿病心肌病。本研究采用连续HFD结合单次腹腔注射低剂量STZ的方法,建立小鼠2型糖尿病心肌病模型。
材 料 和 方 法
1 实验动物
5~6周龄C57BL/6J雄性小鼠,购于解放军总医院医学实验动物中心,动物质量合格证编号为No. 11400700164757。小鼠饲养于解放军总医院医学实验动物中心,SPF级。室温保持在20~26 ℃,湿度为0.4~0.7,每天12 h昼夜循环(光照时间为7:00 AM~7:00 PM),自由进食水。造模实验开始前,适用性饲养1周。所有操作均符合解放军总医院实验动物福利伦理委员会的要求。
2 药品与试剂
高脂饲料购于Research Diets;普通饲料购于北京斯贝福公司;STZ、柠檬酸和柠檬酸钠均购于Sigma;40 g/L多聚甲醛购于北京索莱宝公司。
3 实验方法
3.1造模方法 将40只小鼠随机分成2组:对照组(control组)和HFD+STZ组,每组各20只小鼠。Control组以普通饲料喂养;HFD+STZ组以高脂饲料喂养4周后,禁食不禁水约12 h,以100 mg/kg的剂量腹腔注射STZ(100 g/L溶于柠檬酸缓冲液),control组小鼠腹腔注射等体积柠檬酸缓冲液[8]。密切监测小鼠体重和血糖变化,于第11周和第16周分别选择control 和HFD+STZ 组小鼠进行心功能检测、血清胰岛素水平检测、组织学观察和心肌细胞凋亡分析。
3.2体重(body weight,BW)和血糖测量 分别于造模实验开始(0周)、5周、6周、11周和16周,禁食不禁水约12 h后称重,取鼠尾血用血糖仪测量空腹血糖值(fasting blood glucose,FBG)。以空腹血糖值>13.89 mmol/L认为2型糖尿病小鼠造模成功[9]。
3.3心功能测定 用异氟烷吸入麻醉小鼠,固定于实验台上,使用高分辨率小动物超声影像系统Vevo 770TM(VisualSonics)检测心功能。检测指标包括二尖瓣E′峰与A′峰之比(ratio of early diastolic peak E′ velocity to late diastolic peak A′ velocity, E′/A′)、二尖瓣E峰与E′峰之比(ratio of mitral valve E velocity to E′ velocity, MV E/E′)、心输出量(cardiac output, CO)、左室射血分数(left ventricular ejection fraction,LVEF)以及左室短轴缩短率(left ventricular fractional shortening,LVFS)。取3次测量的平均值。
3.4ELISA检测 取小鼠眼球血离心得到血清,用小鼠胰岛素检测试剂盒(ALPCO)检测血清胰岛素水平。
3.5组织学分析 取小鼠心肌组织用40 g/L多聚甲醛溶液固定8~12 h,石蜡包埋,组织切片,苏木素-伊红染色。用荧光显微镜(Olympus)观察,分析心肌的病理形态情况并定量,随机选取的小鼠心肌相似截面,并从心肌切片截面上随机选取10个心肌细胞,计算其平均值,定量分析心肌细胞面积。
3.6心肌细胞凋亡分析 取小鼠心脏组织用40 g/L多聚甲醛溶液固定,石蜡包埋,组织切片,60 ℃孵化15 min,脱蜡,再水化。小鼠心室肌细胞的凋亡水平使用TUNEL检测试剂盒(Roche)检测。用荧光显微镜观察,进行图像分析和定量,用Image-Pro Plus软件在切片截面上进行细胞计数,计算心肌细胞凋亡率。
由式(5)可知,代替fal函数的反双曲函数的TD中的参数有a1、a2、R、b等4个。这些参数的整定一般运用以往的调试经验试凑法获得。[7]
4 统计学处理
统计软件采用SPSS 17.0。数据以均数±标准差(mean±SD)或均数±标准误(mean±SEM)表示。组间多重比较行单因素方差分析后采用 SNK-q检验或Tamhane’s T2检验,进行各组均数间两两比较;两独立样本比较选用t-test。以P<0.05 为差异有统计学意义。
结 果
1 造模过程中小鼠体重的变化
各组小鼠在造模过程中的体重变化情况显示,经过4周高脂饲料喂养后,HFD+STZ组小鼠相对于control组体重增加(P<0.05);注射STZ 1周后HFD+STZ组小鼠体重略有下降,但仍比control组高(P<0.05);造模第11周和第16周,小鼠体重持续增加,与control组相比均有显著差异(P<0.05),见图1。
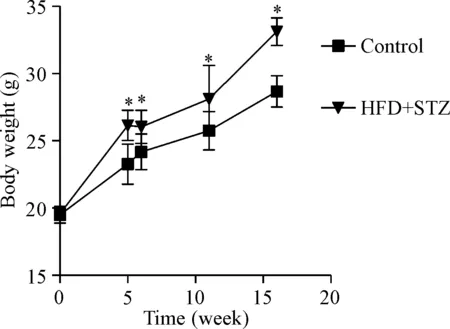
Figure 1. The body weight of mice in the 2 groups. Mean±SD.n=20.*P<0.05vscontrol group.
图1各组小鼠体重的比较
2 造模过程中小鼠空腹血糖的变化
在造模过程中小鼠的空腹血糖变化情况示,control组小鼠血糖值较为稳定;经过4周高脂饲料喂养后,HFD+STZ组小鼠相对于control组血糖有所增加(P<0.05),但未达到13.89 mmol/L,注射STZ 1周后HFD+STZ组血糖显著增加(>13.89 mmol/L),造模第11周血糖继续增加,第16周血糖较之前比略有下降,但仍高于13.89 mmol/L。造模第6、11和16周小鼠的血糖与同时期control组相比均有显著差异(P<0.05),见图2。
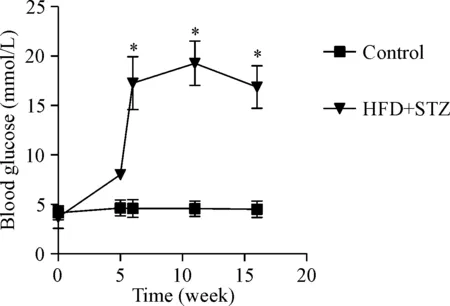
Figure 2. Blood glucose of mice in the 2 groups. Mean±SD.n=20.*P<0.05vscontrol group.
图2各组小鼠血糖的比较
3 小鼠血清胰岛素水平
ELISA检测显示,在造模第11周和16周时,HFD+STZ组小鼠与同时期正常对照组相比血清胰岛素水平均降低(P<0.05),见图3。
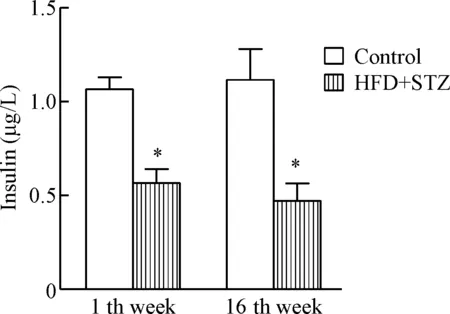
Figure 3. The changes of the serum insulin in the 2 groups. Mean±SEM.n=10.*P<0.05vscontrol group.
图3小鼠血清胰岛素水平的变化
4 小鼠心功能相关指标的变化
于造模第11周和第16周分别选择control组和HFD+STZ组进行心功能检测,结果见表1。造模第11周,HFD+STZ组小鼠与control组相比,E′/A′增大(P<0.05),其它指标变化不明显;造模第16周,HFD+STZ组小鼠与control组相比,E′/A′和MV E/E′增大(P<0.05),CO、LVEF和LVFS减小(P<0.05)。
表1小鼠造模后不同时点心功能相关指标的比较
Table 1. The echocardiographic parameters of mice in the 2 groups at different time points (Mean±SD.n=10)
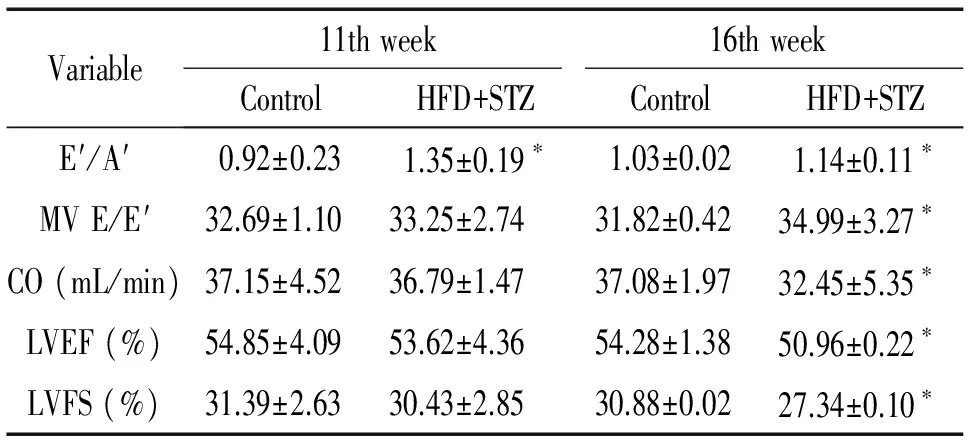
Variable11thweek16thweekControlHFD+STZControlHFD+STZE′/A′0.92±0.231.35±0.19∗1.03±0.021.14±0.11∗MVE/E′32.69±1.1033.25±2.7431.82±0.4234.99±3.27∗CO(mL/min)37.15±4.5236.79±1.4737.08±1.9732.45±5.35∗LVEF(%)54.85±4.0953.62±4.3654.28±1.3850.96±0.22∗LVFS(%)31.39±2.6330.43±2.8530.88±0.0227.34±0.10∗
*P<0.05vscontrol group.
5 小鼠心肌病理形态的改变
小鼠心肌组织切片HE染色观察和定量分析显示,造模第16周,HFD+STZ组小鼠心肌组织结构中可见心肌细胞明显肥大,心肌细胞面积明显大于同时期control组(P<0.05);与造模第11周时control组相比,同时期HFD+STZ组小鼠心肌细胞面积变化不明显,见图4。
6 小鼠心肌细胞凋亡分析
小鼠心肌细胞凋亡分析显示,在造模第16周时,HFD+STZ组小鼠心肌细胞凋亡率明显大于同时期control组(P<0.05);与造模第11周时control组相比,同时期HFD+STZ组小鼠心肌细胞凋亡率变化不明显,见图5。
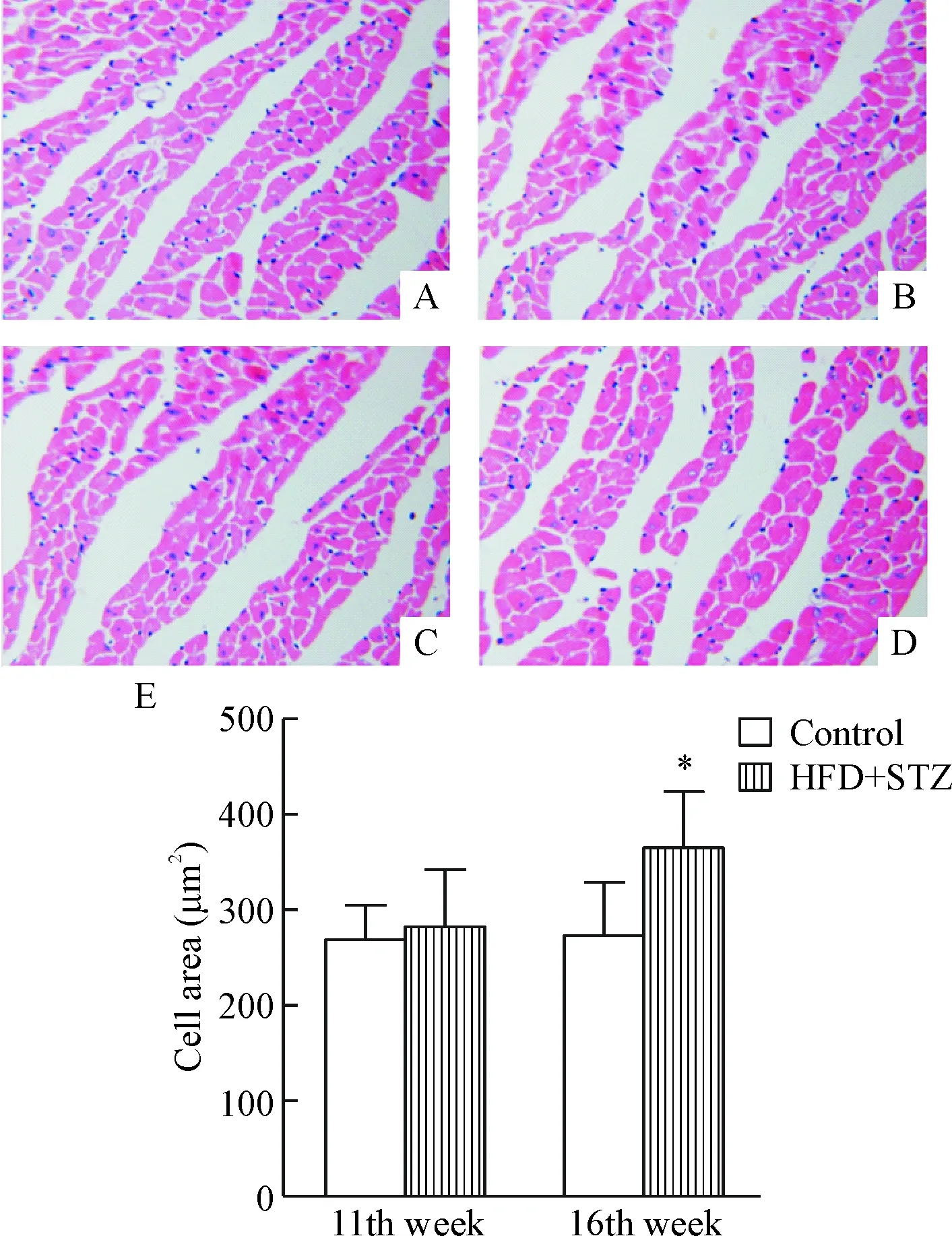
Figure 4. HE staining of the heart tissues and cell area quantification in the 2 groups (×400). A: control group (11th week); B: HFD+STZ group (11th week); C: control group (16th week); D: HFD+STZ group (16th week); E: the quantitative analysis of the cell area. Mean±SD.n=10.*P<0.05vsgroup.
图4小鼠心脏的HE染色结果
讨 论
2型糖尿病约占所有糖尿病患者的90%以上,并且有证据显示60%~75%的血糖控制良好且无其它并发症的2型糖尿病患者被证明存在舒张期功能障碍,其中28%发展为伴左心室充盈压增高的舒张功能严重受损[10]。随着糖尿病病人的增多,糖尿病心肌病的防治已成为社会和医学界共同关注的问题,但其发病机制仍不清楚。因此,建立2型糖尿病心肌病的动物模型并对其发病机制等进行研究具有重要意义。
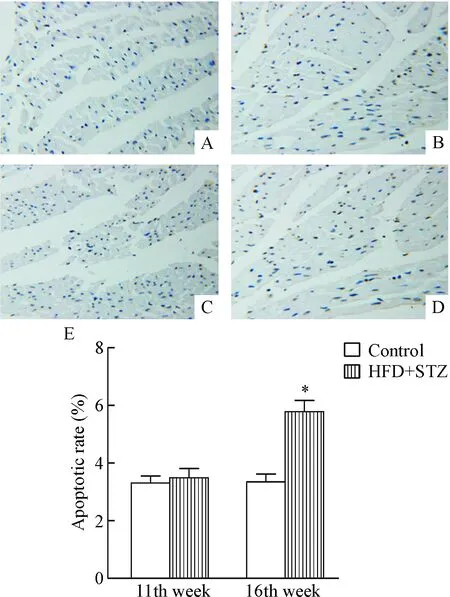
Figure 5. TUNEL analysis of cardiomyocyte apoptosis and apoptosis rate quantification in the 2 groups (×400). A: control group (11th week); B: HFD+STZ group (11th week); C: control group (16th week); D: HFD+STZ group (16th week); E: the quantitative analysis of the apoptotic rate. Mean±SD.n=10.*P<0.05vscontrol group.
图5小鼠心肌细胞凋亡的TUNEL分析
2型糖尿病患者随病程的延长会出现不同程度的心肌舒缩功能异常,其中左室舒张功能的异常较早出现。临床上超声心动图、核素显像等检查发现糖尿病心肌病患者在出现心功能障碍时,主要表现为射血分数降低和峰充盈率降低等变化。2型糖尿病患者的代谢紊乱会导致广泛的心肌损害,表现为心肌细胞肥大、变性、灶性坏死等。鉴于20周龄db/db小鼠出现明显心脏功能障碍[14],本研究分别检测造模第11周(15周龄)和第16周(20周龄)小鼠的心脏功能。超声检测显示,在造模第16周时,HFD+STZ组小鼠与正常对照组相比E′/A′和MV E/E′增大,心输出量、左室射血分数和左室短轴缩短率减小,出现心功能障碍。本研究的组织学和心肌细胞凋亡分析显示,在造模第16周时,HFD+STZ组心肌细胞肥大,心肌细胞面积和凋亡率明显大于同时期正常对照组。造模第11周时2组小鼠上述各项指标变化不明显。本研究的结果与上述人2型糖尿病心肌病的心功能、心肌细胞改变相符。
采用连续HFD结合单次腹腔注射低剂量STZ的方法建立2型糖尿病心肌病小鼠模型有许多优势。(1)其相较于单纯HFD诱导小鼠模型的造模时间较短,有研究显示采用单纯HFD饲养大于24周才能复制出2型糖尿病心肌病小鼠模型[15]。(2)其相较于自发性2型糖尿病心肌病模型,如db/db小鼠,费用更低,并且比此类基因突变的动物模型更适宜评价药物疗效。(3)有文献报道[16],小鼠腹腔注射150 mg/kg或更大剂量的STZ可使血糖升高更明显,但这会造成小鼠死亡率增高,并且这种方法很有可能会诱导成1型糖尿病心肌病模型;也有一些学者采用HFD结合多次注射小剂量STZ的方法建模[17],STZ溶液需要现用现配,操作较为繁琐。本研究给小鼠腹腔单次注射STZ(100 mg/kg),剂量较为适宜,操作也相对简单,未出现小鼠死亡,造模成功率高。
综上所述,采用连续喂养HFD结合单次注射STZ可成功建立2型糖尿病心肌病小鼠模型,并具有造模周期短、成功率高、操作简单、费用低等优势,且与人2型糖尿病心肌病临床特征相符,为深入研究2型糖尿病心肌病的发病机制、治疗药物等提供动物实验模型基础。
[参考文献]
[1] Hayat SA, Patel B, Khattar RS, et al. Diabetic cardio-myopathy: mechanisms, diagnosis and treatment[J]. Clin Sci (Lond), 2004, 107(6):539-557.
[2] Bugger H, Abel ED. Molecular mechanisms of diabetic cardiomyopathy[J]. Diabetologia, 2014, 57(4):660-671.
[3] Joost HG, Al-Hasani H, Schürmann A, et al. Animal models in diabetes research[M]. New York: Humana Press, 2012:47-176.
[4] 吕青兰, 孙 丽, 蒋碧梅, 等. 核仁素对小鼠糖尿病性心肌病心肌肥大与纤维化发生的影响[J]. 中国病理生理杂志, 2017, 33(7):1231-1236.
[5] 钟 明, 张 薇, 苗 雅, 等. 凝血酶敏感蛋白-1在2型糖尿病心肌病大鼠心肌中的表达及意义[J]. 中国病理生理杂志, 2007, 23(9):1671-1675.
[6] 刘 群. 实验性2型糖尿病心肌病大鼠模型建立的方法[J]. 临床心血管病杂志, 2014, 30(3):254-257.
[7] 王 祥, 李长运, 曾秋棠, 等. 大鼠2型糖尿病心肌病模型的建立方法[J]. 中国病理生理杂志, 2006, 22(9):1868-1870.
[8] Mu J, Woods J, Zhou YP, et al. Chronic inhibition of dipeptidyl peptidase-4 with a sitagliptin analog preserves pancreatic β-cell mass and function in a rodent model of type 2 diabetes[J]. Diabetes, 2006, 55(6):1695-1704.
[9] 曾位森, 黄源坚, 邵聪文, 等. 高脂饮食诱导的2型糖尿病模型小鼠的生化及病理分析[J]. 南方医科大学学报, 2014, 34(8):1115-1120.
[10] Dei Cas A, Khan SS, Butler J, et al. Impact of diabetes on epidemiology, treatment, and outcomes of patients with heart failure[J]. JACC Heart Fail, 2015, 3(2):136-145.
[11] Zhang X, Wang Z, Huang Y, et al. Effects of chronic administration of alogliptin on the development of diabetes and β-cell function in high fat diet/streptozotocin diabetic mice[J]. Diabetes Obes Metab, 2011, 13(4): 337-347.
[12] Kusakabe T, Tanioka H, Ebihara K, et al. Beneficial effects of leptin on glycaemic and lipid control in a mouse model of type 2 diabetes with increased adiposity induced by streptozotocin and a high-fat diet[J]. Diabetologia, 2009, 52(4):675-683.
[13] Poucher SM, Cheetham S, Francis J, et al. Effects of sa-xagliptin and sitagliptin on glycaemic control and pancrea-tic β-cell mass in a streptozotocin-induced mouse model of type 2 diabetes[J]. Diabetes Obes Metab, 2012, 14(10):918-926.
[14] Qi Y, Xu Z, Zhu Q, et al. Myocardial loss of IRS1 and IRS2 causes heart failure and is controlled by p38α MAPK during insulin resistance[J]. Diabetes, 2013, 62(11): 3887-3900.
[15] Qi Y, Zhu Q, Zhang K, et al. Activation of foxo1 by insulin resistance promotes cardiac dysfunction and β-myosin heavy chain gene expression[J]. Circ Heart Fail, 2015, 8(1):198-208.
[16] Masaki I, Hideaki K, Yasuyo I, et al. Nerve growth factor is critical for cardiac sensory innervation and rescues neuropathy in diabetic hearts[J]. Circulation, 2006, 114(22):2351-2363.
[17] Gilbert ER, Fu Z, Liu D. Development of a nongenetic mouse model of type 2 diabetes[J]. Exp Diabetes Res, 2011, 2011:416254.

