去甲肾上腺素减轻脂多糖所致内皮细胞损伤*
胡 静, 龙燕琼, 岳 阳, 刘作良
(中南大学湘雅三医院, 湖南 长沙 410013)
脓毒症(sepsis)是指由感染或有高度可疑感染灶引起的全身炎症反应综合征。已有研究表明,在脓毒症的病理生理改变中,血管内皮细胞(vascular endothelial cells,VECs)会受到损伤,是脓毒症炎症反应的靶细胞;损伤的VECs释放多种炎性因子,加重脓毒症的进展,故VECs又是效应细胞[1-2]。儿茶酚胺类药物去甲肾上腺素(norepinephrine,NE)是改善脓毒症患者血流动力学紊乱的常用药物。本研究拟构建内皮细胞脓毒症损伤模型,初步探讨NE对内皮细胞的保护作用及其具体机制。
材 料 和 方 法
1 药品和试剂
NE和二甲基亚砜(Sigma);DMEM培养基(Gibco);小牛血清(杭州四季青);逆转录试剂盒和real-time PCR试剂盒(TaKaRa);TNF-α、IL-1β、IL-2和IL-10 ELISA试剂盒(武汉博士德);BCA蛋白定量试剂盒(江苏碧云天);山羊抗血管内皮型钙黏素(VE-cadherin)抗体(Millipore);HRP标记的兔抗山羊 II 抗(MBI)。
2 方法
2.1细胞培养 解冻复苏人脐静脉内皮细胞HUVEC-12后加入含10%胎牛血清的DMEM养液制成细胞悬液,分种于培养瓶中,再静置于CO2培养箱中培养(37 ℃)。每隔2 d换培养液1次,待细胞亚融合时0.25%胰蛋白酶消化传代。取4~6代呈亚融合的细胞铺种于6孔板或者12孔板,待细胞80%融合时进行不同的处理。
2.2MTT法检测细胞活力 用含10%胎牛血清的低糖DMEM培养基将刚消化离心的内皮细胞重悬,以1×108/L的密度接种于96孔板,每孔200 μL,96孔板四周加200 μL PBS封孔。置于37 ℃、5% CO2培养箱中静置培养,贴壁后弃细胞上清,加入新鲜的含1%胎牛血清的低糖DMEM培养基,同步化细胞。12 h后,实验分为4组,空白对照(control)组加入100 μL不含LPS的培养液,其余3组为实验组,分别加入LPS终浓度为50 mg/L和100 mg/L、200 mg/L 的培养液,置于37 ℃、5% CO2培养箱中培养。在培养12 h、24 h和48 h时分别取出96孔板,避光,每孔加入10 μL的MTT工作液(5 g/L),置于37 ℃、5%CO2培养箱中培养4 h,终止培养。吸走孔内的培养基,每孔加入DMSO 200 μL,置摇床上振荡15 min至蓝紫色结晶完全溶解,酶标仪上测定490 nm波长各孔吸光度(A)。细胞抑制率(%)=(空白组A值-实验组A值)/空白组A值×100%。
2.3细胞培养上清液中TNF-α、IL-1β、IL-2和IL-10含量的测定 消收集细胞培养板中的上清液后按照试剂盒说明书测定TNF-α、IL-1β、IL-2和IL-10的含量。
2.4细胞内活性氧簇(reactive oxygen species,ROS)的测定 将细胞以1×108/L的密度接种于96孔板中, 药物处理后, PBS冲洗细胞3遍, 加入含有10 μmol/L DCFH-DA 的培养液,37 ℃ 细胞培养箱中避光孵育20 min, 用无血清培养液冲洗细胞3次, 然后用荧光分光光度计测定荧光强度,其激发波长为488 nm, 发射波长为525 nm。
2.5Real-time PCR 应用Prime Premier 5.0软件设计目的基因和内参照基因引物,引物由上海生工生物工程技术服务有限公司合成。VE-cadherin的正向引物序列为5’-ACAGACCGCCGTCTAACTCAAA-3’,逆向引物序列为5’-AGATAGGCACCAGGACCTCACC-3’;GAPDH(内参照)的正向引物序列为5’-CTGCACCACCAACTGCTTAG-3’,逆向引物序列为5’-AGGTCCACCACTGACACGTT-3’。PCR 反应参数为:预变性95 ℃ 10 s; 95 ℃变性5 s、60 ℃退火和延伸31 s,共40个循环,在延伸的过程中搜集荧光信号。于每次扩增的同时设置无 cDNA的阴性对照,将 PCR产物做熔解曲线,以证实以上 PCR 反应产物特异性良好。用7300 System SDS Software 分析数据,计算2-ΔΔCt值以比较各组mRNA的表达。
2.6Western blot检测蛋白水平 将指数生长期的内皮细胞分为正常对照(control)组、100 mg/L LPS组(LPS组)及LPS损伤与NE低、中、高剂量共同作用(LPS+50 mg/L NE、LPS+100 mg/L NE和LPS+200 mg/L NE)组,各处理组与人脐静脉内皮细胞株共同孵育24 h后收集细胞,用PBS重悬,提取蛋白。蛋白样品定量后与上样缓冲液混合均匀,95 ℃ 5 min变性,自然冷却后上样于凝胶加样孔内,上样量为20 μg,60 V集成、120 V恒压电泳。转膜48 min后,用5%牛奶封闭1 h后加适量稀释的 I 抗,4℃孵育16 h,洗膜后加适量稀释的相应 II 抗,室温摇床反应 1 h,洗膜后按照 ECL 发光试剂盒说明书进行显色。
3 统计检验方法
所有数据均以均数±标准差(mean±SD)表示。多组均数比较选择单因素方差分析(one-way ANOVA),两两比较采用Student-Newman-Keuls (SNK)检验。使用SPSS 13.0软件进行统计分析,以P<0.05为差异有统计学意义。
结 果
1 LPS诱导内皮细胞损伤模型的建立
MTT实验结果显示,细胞抑制率随着LPS浓度的升高和作用时间的延长而显著增加,当LPS浓度达到100 mg/L,作用细胞24 h后,其细胞抑制率达50%左右,选定为后续实验条件,见图1。

Figure 1. The effects of different concentrations of LPS for diffe-rent time on the viability of the endothelial cells. Mean±SD.n=6*P<0.05vs12 h;#P<0.05vs24 h;△P<0.05vs50 mg/L;▲P<0.05vs100 mg/L.
图1各组细胞MTT实验结果
2 不同浓度NE对LPS损伤内皮细胞释放炎性因子的影响
检测细胞上清中TNF-α、IL-1β、IL-2和IL-10的浓度,结果示,与对照组相比,LPS组TNF-α、IL-1β和IL-2水平明显上升, IL-10的浓度明显下降(P<0.05);与LPS组相比,不同浓度的NE可逆转TNF-α、IL-1β、IL-2和IL-10的含量变化,见表1。

表1 不同浓度NE对LPS损伤内皮细胞释放炎性因子的影响
##P<0.01vscontrol group;*P<0.05,**P<0.01vsLPS group.
3 不同浓度NE对内皮细胞中LPS诱导的ROS水平上调的影响
内皮细胞经100 mg/L LPS处理24 h后,与对照组相比,LPS组细胞的ROS水平上升(P<0.05);当使用低、中、高浓度的NE预处理细胞后,与模型组相比,细胞内ROS水平均显著下降(P<0.05或P<0.01),见图2。这表明NE对LPS引起的细胞内ROS生成增多有明显的抑制作用。

Figure 2. The effects of NE on ROS production induced by LPS. Mean±SD.n=3.##P<0.01vscontrol group;*P<0.05,**P<0.01vsLPS group.
图2不同浓度NE对LPS诱导的内皮细胞ROS水平的影响
4 不同浓度NE对内皮细胞中LPS诱导的VE-cadherin mRNA下调的影响
Real-time PCR结果显示,100 mg/L LPS使内皮细胞中VE-cadherin mRNA的表达明显下调(P<0.01),不同浓度(50 mg/L、100 mg/L和200 mg/L)NE可恢复VE-cadherin mRNA的表达水平,见图3。
5 不同浓度NE对LPS刺激内皮细胞VE-cadherin蛋白表达的影响
Western blot实验结果显示,与对照组比较,100mg/L LPS处理细胞后,细胞中VE-cadherin的蛋白表达明显下调(P<0.05);与LPS组相比,不同浓度NE预处理细胞后,VE-cadherin的蛋白表达明显上升,见图4。
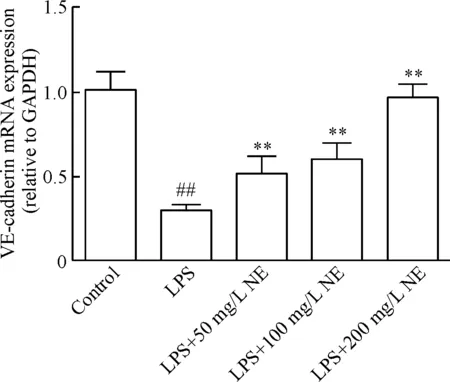
Figure 3. The effects of NE on the mRNA expression of VE-cadherin induced by LPS. Mean±SD.n=3.##P<0.01vscontrol group;**P<0.01vsLPS group.
图3不同浓度NE对LPS诱导内皮细胞VE-cadherinmRNA表达的影响
讨 论
血管内皮在维持心血管系统的稳态中发挥极其重要的作用,在生理情况下,只有极小部分(<0.1%)内皮细胞发生凋亡,脓毒症病人血液中的凋亡内皮细胞数量明显增多,并且与病人的预后呈线性关系[3]。脓毒症中大量炎性介质如TNF-α、IL-1β和IL-2释放入血可以诱导内皮细胞凋亡[4];内皮细胞凋亡、脱落导致血管屏障功能受损并进一步释放促炎因子;血管通透性升高和防御功能减弱导致组织水肿,病原菌侵入组织,加重脓毒症的发展,进而引起有效循环血量不足和器官组织功能损害。
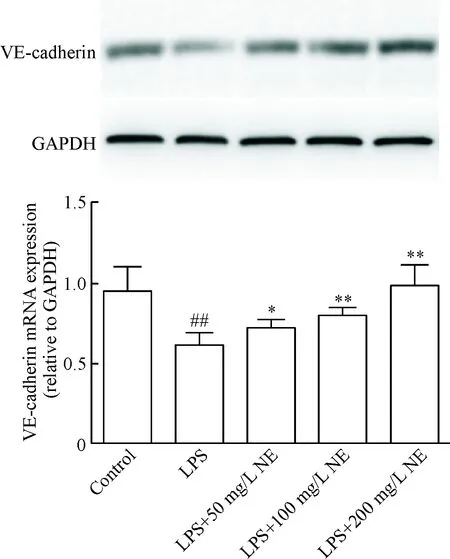
Figure 4. The effects of NE on VE-cadherin protein expression in the endothelial cells injured by LPS. Mean±SD.n=3.##P<0.01vscontrol group;*P<0.05,**P<0.01vsLPS group.
图4不同浓度NE对LPS诱导内皮细胞VE-cadherin蛋白表达的影响
VE-cadherin是内皮细胞中的特异性蛋白,位于内皮细胞间连接处,是内皮细胞黏附连接的主要组成部分,属于II型钙黏蛋白[5]。脓毒症时大量的炎性细胞和炎性介质通过已知的、未知的信号途径导致黏附连接的局部分解、黏附连接复合体的解体、胞浆内肌动蛋白微丝系统重组,从而引起内皮细胞黏附连接受损,内皮细胞间通透性增加。可能的机制主要包括脓毒症时活化的中性粒细胞以及其它细胞可以释放多种酶,如基质金属蛋白酶,直接使血管内皮细胞表面的VE-cadherin分解,细胞间的黏附结构被破坏,引起通透性增加。Herwig等[6]研究显示,在脓毒症所致的急性呼吸窘迫综合征中,VE-cadherin的表达减少是导致血管通透性增加的一项重要机制。
本文研究结果提示,LPS所致内皮细胞损伤使细胞处于明显的氧化应激损伤状态,VE-cadherin的 mRNA及蛋白表达均明显抑制,TNF-α、IL-1β和IL-2水平明显上升, IL-10的浓度明显下降;不同浓度的NE处理能抑制LPS所致VE-cadherin的下调,并抑制炎性因子TNF-α、IL-1β和IL-2的水平,改善内皮细胞的氧化应激状态。根据实验结果,我们认为LPS通过刺激内皮细胞释放促炎因子而抑制VE-cadherin的水平,其机制可能是LPS诱导了内皮细胞微环境中TNF-α、IL-1β和IL-2的表达,从而激活包括NF-κB在内的一系列下游信号通路,进一步导致促炎因子的上调,另一方面LPS损伤内皮细胞后还可以诱导氧化应激和活性氧簇的生成,从而对内皮细胞的功能造成损伤。NE能够明显逆转感染性患者外周血管扩张,改善胃肠道血液灌注,对肠道黏膜屏障具有保护作用[7],我们的研究结果表明NE的内皮保护作用可能是通过上调内皮损伤中VE-cadherin的表达及对氧化应激水平的抑制而发挥。本实验虽然对NE的内皮保护作用及其机制做了初步探讨,但仍需要大量的体内外实验进一步验证NE发挥作用的具体分子机制。
[参考文献]
[1] Chen H, Xie K, Han H, et al. Molecular hydrogen protects mice against polymicrobial sepsis by ameliorating endothelial dysfunction via an Nrf2/HO-1 signaling pathway[J]. Int Immunopharmacol, 2015, 28(1):643-654.
[2] Macdonald S, Bosio E, Neil C, et al. Resistin and NGAL are associated with inflammatory response, endothelial activation and clinical outcomes in sepsis[J]. Inflamm Res, 2017, 66(7):611-619.
[3] Muller AM, Gruhn KM, Herwig MC, et al. VE-cadherin and ACE: markers for sepsis in post mortem examination?[J]. Leg Med (Tokyo), 2008, 10(5):257-263.
[4] Stefanec T. Endothelial apoptosis: could it have a role in the pathogenesis and treatment of disease?[J]. Chest, 2000, 117(3):841-854.
[5] Blaise S, Polena H, Vilgrain I. Soluble vascular endothelial-cadherin and auto-antibodies to human vascular endothelial-cadherin in human diseases: two new biomarkers of endothelial dysfunction[J]. Vasc Med, 2015, 20(6):557-565.
[6] Herwig MC, Tsokos M, Hermanns MI, et al. Vascular endothelial cadherin expression in lung specimens of patients with sepsis-induced acute respiratory distress syndrome and endothelial cell cultures[J]. Pathobiology, 2013, 80(5):245-251.
[7] Harrois A, Baudry N, Huet O, et al. Norepinephrine decreases fluid requirements and blood loss while preserving intestinal villi microcirculation during fluid resuscitation of uncontrolled hemorrhagic shock in mice[J]. Anesthesiology, 2015, 122(5):1093-1102.

