脱氢表雄酮抑制高脂诱导的兔主动脉及人脐静脉内皮细胞细胞间黏附分子1的表达*
周 颖, 赵 敏, 李 桃, 张 辉, 肖 芳
(秦皇岛市第一医院病理科,河北 秦皇岛 066000)
脱氢表雄酮(dehydroepiandrosterone,DHEA)是内源性甾体类前体激素,血浆DHEA水平随年龄增长而降低。近年来大量研究显示[1-2],DHEA可以抑制动脉粥样硬化(atherosclerosis,AS)的形成和发展,然而其作用机制尚未明确。维甲酸受体被激活后可增强DHEA转化为雌激素的关键酶——细胞色素P450芳香酶的表达,由此推想,补充全反式维甲酸(all-transretinoic acid, ATRA)可以特异性地增强DHEA的抗AS作用。细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)是一种细胞表面的黏附分子,能促进免疫细胞浸润,使单核细胞和淋巴细胞黏附于内皮,然后迁移入内皮下,单核细胞分化为巨噬细胞,形成泡沫细胞进而促进AS的发生发展[3]。本实验从体外、体内2个水平研究DHEA对高脂诱导的ICAM-1表达的影响,以及全反式维甲酸在这一过程中的作用,从而探讨DHEA抗AS的可能机制。
材 料 和 方 法
1 材料
FBS和M199培养基购自Gibco;氧化型低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)由中山医科大学公共卫生学系提供;DHEA购自Fluka;引物和Trizol购自Invitrogen;M-MLV逆转录酶和Oligo(dT)购自TOYOBO;全反式维甲酸购自山东良福集团制药有限公司;内皮细胞生长添加剂购自Sigma;Taq酶和dNTP购自天为时代公司;GoldView核酸染料购自赛百盛公司;ELISA试剂盒购自R&D;抗 ICAM-1抗体及通用型SP试剂盒均购自福州迈新生物技术开发公司。
2 方法
2.1人脐静脉内皮细胞(human umbilical venous endothelial cells,HUVECs)的原代培养与分组 用胰酶消化法获取HUVECs。采用内含15% FBS、0.03%谷氨酰胺和50 mg/L 内皮细胞生长添加剂的M199培养基于37 ℃、5% CO2培养箱中孵育。每3~4 d传代1次,将1~3代的细胞用于实验。将生长良好的细胞换用无血清DMEM/F12培养基,培养12 h后,分为5组:(1)正常对照(control)组:DMEM/F12培养基;(2) ox-LDL组:DMEM/F12培养基+25 mg/L ox-LDL;(3) ox-LDL+DHEA组:DMEM/F12培养基+25 mg/L ox-LDL+1 μmol/L DHEA;(4) ox-LDL+DHEA+ATRA组:DMEM/F12培养基+25 mg/L ox-LDL+1 μmol/L DHEA+10-8mol/L全反式维甲酸;(5) DHEA组:DMEM/F12培养基+1 μmol/L DHEA。以上各组均用相应药物作用24 h。
2.2RT-PCR反应 用Trizol一步法提取各组HUVECs的总RNA,每组取4 μg总RNA逆转录成cDNA。取2 μL cDNA产物进行RT-PCR反应。ICAM-1的上游引物序列为5’-CAGTGACCATCTACAGCTTTCCGG-3’,下游引物序列为5’-GCTGCTACCACAGTGATGATGACAA-3’,扩增产物长450 bp;内参照GAPDH的上游引物序列为5’-GCTGGGGCTCACCTGAAGGG-3’ ,下游引物序列为5’-GGATGACCTTGCCCACAGCC-3’ ,扩增产物长度384 bp。PCR反应体系为每20 μL反应体系中包含 10×buffer 2.0 μL、0.2 mmol/μL引物各0.4 μL、Taq酶0.2μL、Mg2+1.2 μL、dNTPs 0.4 μL和cDNA模板2 μL,其余用无菌三蒸水补足。扩增条件为:94 ℃ 5 min;94 ℃ 1 min、62 ℃ 45 s、72 ℃ 1 min,35 个循环;72 ℃ 10 min。 取4 μL 扩增产物进行琼脂糖凝胶电泳,GoldView染色,继用SQ9636 型扫描系统扫描。HPIAS-1000 型图像分析系统检测各组目的基因及内参照的积分吸光度(A) 值,并以两者比值作为各组mRNA的相对表达量。
2.3细胞酶联免疫吸附实验 以每孔1×105个的细胞密度将HUVECs接种于96孔板,以无血清DMEM/F12培养基培养12 h后,按2.1所述分组加药(每组8孔),作用24 h。弃去培养液,其中每组取3孔细胞用1mol/L NaOH裂解,用Lowry法进行蛋白定量,其余5孔用4%多聚甲醛固定,正常血清封闭,加羊抗人ICAM-1多克隆抗体(1∶400),4 ℃孵育48 h,用兔抗羊SP试剂盒检测ICAM-1蛋白表达。用酶标仪在490 nm下检测各孔细胞的A值。用各孔A值/各孔细胞蛋白总含量的比值表示各孔细胞ICAM-1蛋白的相对表达量。
2.4动物模型的制备 25只正常成年雄性新西兰大耳白兔,体重2.0~2.5 kg。随机分为5组,每组5只,分笼喂养,各组分别给予以下饮食喂养10周:(1)正常对照(control)组:正常饲料; (2)高脂(high lipid)组:高脂饲料(含1%胆固醇和3%猪油的饲料); (3)高脂+DHEA组:加入DHEA (0.125 g·kg-1·d-1)的高脂饲料; (4)高脂+DHEA+ATRA组:加入DHEA(0.125 g·kg-1·d-1)和全反式维甲酸(0.6 mg·kg-1·d-1)的高脂饲料; (5)DHEA组:加入DHEA(0.125 g·kg-1·d-1)的正常饲料。
各组大耳白兔喂养10周后禁食12 h,用3%戊巴比妥钠(1.3 mL/kg)耳缘静脉麻醉。固定后,迅速打开胸腔心脏采血。之后分离由主动脉弓至肾动脉分支的主动脉,将外膜结缔组织及脂肪组织剥离干净,沿分支最多处剪开,肉眼观察,见主动脉弓处斑块最明显。从主动脉弓处取一小块血管,放入-80 ℃冰箱,留做RT-PCR之用。将剩下的血管放入4%多聚甲醛中固定。
2.5血脂的生化检测 将所采血液分离血清,用全自动生化分析仪检测血清中总胆固醇(total cholesterol,TC)、总甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的含量。
2.6免疫组织化学实验 将固定好的主动脉石蜡包埋、切片,免疫组织化学SP法染色,染色步骤严格按试剂盒说明书操作。采用HPIAS-1000高清晰度图像处理系统,分析各组切片的免疫组织化学结果,用细胞胞浆内和胞膜上棕黄色阳性颗粒的平均A值表示其ICAM-1的蛋白表达量。
2.7RT-PCR反应 用Trizol一步法提取各组主动脉的总RNA,每组取4 μg总RNA逆转录成为cDNA。取1 μL cDNA产物进行RT-PCR反应。ICAM-1的上游引物序列为5’-GAGCTGTTTGAGAACACCTC-3’,下游引物序列为5’-TCACACTTCACTGTCACCTC-3’,扩增产物长407 bp;内参照GAPDH的上游引物序列为5’-GCGCCTGGTCACCAGGGCTGCTT-3’,下游引物序列为5’-TGCCGAAGTGGTCGTGGATGACCT-3’,扩增产物长465 bp。PCR反应体系除cDNA模板为1 μL外,其余同2.2。扩增条件为:95 ℃ 5 min;95 ℃ 1 min、63 ℃ 1 min、72 ℃ 1 min,30个循环;72 ℃ 10 min。琼脂糖凝胶电泳和半定量分析同2.2。
3 统计学处理
实验数据使用SPSS 13.0软件处理,主要统计指标进行正态性检验,正态分布的各个统计指标均以均数±标准差(mean±SD)表示。多组间统计学差异显著性采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 细胞实验
RT-PCR及ELISA结果显示,ox-LDL组ICAM-1的mRNA和蛋白表达明显高于正常对照组(P<0.05);ox-LDL+DHEA组ICAM-1的mRNA和蛋白表达与ox-LDL组相比明显降低(P<0.05);ox-LDL+DHEA+ATRA组与ox-LDL+DHEA组ICAM-1 mRNA和蛋白表达无统计学差异(P>0.05);DHEA组与正常对照组ICAM-1 mRNA和蛋白表达无统计学差异(P>0.05),见图1、表1。
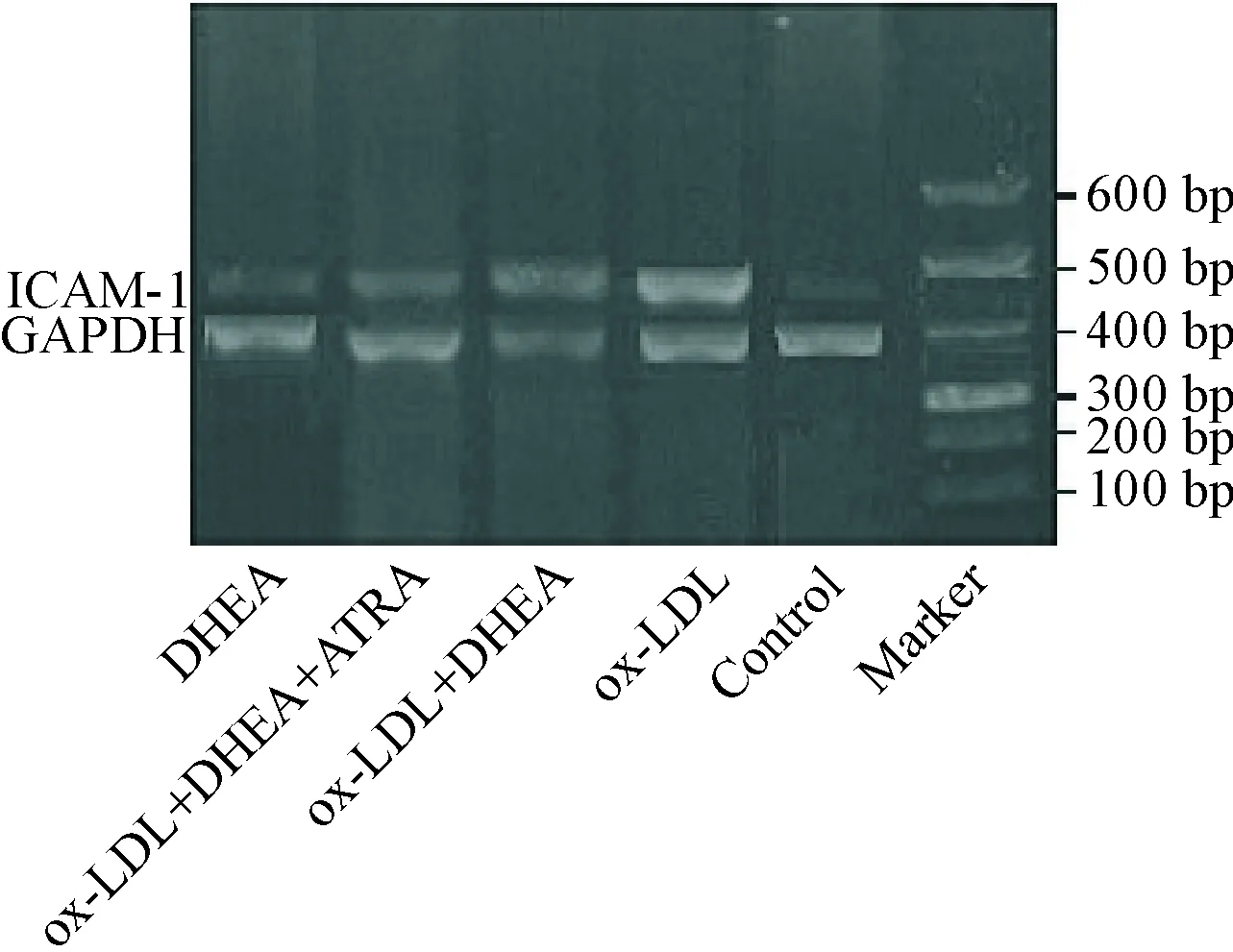
Figure 1. ICAM-1 mRNA in HUVECs of all groups detected by RT-PCR.
图1各组HUVECsICAM-1的mRNA表达情况
表1各组HUVECsICAM-1mRNA和蛋白的表达
Table 1. The expression of ICAM-1 at mRNA and protein levels in HUVECs of all groups (Mean±SD.n=5)
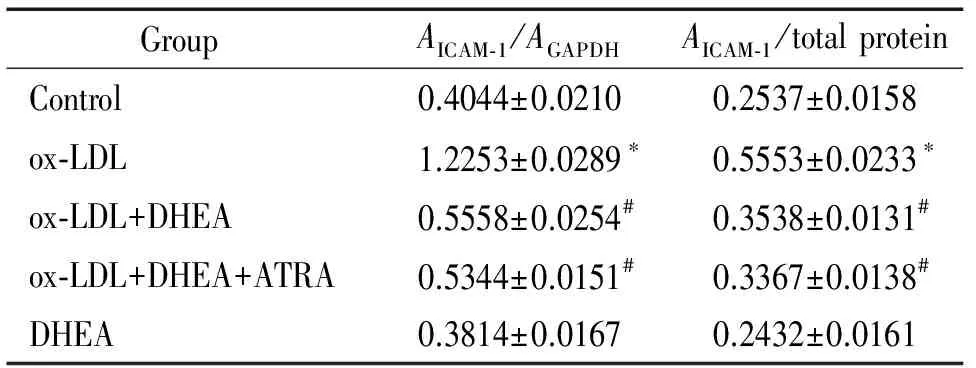
GroupAICAM⁃1/AGAPDHAICAM⁃1/totalproteinControl0.4044±0.02100.2537±0.0158ox⁃LDL1.2253±0.0289∗0.5553±0.0233∗ox⁃LDL+DHEA0.5558±0.0254#0.3538±0.0131#ox⁃LDL+DHEA+ATRA0.5344±0.0151#0.3367±0.0138#DHEA0.3814±0.01670.2432±0.0161
*P<0.05vscontrol group;#P<0.05vsox-LDL group.
2 动物实验
2.1血脂的生化检测 各组TC、 TG、HDL-C和LDL-C的含量见表2,其中TC和LDL-C的含量高脂组高于正常对照组(P<0.05);高脂+DHEA组与高脂组的差异无统计学显著性(P>0.05);高脂+DHEA+ATRA组低于高脂组(P<0.05);高脂+DHEA+ATRA组低于高脂+DHEA组(P<0.05);DHEA组与正常对照组的差异无统计学显著性(P>0.05)。而TG和HDL-C的含量各组间的差异无统计学显著性(P>0.05)。

表2 各组新西兰大耳白兔血脂水平
*P<0.05vscontrol group;#P<0.05vshigh lipid group;△P<0.05vshigh lipid+DHEA group.
2.2兔主动脉ICAM-1蛋白的表达 免疫组化结果示,阳性信号为细胞胞浆内和胞膜上棕黄色颗粒。与正常对照组相比,高脂组的ICAM-1蛋白表达明显增强(P<0.05),表现为棕黄色颗粒明显增多,颜色明显加深;同高脂组比较,高脂+DHEA组ICAM-1蛋白表达受到抑制(P<0.05),表现为颗粒减少、颜色变浅;高脂+DHEA+ATRA组与高脂+DHEA组相比ICAM-1蛋白量的差异无统计学显著性(P>0.05);DHEA组与正常对照组相比ICAM-1蛋白量的差异也无统计学显著性(P>0.05),见图2、表3。

Figure 2. The protein expression of ICAM-1 in aorta of all groups detected by immunohistochemistry (×200). A: control group; B: high lipid group: C: high lipid+DHEA group; D: high lipid+DHEA+ATRA group; E: DHEA group.
图2免疫组织化学法检测各组主动脉ICAM-1蛋白的表达情况
2.3兔主动脉ICAM-1 mRNA表达 RT-PCR结果示,高脂组ICAM-1的mRNA表达明显高于正常对照组(P<0.05);高脂+DHEA组ICAM-1的mRNA表达与高脂组比较显著降低(P<0.05);高脂+DHEA+ATRA组与高脂+DHEA组ICAM-1 mRNA表达的差异无统计学显著性(P>0.05);DHEA组与正常对照组ICAM-1 mRNA表达的差异无统计学显著性(P>0.05),见图3、表3。
讨 论
动脉粥样硬化是以动脉内脂质沉积,粥样斑块形成及伴随的炎症反应为病理特征的一种常见病、多发病。AS的发生是多因素综合作用的结果,涉及损伤的内皮细胞与单核巨噬细胞、平滑肌细胞之间的相互作用,以及局部产生的大量细胞因子、生长因子的网络调控。高脂血症是AS发生的独立危险因子;ox-LDL对血液单核细胞具有趋化作用,并与单核巨噬细胞相互作用使其形成泡沫细胞,在AS的病变形成中起重要作用。ICAM-1是AS发生发展进程中的主要因子,在介导单核细胞和内皮细胞黏附过程中起着重要作用,单核细胞只有在ICAM-1等作用下才能牢固的黏附在内皮细胞上[4]。ICAM-1 在正常血管内皮细胞上呈低水平表达,而在AS病变的内皮细胞、平滑肌细胞、巨噬细胞上表达增加,其中脂纹和斑块上表达量最大[5],因此ICAM-1的过表达被认为是斑块早期形成的标志和斑块进展的潜在机制。
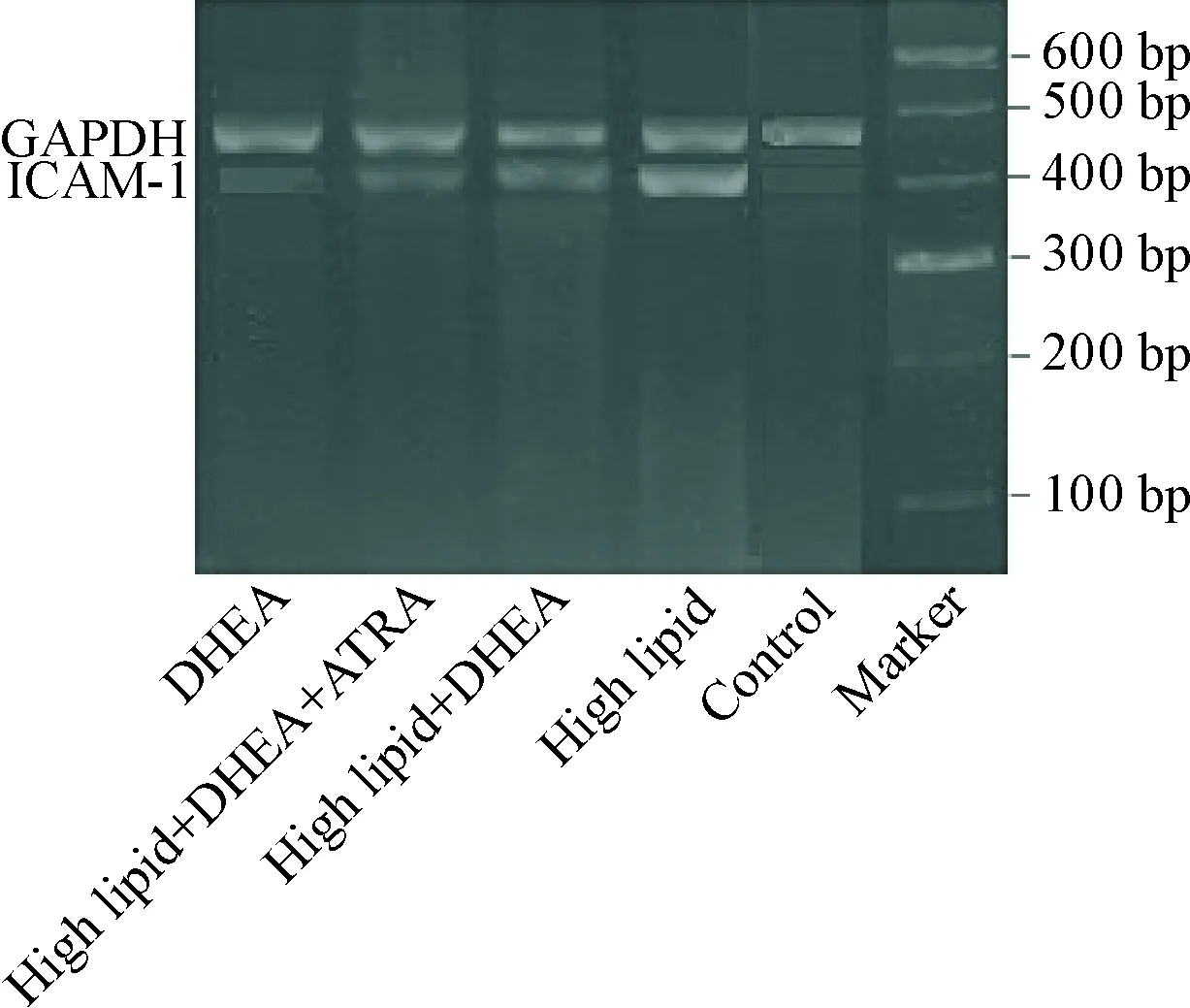
Figure 3. ICAM-1 mRNA in aorta of all groups detected by RT-PCR.
图3各组主动脉ICAM-1的mRNA表达情况
表3各组兔主动脉ICAM-1的mRNA和蛋白的表达
Table 3. The expression of ICAM-1 at mRNA and protein levels in the aorta of all groups (Mean±SD.n=5)
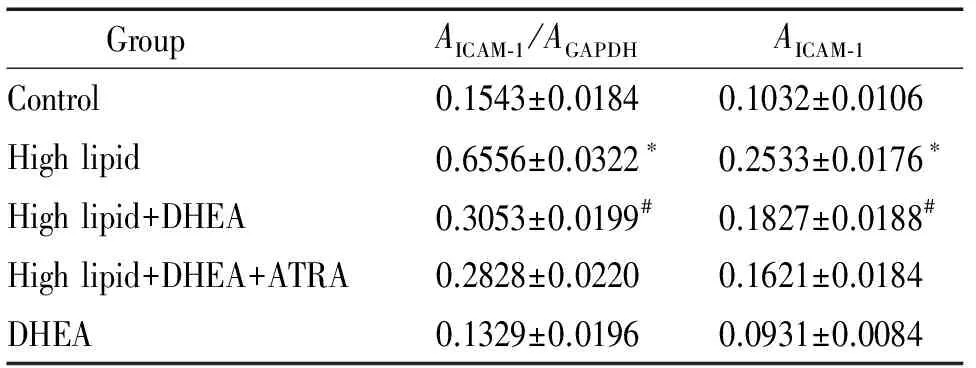
GroupAICAM⁃1/AGAPDHAICAM⁃1Control0.1543±0.01840.1032±0.0106Highlipid0.6556±0.0322∗0.2533±0.0176∗Highlipid+DHEA0.3053±0.0199#0.1827±0.0188#Highlipid+DHEA+ATRA0.2828±0.02200.1621±0.0184DHEA0.1329±0.01960.0931±0.0084
*P<0.05vscontrol group;#P<0.05vshigh lipid group.
DHEA是主要由肾上腺皮质细胞合成的一种弱雄激素,是血清中含量最多的一类类固醇激素[6],其在血浆中的浓度在青春期达高峰,而后随年龄的增加而迅速递减,因此它被称为“青春激素”[7-8]。基于DHEA水平随年龄的增加而递减的特点,人们开始关注DHEA与老年性疾病AS的关系。流行病学调查表明,血浆DHEA水平与AS发病率呈显著的负相关[9]。Bednarek等[10]的研究结果表明,DHEA可以减少高胆固醇喂饲兔的动脉壁脂纹面积,且这种作用并不依赖于血脂水平的改变。
本实验从体外、体内2个水平进行研究。体外细胞实验以ox-LDL作为刺激因素造成体外AS模型。结果显示,ox-LDL+DHEA组ICAM-1 mRNA和蛋白的表达与ox-LDL组相比均明显降低,而DHEA组与正常对照组ICAM-1 mRNA和蛋白的表达无统计学差异,提示DHEA能特异性地抑制ox-LDL诱导的HUVECs的 ICAM-1表达。动物实验中,高脂组兔血脂(TC和LDL-C)水平显著升高,动脉内膜有明显脂纹形成,证明AS模型构建成功。高脂+DHEA组与高脂组相比血脂水平无显著差异,DHEA组与正常对照组相比血脂水平也无显著差异,说明DHEA对血脂水平的影响不大,DHEA的抗AS作用不依赖于血脂水平的改变。高脂+DHEA组ICAM-1的mRNA和蛋白表达与高脂组比较显著降低,单DHEA组与正常对照组ICAM-1的mRNA和蛋白表达的差异无统计学显著性,提示DHEA能特异性地抑制高脂诱导的兔主动脉ICAM-1的表达,且DHEA的这种作用不依赖于血脂水平的改变。这与细胞实验结果相一致,由此我们认为,DHEA通过抑制高脂诱导的ICAM-1的表达而发挥抗AS作用。
DHEA在体内主要是在细胞内细胞色素P450芳香酶的作用下降解成雌酮而发挥作用[11-12]。增加细胞内细胞色素P450芳香酶的活性,应该可以特异性地加强DHEA在血管局部发挥的抗AS作用。研究表明[13],细胞色素P450芳香酶具有多个启动子,在血管内皮细胞中主要由启动子Ⅰ.6发挥作用,维甲酸受体被激活后可通过Ⅰ.6启动子增强细胞色素P450芳香酶的表达。由此推想,补充全反式维甲酸就可以增强参与AS的细胞内雌激素水平,从而特异性的增强DHEA的抗AS作用。然而本研究细胞实验显示,ox-LDL+DHEA+ATRA组与ox-LDL+DHEA组ICAM-1 mRNA和蛋白的表达无统计学差异;动物实验显示,高脂+DHEA+ATRA组与高脂+DHEA组ICAM-1 mRNA和蛋白的表达也无统计学差异。以上结果均提示,全反式维甲酸对DHEA的上述作用(DHEA抑制高脂诱导的ICAM-1的表达)并无明显增强作用。推测DHEA的上述作用可能不是通过转化为雌酮而发挥的,可能是通过直接与涉及ERK1信号通路的特异性受体相结合而引发的[14]。这与Simoncini等[15]的报道一致,但其具体分子机制有待进一步深入研究。
[参考文献]
[1] 王海芳, 赵向绒, 霍雪萍, 等. Semaphorin 3A过表达对H2O2诱导的人脐静脉内皮细胞损伤的影响[J]. 中国病理生理杂志, 2017, 33(6):1080-1085.
[2] Naessen T, Sjogren U, Bergquist J, et al. Endogenous steroids measured by high-specificity liquid chromatography-tandem mass spectrometry and prevalent cardiovascular disease in 70-year-old men and women[J]. J Clin Endocrinol Metab, 2010, 95(4):1889-1897.
[3] 冯 辉, 吴 标, 赵习德, 等. 生长抑素联合大柴胡汤对重症急性胰腺炎大鼠的作用[J]. 中国病理生理杂志, 2016, 32(7):1297-1301.
[4] 刘建兰, 张东红, 朱 毅. 同型半胱氨酸对人脐静脉内皮细胞自噬的影响及其意义[J]. 中国病理生理杂志, 2012, 28(11):2034-2035.
[5] 王诗才, 陈太军, 黄美松, 等. 脑源性神经营养因子保护H2O2诱导的氧化损伤血管内皮细胞[J]. 中国病理生理杂志, 2015, 31(8):1384-1394.
[6] Chevalier M, Gilbert G, Lory P, et al. Dehydroepiandrosterone (DHEA) inhibits voltage-gated T-type calcium channels[J]. Biochem Pharmacol, 2012, 83(11):1530-1539.
[7] Wang L, Hao Q, Wang YD, et al. Protective effects of dehydroepiandrosterone on atherosclerosis in ovariectomized rabbits via alleviating inflammatory injury in endothelial cells[J]. Atherosclerosis, 2011, 214(1):47-57.
[8] Marder W, Somers EC, Kaplan MJ, et al. Effects of prasterone (dehydroepiandrosterone) on markers of cardiovascular risk and bone turnover in premenopausal women with systemic lupus erythematosus: a pilot study[J]. Lupus, 2010, 19(10):1229-1236.
[9] 吴 强, 林 静, 彭 俊, 等. 内皮源性硫化氢在雌激素抗动脉粥样硬化中的作用及机制[J]. 中国病理生理杂志, 2013, 29(8):1375-1379.
[10] Bednarek-Tupikowska G, Gosk I, Szuba A, et al. Influence of dehydroepiandrosterone on platelet aggregation, superoxide dismutase activity and serum lipid peroxide concentrations in rabbits with induced hypercholesterolemia[J]. Med Sci Monit, 2000, 6(1):40-45.
[11] Labrie F, Luu-The V, Labrie C, et al. DHEA and its transformation into androgens and estrogens in peripheral target tissues: intracrinology[J]. Front Neuendocrinol, 2013, 22(3):185-212.
[12] Nawata H, Yanase T, Goto K, et al. Mechanism of action of anti-anging DHEA-S and the replacement of DHEA-S[J]. Mech Ageing Dev, 2014, 123(8):1101-1106.
[13] Bouraima H, Hanoux V, Mittre H. Expression of the rabbit cytochrome P450 aromatase encoding gene uses alternative tissue-specific promoters[J]. Eur J Biochem, 2001, 268(16):4506-4512.
[14] Williams MR, Ling S, Dawood T, et al. Dehydroepiandrosterone inhibites human vascular smooth muscle cell proliferation independent of ARs and ERs[J]. J Clin Endocrinol Metab, 2012, 87(1):176-181.
[15] Simoncini T, Mannella P, Forneri L, et al. Dehydroepiandrosterone modulates endothelial nitric oxide synthesis via direct genomic and nongenomic mechanisms[J]. Endocrinology, 2003, 144(3):449-455.

