基于细胞培养的新型微流体加热器的开发与应用
张艳秋, 陶文铨, 李 卓
(同济大学 环境科学与工程学院,上海 200092)
随着微流体技术的快速发展,越来越多的研究人员采用微流体技术进行生物、化学分析等方面的研究[1-3],并采用微阀门等新型技术,实现对流体流动过程的精确控制.已有大量研究采用PDMS制作微流体细胞培养系统[4-5],通过对流动系统的简单控制完成对传输过程中二氧化碳含量、剪切应力等条件的控制.但基于微流体芯片技术的生物和化学等方面的研究(如细胞培养、基因工程中的聚酶链反应等),不仅需要准确控制流体的成分比,还需要精确的控制温度.传统的细胞培养箱需要将温度控制在37 ℃,CO2浓度控制在5%并保证培养环境维持合适的pH.在对细胞进行生长情况监控时,需要将培养皿从传统恒温箱中取出.显然,用于培养细胞的传统恒温箱不适合与微流体芯片结合,无法对实验进行实时监测.比较简单、直接的方法是将微流体系统直接放置在设定为37℃的加热板上,进行哺乳类细胞的研究[5],但该方法没有实现整个实验系统的集成化.科研人员[6-7]将铟-锡氧化物加热片置于微流体系统中,实现了流动系统与温度控制系统的结合,但没能有效实现温度的局部控制.因此,如何实现微流控细胞培养技术中温度的准确控制测量成为许多应用研究中的技术难题.
本文设计开发一种用于细胞培养的新型微流体加热器.采用PDMS制作微流体通道以实现对细胞和培养液输入输出的有效控制,并与Au/Cr微加热系统集成.采用Rhodamine B和热致变色液晶(thermochromic liquid crystal,TLC)方法校核该微型加热器的温度,并根据校核温度将温度控制在适合哺乳类细胞生存的温度(37 ℃),计算该温度下所需工作功率.向该系统的微流体通道的不同单元接种不同密度的Hela细胞,连续培养3 d以上,实时监控细胞生长情况,以验证该装置工作性能.
1 装置设计加工
所设计的微流体加热器由微流体系统及微加热系统两部分组成,因此需要分别对两个系统进行设计加工,然后进行集成.
1.1 微流体系统的设计加工
PDMS具有价格低、光学透明度高、低毒性及生物相溶性好、透氧系数高、成型快等优点[8-9],是加工微流体系统的常用材料.选用PDMS材料制作微流体器件气阀(V1-V9),工作原理如文献[8]所述.采用多层软光刻技术制作细胞培养系统,该系统每个微室单元的样品量可以控制在纳升级别,系统采用6个双层气阀(V1—V6)构建9个(C1—C9)用于细胞培养的微室单元,使得各单元独立工作,如图1a所示.各腔室包括一个3层系统,包括培养细胞的中间层及被气阀分隔开的气体进出的两层,如图1b.气阀V7—V9控制不同样品的输入,V1—V3和V4—V6分别控制9个腔室(C1—C9)的工作.例如,在V7—V9进口阀门开启情况下,只打开阀门V1和V6,即可对腔室C1进行独立操作(如细胞灌注或排出),其他腔室不受影响;若关闭V1,只打开V2和V6,即可对腔室C2进行独立操作,其他腔室不受影响,依次类推.当腔室控制阀门处于闭合状态时,灌注样品通过腔室上侧的狭窄通道排出.通过自编Matlab程序控制6个气体阀门的开关状态,所用气体压力控制在50 kPa.流体通道的宽度为450 μm,平均高度为35 μm,因此宽高比为12.8,可以认为该流体通道是二维系统.

a PDMS系统结构图
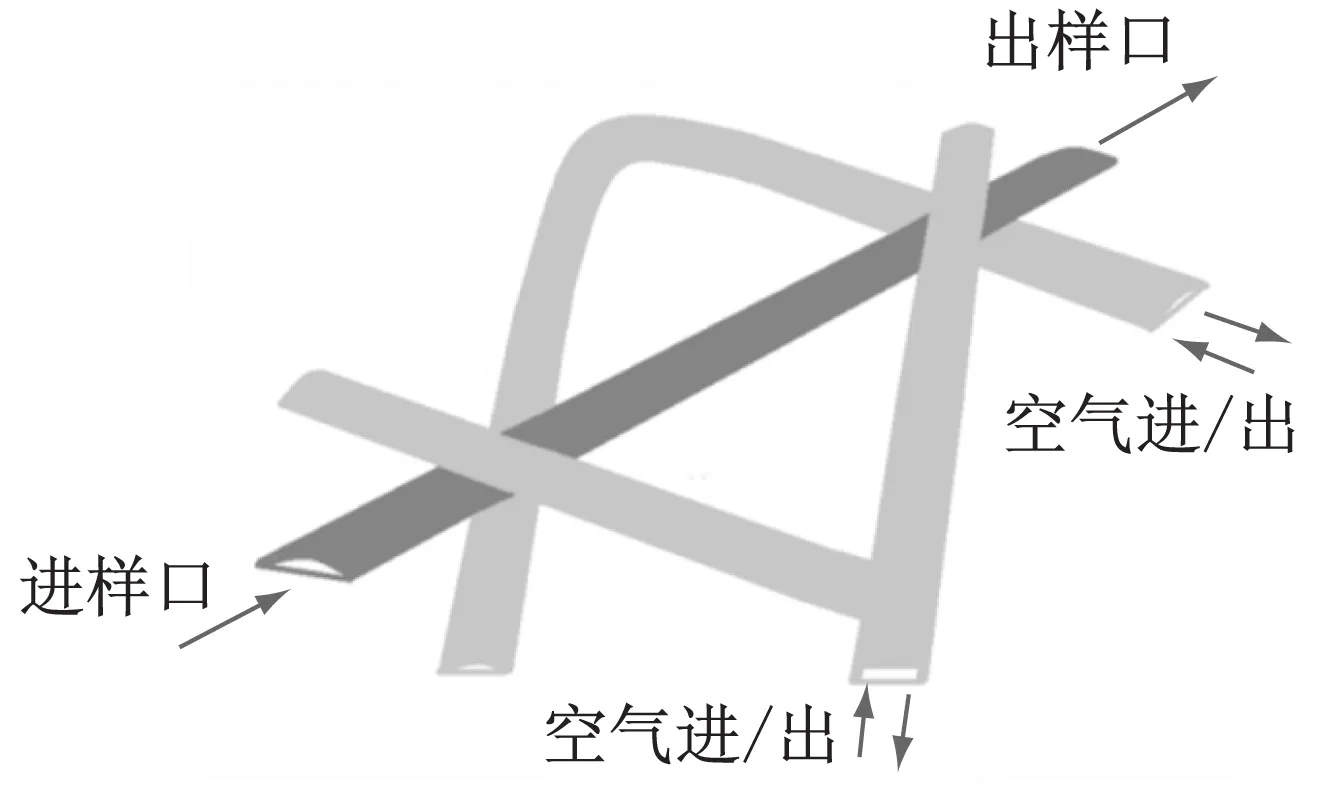
b 腔室3层灌注培养系统的三维图图1 PDMS灌注系统图Fig.1 Diagram of the PDMS perfusion system
根据剪切应力计算公式τ=6μQ/(h2w)[4],本文流体通道的w=450 μm,h=35 μm,Q=0.3 ml·h-1,μ=1.01×10-3Pa·s,因此系统中的剪切应力为1 cm23.93达因,与Hela细胞培养的理想剪切应力1 cm24达因相一致[10].式中μ是流体粘度,单位为kg·m-1·s-1;Q是流量,单位为m3s-1;w和h分别为通道的宽度和高度,单位为m.
将蓝色与红色流体注入到微流体系统中以验证该系统的每个单元的独立工作性能.如图2所示,通过气阀的控制,蓝色与红色液体可以独立地锁定在各腔室中,无混合现象,表明系统各腔室具有较好的独立工作性能,且无液体溢出腔室.由此可见,每个单元中,可根据实际需求控制细胞接种的密度.

图2 向各通路注入染料后,各腔室工作情况图
Fig.2Validationofeachchamberworkingindependently,identifiedbyinfusingdyedwater
1.2 微加热平台的设计加工
采用软光刻技术对镀有金-铬 (Au-Cr)的玻璃片(厚度1 mm)进行微加工,其中金为30 nm,铬为50 nm,得到如图3所示的微型加热器芯片.由于铬的电阻率(ρCr=125 nΩ·m)远大于金的电阻率(ρAu=22.14 nΩ·m),因此在采用直流电加热过程中,铬用来产生焦耳热,从而控制加热面所需的温度,金则对并联的9个加热单位起到导电连接作用,其产生的焦耳热可以忽略不计.为使每个单元的热量均匀分布,基于数值模拟技术以优化加热单元的几何结构,如图3中的放大部分.加热芯片中的9个温度控制单元的位置(图3)要与微流体腔室的位置相匹配(图1).
微加工具体步骤简要介绍如下:首先采用正性光刻胶S1813对镀金-烙玻璃片进行涂层,厚度为2 μm,经过加热、紫外光(UV)曝光,将所需要的几何结构影印到玻璃片上,然后采用显影剂MF319进行显影,最后应用蚀刻溶液对金层进行蚀刻,采用丙酮对蚀刻后的金-烙玻璃片进行清洗,除去剩余的正性光刻胶,以获得如图3所示的灰色部分结构;第二步用正性光刻胶S1813重复第一步的工作,唯一不同的是此时要采用蚀刻溶液对铬层进行蚀刻,得到如图3中的深灰色部分.

图3微型加热片Au-Cr示意图:共有9个独立工作的供热单元,每个单元的面积为600×600μm2
Fig.3Thenetworkofmicroheatersfabricatedonachromiumandgoldwafer,andazoomedheatingunitisinserted.
1.3 微流体加热装置的集成
在Au-Cr微加热平台外涂一薄层(20 μm)的紫外固化光学胶NOA81,将蚀刻的Au-Cr微加热平台与微流体装置黏合到一起,并在紫外光下照射5 s,使NOA81固化,集成装置的截面视图和各部分的几何参数(每一层的厚度)见图4.基于热沉技术,采用铝制平台作为加热系统的散热器.为减小加热片与热沉平台间的热阻,采用高导热剂将微流体系统与微加热平台黏结起来得到集成的微流体加热装置,如图5所示.

图4 加热系统的横剖面图,以其中一个加热单元为例Fig.4 The boundary conditions of the integrated system
2 工作功率测定
所开发微流体加热器的最终目的是为哺乳类细胞生存提供稳定的环境温度(37 ℃),因此需要确定每个腔体单元为37 ℃时所需的供电功率.首先进行微加热器系统温度标定,常用的微流体器件的温度场标定方法有Rhodamine B荧光染料法[11]及热致变色液晶(TLC)法[12].

图5实验过程中的微型加热器系统,其中热沉部位采用高导热系数的铝制平台
Fig.5Photographoftheexperimentaldevice,includingthealuminiumplatformasaheatsinker
2.1 采用Rhodamine B进行温度标定及功率计算
首先,在碳酸盐溶液中进行Rhodamine B溶液的配备,浓度为0.1 mM.为避免外界光对溶液的漂白影响,将配置好的溶液放在暗处存放.实验过程中所用的荧光采集系统包括水银灯、荧光显微镜(目镜(20×))以及高分辨率照相机(EM-CCD,C9100-13).对于每个实验测试点,连续采集30帧,采集频率为32 f·min-1,空间分辨率为512像素×512像素.
为了准确地找出荧光强度随温度变化的函数关系,实验分两步进行.①采用高导热剂将集成的微流体加热装置与珀尔帖热循环仪的加热平台表面粘合.珀尔帖热循环仪能够快速、准确地实现对温度的控制,通常用在生物学研究中的聚酶链反应实验中.在实验中,测试所用的温度范围从25 ℃开始,每次测试升温5 ℃,直至60 ℃.实验过程中采用注射器将Rhodamine B溶液注入到通道中.为防止光学漂白的影响,每个温度点进行数据采集后,对通道内的溶液进行更新.②采用直流电源对如图5所示的加热器系统进行加热.对于电阻(Rt)为常数的加热片,通过调节直流电压(U)以获得不同的供热功率(Pt=U2/Rt),下标t表示加热片的所有供热单元,共9个.通过多次重复测量,整个系统的温度测量偏差在±0.2 ℃,具有较好的准确性.
应用软件ImageJ对采集的荧光强度图像进行数据分析,确定量纲为1的荧光强度Δn(Δn=(n-n0)/n0,n0为背景荧光度)与温度(T)的函数关系式,即T(Δn).对于每个加热单元在不同功率(Ps=U2/Rs)下的荧光强度,表示为Ps(Δn),其中下标s表示一个供热单元.通过求解关联式T(Δn)和Ps(Δn),得到温度与功率的函数关系式T(Ps),即T(Ps)=5.1×10-6Ps3-2.0×10-4×Ps2+0.23Ps+23.63,见图6.在实际应用中,根据此函数式,通过调节电源电压从而改变供电功率,就可以得到实验中所需的温度值,而且所需功率低至毫瓦 (mW) 级.一个加热片共有9个并联的电阻,所用加热片的总电阻为Rtotal=37 Ω,即每个加热单元的电阻为Rsingle=333 Ω.当T=37 ℃时,每个单元所需的功率Ps=57 mW,则整个加热片所需的供电总功率为Pt=9Ps=513 mW.如图7所示,9个腔室的加热区域荧光强度最高,荧光强度随温度降低而逐步减弱,结果表明加热系统中9个加热单元具有独立工作的特性,从而实现了在微型加热器上进行局部控制温度的目标.

图6 温度与功率变化的函数关系Fig.6 Correlativity of the change of temperature and power

图7 加热器中温度分布的全局图Fig.7 Temperature distribution in microheater
2.2 采用热致变色液晶进行温度校核
采用TLC(SLN40/R20C20W)对加热器的供热功能进行温度校核.该材料的工作范围(显色范围)为20~40 ℃,超出该范围显示为无色(注:背景为黑色时显示为黑色).在温度达到19.2 ℃时出现可视光,当温度达到19.9 ℃时,开始显现红色;温度升到23.2 ℃,绿色开始显现;温度达到36.0 ℃时,开始显现蓝色.该材料的工作范围符合本实验中温度校核要求.
由于产品本身已经给出具体的色彩转换的转捩点,因此不需要采用珀尔帖热循环仪进行材料性能的校核.将要测试的加热片背面在不影响热量传递的前提下处理成黑色背景,然后将该TLC材料混合后均匀地涂在加热片的加热面上,同时要避免该材料暴露在紫外光或高温环境下.实验中采用LED白色光源和高精度彩色照相机(PL-B625, CMOS)以频率为7 f·s-1、空间分辨率为2592 像素×1944 像素进行数据采集,每个测量点连续采集30帧.通过调节直流电源,获得不同供电功率下的R、G和B值.
同样采用图像分析软件ImageJ对采集的色图进行分析以获得R、G和B值.当采用直流电源对加热器供热时,所得到的色彩值R、G和B随着电压值 (0.0 V≤U≤5.0 V)的变化结果见图8.在室温为24 ℃,U=0时,TLC呈现绿色,符合给定的材料性能;随着电压的增加,绿色值G逐渐降低,当电压达到U=2.8 V时,蓝色B值开始大于其他两种颜色值,此时TLC呈现蓝色,即加热单元的表面温度达到36 ℃.当电压继续增大到U=4.5 V时,TLC开始进入无色区域,即此时表面温度已经到达40 ℃.

图8采用加热器系统(0≤U≤5.0V)得到的TLC(SLN40/R20C20W)色彩值随温度变化结果
Fig.8Temperaturecalibrationofcrystalslurry(SLN40/R20C20W)coatedonthemicroheaterwaferwithaDCpowersupplyrangingwithin0~5.0V
本文实验目的是找到T=37 ℃时所需的供电功率,通过对在2.8 V≤U≤4.5 V范围内的实验数据进行拟合,找出T=37 ℃时相应的电压值U=2.9 V.加热片中每个加热单元的电阻Rsingle=333 Ω,对应的功率P=25.3 mW.因此整个加热片所需要的总功率为Ptotal=U2/Rtotal=212.4 mW.
可以看出,对于相同的加热单元,采用Rhodamine B和TLC测量得出的所需电功率结果存在差异.Rhodamine B的结果显示在温度达到37 ℃时,一个加热单元所需的电功率为57 mW,而TLC的标定结果为25.3 mW.分析认为由于采用PDMS制作微流体通道,该材料的多孔性会产生渗透压,使得Rhodamine B溶液不断被吸入壁面中,造成荧光物质的不断累积从而造成实验结果的偏差.因此,通过两种实验方法的比较,采用TLC的实验结果作为细胞研究实验参照依据.
3 基于细胞培养的性能测试
以Hela细胞作为培养对象,测试所研发的微加热系统的可靠性.
3.1 细胞灌注培养
实验操作步骤如下:
(1)PDMS系统的预饱和处理:高温环境下的水蒸汽或清洗过程中携入的乙醇会影响PDMS的清晰度及渗透性等性能,对细胞培养造成不利影响[13],因此需要对系统进行预饱和处理.使用Fluigent MFCS泵连续向PDMS中泵入去离子水,将流体通道内的空气赶出,并在实验前使PDMS系统达到饱和状态.实验中选用内径为127 μm的PEEK1535管进行灌注.
(2)消毒:对每一个培养基底进行消毒,首先在紫外光下进行30 s表面等离子处理,然后分别使用70%的乙醇及去离子水进行30 min以上的清洗处理.
(3)纤连蛋白涂层:在系统中注入纤连蛋白(以磷酸盐缓冲液(PBS)配制,浓度为50 μg·mL-1),以促进细胞附着.然后将所有阀门关闭,注入PBS溶液对9个腔室外的纤连蛋白进行清洗.将装置在室温下放置1 h,然后将所有阀门打开,并使用PBS对系统进行冲洗.
(4)细胞准备:准备2 mL平均浓度为每mL 2×106个细胞的细胞悬液,同时准备一定量含约15 mL HEPES(简称MCH)的培养基,并以小于0.3 mL·h-1的流量连续4 d进行灌注.用MCH进行系统冲洗,并保证系统内无气泡产生.
(5)细胞接种:采用注射器注射法,在低流速下进行细胞接种,达到目标接种密度后,关闭阀门.接种完成后,对通路或旁路内多余细胞进行快速清洗,保证细胞只接种在9个腔室内.在37 ℃条件下,细胞经过6 h沉降及伸展后,打开所有阀门,使用Fluigent MFCS泵以0.3 mL·h-1的流速用CO2独立装置进行连续灌注.由于PDMS具有气体渗透性,因此由空气扩散入腔室内的氧气对细胞培养是足够的,无需额外补充操作.
(6)细胞生长监控:对细胞进行连续3 d培养,注入台盼蓝溶液进行细胞标定,并利用相差显微镜进行细胞生长监控.
3.2 细胞培养结果
在装置两个腔室内,接种不同密度的Hela细胞,利用相差显微镜详细给出微流体通道内细胞培养结果(图9).如果细胞是圆形可以判断已经死亡,如果细胞以各种形状呈分散状态,表明细胞存活.图9a分别为将细胞悬液通入腔室C1、C6(如图1a标注)后的照片,细胞呈悬浮未贴壁状态;图9b是在微流体加热系统中培养24 h后的细胞照片,可以看出细胞数量没有太大变化,但绝大部分细胞已经贴壁并铺展开来;图9c是培养48 h后细胞照片,可以看出细胞数量有明显增加,分布均匀并以各种形状呈分散状态;培养72 h后的细胞照片(图9d)可以看出细胞继续在通道内生长,并以各种形态挤满了整个腔室.

a 接种后

b t=24 h

c t=48 h
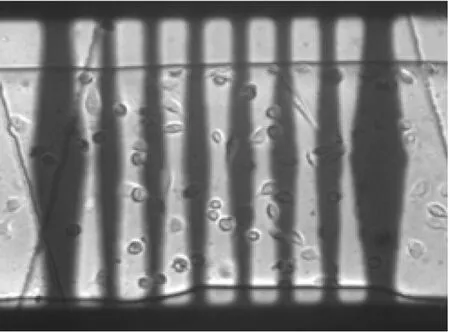
d t=72 h图9 不同时间内,腔室C1和C6中细胞生长状况Fig.9 Cells growth in chambers C1 and C6 withdifferent seeding densities in 72 h
选择腔室C6注入台盼蓝溶液进行死亡细胞标定,并采用ImageJ软件对细胞数目进行统计,细胞生长曲线见图10,可以看出24 h内细胞数量无明显增加,这是由于细胞需要时间进行贴壁铺展及生长.在24~72 h内,细胞数目不断增多.细胞生长实时监控结果可以看出所培养细胞生长良好,在生长特征及形态方面与在传统血管组织培养中的细胞无明显区别,表明该微加热系统具有可以为细胞培养提供稳定的温度环境的良好工作性能.

图10 腔室C6内连续培养3 d细胞生长曲线
Fig.10EvolutioncurveofcellgrowthinchambersC6from3dexperiment
4 结论
针对在实时监控细胞生长过程中较难维持细胞生长所需温度等条件的问题,本文通过采用微加工技术,完成一种新型微流体加热器的设计和加工,由微流体输入输出系统及温度控制平台两部分集成.所设计加热系统与传统的恒温箱相比,具有体积微小、易于与流动芯片集成、易于实时观测等优点,且可以同时独立完成多个测试单元的实验工作.采用Rhodamine B和TLC材料对微流体加热器的温度进行标定及校核,并计算得到维持系统37 ℃时所需的工作功率为212.4 mW.为微加热系统提供稳定的工作功率,将Hela细胞接种入微流体加热系统,连续培养3 d,结果表明该系统所培养细胞在生长特征及形态方面与在传统血管组织培养中的细胞无明显区别,说明所设计微流体加热器可以为细胞培养提供稳定的温度环境,具有较好的实用性能.该微加热系统在生物及化学研究方面具有较大的应用潜力,
进一步的研究还在继续中.
参考文献:
[1] WHITESIDES G M. The origins and the future of microfluidics[J]. Nature, 2006, 442: 368.
[2] 郝丽, 徐春秀, 程和勇,等. 微流控芯片测定单细胞内化学组分的进展[J]. 化学进展, 2012, 24(8): 1544.
HAO Li, XU Chunxiu, CHENG Heyong,etal. Recent advances in the determination of intracellular contents in individual cells using microfluidic devices[J]. Progress in Chemistry, 2012, 24(8): 1544.
[3] 骆亦奇. 微流控芯片在表面等离子体共振生物传感器中的应用[J]. 大学化学, 2010, 25(1): 1.
LUO Yiqi. Application of microfluidic chips on surface plasmon resonance biosensors[J]. University Chemistry, 2010, 25(1): 1.
[4] KIM L, VAHEY M D, LEE H Y,etal. Microfluidic arrays for logarithmically perfused embryonic stem cell culture[J]. Lab on a Chip, 2006, 6(3): 394.
[5] TOH Y C, ZHANG C, ZHANG J,etal. A novel 3D mammalian cell perfusion-culture system in microfluidic channels[J]. Lab on a Chip, 2007, 7(3): 302.
[6] HUNG P J, LEE P J, SABOUNCHI P,etal. A novel high aspect ratio microfluidic design to provide a stable and uniform microenvironment for cell growth in a high throughput mammalian cell culture array[J]. Lab on a Chip, 2005, 5(1): 44.
[7] LIN J L, WANG S S, WU M H,etal. Development of an integrated microfluidic perfusion cell culture system for real-time microscopic observation of biological cells[J]. Sensors, 2011, 11(9): 8395.
[8] MELIN J, QUAKE S R. Microfluidic large-scale integration: the evolution of design rules for biological automation[J]. Annual Review of Biophysics Biomolecular Structure, 2007, 36: 213.
[9] UNGER M A, CHOU H P, THORSEN T,etal. Monolithic microfabricated valves and pumps by multilayer soft lithography[J]. Science, 2000, 288(5463): 113.
[10] HUNG P J, LEE P J, SABOUNCHI P,etal. Continuous perfusion microfluidic cell culture array for high-throughput cell-based assays[J]. Biotechnology and Bioengineering, 2005, 89(1): 1.
[11] SELVA B, MARY P, JULLIEN M C. Integration of a uniform and rapid heating source into microfluidic systems[J]. Microfluidics and Nanofluidics, 2010, 8(6): 755.
[12] HÖHMANN C, STEPHAN P. Microscale temperature measurement at an evaporating liquid meniscus[J]. Experimental Thermal and Fluid Science, 2002, 26(2): 157.
[13] HEO Y S, CABRERA L M, SONG J W,etal. Characterization and resolution of evaporation-mediated osmolality shifts that constrain microfluidic cell culture in poly (dimethylsiloxane) devices[J]. Analytical Chemistry, 2007, 79(3): 1126.

