EMS-ARTP复合诱变选育高产DHA裂殖壶菌
赵 犇
王 武1
李昌灵2
杨海麟1
(1.江南大学生物工程学院教育部工业微生物技术重点实验室,江苏 无锡 214122;2.怀化学院生物与食品工程学院,湖南 怀化 418000)
随着世界范围内能源和资源的日益紧张,可再生能源与资源的研究与开发已成为关注热点。近几年,各国纷纷开始在微藻生物燃料和营养化学品领域谋求突破与发展:美国能源部宣布将投资1 800万美元用于藻类生物燃料与生物基产品研究;欧盟也积极投资藻类研究,旨在示范从藻种选育、培养条件优化、油脂提取、生物燃料生产等过程[1]。微藻在食品资源方面的利用涉及到裂殖壶菌,又称裂壶藻,是属于破囊壶菌科的单细胞海洋微藻,在一定的培养条件下,裂殖壶菌胞内油脂中二十二碳六烯酸(DHA,C22:6)含量较高,是值得研究和深度开发的生物合成DHA的优质种源[2]。
DHA为ω-3多不饱和脂肪酸,是一种重要的食品添加剂。它是大脑和视网膜的重要组成成分,还具有抗癌、消炎、预防心血管疾病等诸多功能[3-4],其保健和医疗功效越来越受到重视。与传统的深海鱼油生产DHA的方式相比,裂殖壶菌发酵生产DHA具有培养简单、无季节波动、目的产物含量比高、无污染、无鱼腥味、成本低、不影响海洋生态等优点[5],裂殖壶菌发酵生产DHA开始进入了工业化阶段[6]。
近些年,不断见到优化裂殖壶菌发酵,提高DHA产量的研究报道,如发酵培养基优化[7-9]、pH调控[10-11]、溶氧调控[12-14]、补料策略优化[15]等,靠传统发酵策略提高DHA的发酵生产强度的余地越来越小。而借助遗传育种手段,培育高产DHA的裂殖壶菌变异株仍有一定的发展空间,这也是发酵法提高DHA生产强度的上游基础。
裂殖壶菌基因组约39 Mb[16],且裂殖壶菌代谢体系中脂肪酸合成途径复杂,既存在短链饱和脂肪酸的脂肪酸合酶(fatty acid synthase, FAS)合成途径,又存在长链不饱和脂肪酸的聚酮合酶(polyketide synthase, PKS)的合成通路[17]。尽管基因工程已普遍应用于微生物育种,并且在裂殖壶菌上也有所研究[18-19],但考虑到裂殖壶菌复杂的遗传背景和尚不十分明晰的DHA合成途径,物理和化学诱变仍旧是可以考虑的选择。
甲基磺酸乙酯(EMS)诱变为化学诱变,其作用机制是对DNA上高密度的碱基进行烷化作用,形成转换型或置换型突变[20]。目前EMS诱变在微生物育种以及农作物的优良品种选育上广泛应用,并获得了不错的效果[21-22]。常压室温等离子体(ARTP)是一种新型的诱变技术,它利用大气压辉光放电,产生多种活性粒子,作用于DNA上,引发基因突变[23],它具有操作简单、可控性强、诱变效果好的特点,已逐步开始在科研与工业领域发挥重要作用[24]。由于单种诱变方法往往会使菌种产生抗性,或得到的诱变菌株性能不够稳定,在实际应用中往往采用2种或多种诱变方式相结合的方法进行诱变,即复合诱变[25]。
裂殖壶菌具有多层的细胞壁结构保护着胞内物质[26],DHA的合成途径与代谢机制又十分复杂。以往针对裂殖壶菌的育种手段往往采用单一的诱变方法,这会产生诱变效果差、诱变效率低或诱变株性能不稳定、易退化等问题,如吕晓义等[27]仅仅利用60Co-γ射线辐照诱变裂殖壶菌,获得的诱变菌产量只有5.65 g/L;梁园梅等[28]采用单一UV诱变育种,获得的诱变株性能也没有突出的提升。欲获得性状良好、遗传稳定的裂殖壶菌高产DHA变异株,本研究将EMS-ARTP复合诱变方法应用于裂殖壶菌诱变育种,以期获得裂殖壶菌高产DHA诱变菌。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
菌株:裂殖壶菌(Schizochytriumsp.S31,ATCC 20888),美国菌种保藏中心;
脂肪酸:标准品,美国Sigma公司;
正己烷:HPLC级,美国Fisher公司;
其他试剂:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
离心机:3K15型,德国Sigma公司;
分光光度计:T6新世纪型,北京普禧通用仪器有限公司;
ARTP诱变仪:ARTP-III型,北京思清源生物科技有限公司;
气相色谱仪:GC-2010型,日本岛津公司。
1.1.3 培养基
790 By+固体培养基:葡萄糖5 g/L、胰蛋白胨1 g/L、酵母粉1 g/L、琼脂20 g/L、海水晶17.5 g/L,121 ℃ 灭菌20 min;
种子培养基:葡萄糖30 g/L、胰蛋白胨10 g/L、酵母粉5 g/L、海水晶15 g/L、VB10.05 g/L、VB60.05 g/L、VB120.000 5 g/L,115 ℃灭菌20 min;
发酵培养基:葡萄糖100 g/L、胰蛋白胨5.6 g/L、谷氨酸钠20 g/L、磷酸二氢钾2.5 g/L、硫酸镁7.2 g/L、硫酸钠 12.8g/L、氯化钙 0.4 g/L、海水晶17.5 g/L、VB10.1 g/L、VB60.1 g/L、VB120.001 g/L,115 ℃灭菌20 min;
0.2 mol/L PBS缓冲液(pH 7.2):用双蒸水分别溶解24.00 g 磷酸二氢钠和28.39 g磷酸氢二钠至1 000 mL,然后混合280 mL磷酸二氢钠溶液和720 mL磷酸氢二钠溶液,121 ℃灭菌20 min,备用;
EMS溶液:取5 mL EMS原液,加入到15 mL预冷的乙醇溶液中,加盖并轻轻转动试管混合均匀。
1.2 方法
1.2.1 裂殖壶菌诱变菌株制备
(1) 菌悬液制备:将裂殖壶菌接种于装有50 mL种子培养基的250 mL摇瓶中,28 ℃、200 r/min培养2 d。取1 mL培养液3 000 r/min离心5 min收集菌体,用PBS缓冲液洗涤2次后稀释至OD540为0.6~0.7(以PBS缓冲液为参比管)。
(2) EMS诱变株制备:在10 mL菌悬液中加入400 μL EMS溶液,轻轻摇匀后置于摇床,28 ℃、200 r/min条件下分别处理0,10,20,30,40,50,60 min(0 min为对照组),取出后用5%硫代硫酸钠溶液洗涤2~3次终止反应,细胞用PBS缓冲液悬浮后吸取100 μL均匀涂布于固体培养基平皿上,置于30 ℃避光培养4 d。
(3) ARTP诱变株制备:吸取20 μL菌悬液,均匀涂抹在灭过菌的载物铁片上,将铁片置于ARTP诱变仪载物台上,用高纯氦气等离子体诱变分别处理0(对照组),5,10,15,20,25 s,诱变参数为:电源功率100 W,氦气流量10 L/min,照射距离2 mm。ARTP诱变处理后,将铁片转移至装有1 mL PBS缓冲液的EP管中,震荡洗脱菌体。吸取100 μL菌体悬浮液均匀涂布于固体培养基平皿上,置于30 ℃避光培养4 d。
(4) EMS-ARTP复合诱变菌制备:将EMS诱变处理40 min 后制备的诱变菌悬液吸取100 μL均匀涂布于固体培养基平皿上,置于30 ℃避光培养4 d。混合平皿上长出的单菌落,并挑取一环,接种于装有50 mL种子培养基的250 mL摇瓶中,按1.2.1(1)制备菌悬液,然后按1.2.1(3)经ARTP照射诱变15 s,获得EMS-ARTP复合诱变菌。其中对照组EMS处理时间0 min,ARTP照射时间0 s。
1.2.2 致死率、突变率计算
(1) 致死率计算:各诱变试验中,对对照组和诱变组固体培养基平皿上长出的菌落进行计数。按式(1)计算致死率。
(1)
式中:
rL——致死率,%;
N0——对照组菌落数;
Nm——诱变组菌落数。
(2) 突变率计算:各诱变试验中,选取致死率为80%~90%的处理时间作为最终诱变时间。在该诱变时间下对裂殖壶菌进行诱变处理,平板培养4 d后各组随机挑选50株菌,摇瓶培养120 h后测DHA产量,记产量高于原始菌株10%的诱变株为正突变株,产量低于原始菌株10%的诱变株为负突变株,并按式(2)计算突变率。
(2)
式中:
rm——突变率,%;
rP——正突变率,%;
rN——负突变率,%;
NP——正突变株菌株数;
NN——负突变株菌株数。
1.2.3 分析方法
(1) 生物量测定:各诱变株摇瓶培养120 h后,取5 mL发酵液于离心管中,8 000 r/min离心15 min,用双蒸水洗涤离心2次,冷冻干燥后称重计算生物量。
(2) 含油量测定:采用磷酸香草醛法[29]。
(3) 脂肪酸含量测定:采用气相色谱法[11]。
各诱变组选取5株DHA产量最高的菌株,其发酵平均水平作为该诱变方法下得到的高产菌的发酵水平。
2 结果与分析
2.1 诱变剂量的确定
2种诱变方法对裂殖壶菌的致死效应见图1。裂殖壶菌菌体的致死率与EMS处理时间存在明显的正相关效应,当EMS处理时间为40 min时,致死率达到87%。因此,选取40 min作为EMS处理的诱变剂量。
裂殖壶菌菌体的致死率随着ARTP照射时间的延长而显著增加。当照射时间在15 s以上时,致死率曲线趋于平缓,可能是细胞SOS修复机制的激活,突变率开始增加[30]。此时,裂殖壶菌的致死率达到80%以上。因此,选取15 s作为ARTP照射的诱变剂量。
从图1可以看出,对裂殖壶菌诱变的化学处理中,致死率对应于处理时间,形成较为平缓的上升曲线,而物理诱变中,致死率对应于照射时间则显得陡峭,说明准确掌控照射时间点非常重要。

图1 2种诱变方法对裂殖壶菌的致死效应Figure 1 Lethal effects of 2 mutagenesis factors to Schizochytrium sp.31 (n=3)
2.2 EMS、ARTP和EMS-ARTP处理突变率的对比
分别使用EMS、ARTP和EMS-ARTP复合诱变3种诱变方法对裂殖壶菌进行诱变处理,并对诱变株进行摇瓶培养后测DHA产量,统计正、负突变率,结果见图2。3种诱变方法对裂殖壶菌的诱变效果呈现出一定的差异性。比较2种单因子诱变方法,裂殖壶菌突变率相差不大,介于40%与45%之间,但是在ARTP突变株中,正突变株的数量占到约60%,远高于负突变株;而在EMS突变株中,正、负突变株数量相当。EMS-ARTP复合诱变后,突变率达到55.7%,明显高于2种单因子诱变。其中正突变率达到32.2%,远远高于负突变率。
对裂殖壶菌而言,3种突变方法形成的突变率截然不同。表观上分析,推测EMS-ARTP复合诱变造成了更丰富的突变位点,因此回复突变的频率远远低于单因子诱变。

图2 3种诱变方法对裂殖壶菌诱变处理的突变率Figure 2 Mutation rate of 3 mutagenesis factors to Schizochytrium sp.31 (n=3)
2.3 高产诱变株的关键发酵指标类比
从3种诱变方法获得的诱变株当中各挑选5株DHA产量最高的菌株,其发酵平均水平作为该诱变方法下得到的DHA高产菌株的发酵水平,结果见表1、2。从表1可知,与出发菌株相比,3种DHA高产菌株的生物量无明显的变化,而在含油量上,均有不同程度的提高,其中EMS诱变高产株含油量提升略高于ARTP诱变的,而复合诱变高产株含油量最高,达到51%。如表2所示,EMS诱变高产株的DHA较出发菌株无明显变化,而ARTP诱变高产株和复合诱变高产株DHA含量均得到了提升,分别约为40%和43%。基于上述变化,最终3种诱变菌的DHA产量均得到了一定程度的提升,其中EMS-ARTP复合诱变高产株的产量达到了7.2 g/L,提升了近36%,效果最明显。
3种DHA高产菌株的脂肪酸组成与出发菌株具有明显的差异,见表2。EMS诱变高产株的主要FAS产物,如C14∶0和C16∶0略有增加,主要PKS产物二十二碳五烯酸(DPA)出现下降现象;而ARTP和复合诱变高产株的FAS产物和PKS产物变化与EMS诱变高产株正好相反,如复合诱变高产株的FAS产物由原始菌株的42.3%下降到38.6%,而PKS产物由原始菌株的44.9%上升到55.2%。
表1不同高产DHA裂殖壶菌诱变株发酵性能分析†
Table 1 Analysis of fermentation performances on different high DHA yieldSchizochytriummutants (n=3)

菌株生物量/(g·L-1)含油量/%DHA产量/(g·L-1)w36.41±1.3645.51±2.085.28±0.35mEMS37.01±1.2848.45±2.585.74±0.33mARTP36.82±1.5547.94±2.676.28±0.28mEA36.88±1.2751.15±2.077.16±0.30
† w:原始菌株;mEMS:EMS诱变菌株;mARTP:ARTP诱变菌株;mEA:EMS-ARTP复合诱变菌株。

表2 不同高产DHA裂殖壶菌诱变株脂肪酸组成†Table 2 Fatty acids composition of different high DHA yield Schizochytrium mutants (n=3) %
† w:原始菌株;mEMS:EMS诱变菌株;mARTP:ARTP诱变菌株;mEA:EMS-ARTP复合诱变菌株。
2.4 高产诱变株遗传稳定性
将3种诱变方法获得的高产DHA诱变株进行连续传代培养,考察其遗传的稳定性,结果见图3。经过5代的传代培养,EMS诱变高产株和ARTP诱变高产株的发酵指标都出现了一定程度的退化,而复合诱变高产株的发酵指标保持相对稳定,其DHA含量为42.2%~43.3%,DHA产量为7.0~7.2 g/L,与一代菌无明显差异,遗传稳定性良好。
2.5 诱变方法对裂殖壶菌诱变机理
由3种诱变方法对裂殖壶菌的诱变结果分析可知,EMS产生的诱变效果弱于ARTP,而复合诱变的效果最好。EMS具有烷化DNA碱基的机理,可引发嘌呤和嘧啶转换[22]。在本试验中,EMS诱变高产株的含油量高于出发菌株,但DHA占总脂肪酸的相对含量与出发菌相比相差不大,说明其脂肪酸合成能力得到了提升,但DHA合成的特定代谢途径并未增强。
ARTP诱变为新型的诱变育种方法,它集合了质量、能量和电荷等损伤因素,产生不同的DNA损伤机制,遗传多样性更丰富[31]。Umu-test显示ARTP对基因的损伤能力远高于UV和常规化学诱变方法[32]。ARTP辐射的高活性粒子温度接近室温,不会对菌体产生热致死效应。在本试验中,将ARTP诱变技术应用于裂殖壶菌选育高产DHA菌株,取得了良好的效果,正突变率远远高于负突变率。通过发酵数据和脂肪酸组成的分析可以发现,ARTP高产株的含油量和DHA产量明显提升,而且脂肪酸组成中PKS产物也有了相应的提升,说明诱变株在合成脂肪酸前体物质的相关合成基因和PKS途径的特定基因都有可能发生了变异。
考虑到裂殖壶菌复杂的脂肪酸合成途径,单点或少数几个点的诱变往往不能对DHA的产量产生显著、稳定的改变。将化学诱变和物理诱变相结合,对裂殖壶菌进行EMS-ARTP复合诱变,诱变机制更多样,突变位点更丰富,获得DHA高产菌的概率也更大。通过EMS-ARTP复合诱变得到的高产菌株,DHA产量达到7.2 g/L。李慧玲等[33]采用DES-UV复合诱变结合丙二酸、碘乙酸联合筛选,得到诱变菌株XN001,其DHA产量为5.5 g/L;许永等[34]采用紫外诱变和喹禾灵筛选的方法,筛得的菌株OUC007,其DHA产量为1.2 g/L;袁军等[35]通过ARTP诱变与强氧化剂施压筛选得到的菌种D32,其DHA产量达到7.3 g/L。通过本试验的诱变方法筛选得到的高产诱变菌株,在未使用任何筛选试剂的情况下,已获得较高DHA产量。该产量与近期报道的相同菌种、相同发酵规模的数据相比,已十分具有竞争力(表3)。后期经过合适的筛选方法和发酵培养优化后,有望进一步提高DHA生产能力。

表3 不同破囊壶菌DHA产量和DHA含量比较Table 3 Comparative results of DHA production and percentage among different studies by thraustochytrids
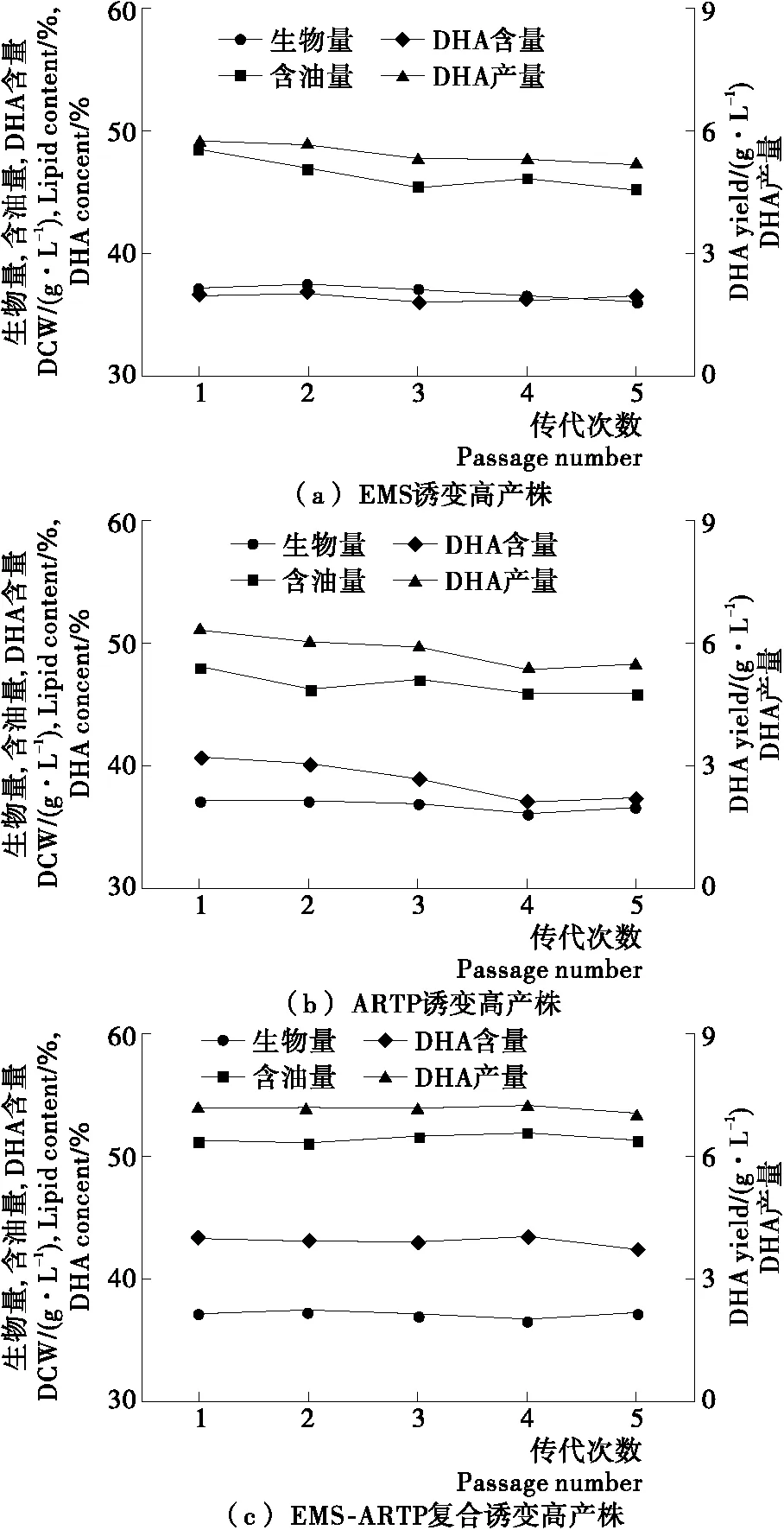
图3 高产诱变株传代次数对发酵指标的影响Figure 3 Effects ofculture passages on fermentation performance of high DHA yield Schizochytrium mutants
3 结论
将EMS-ARTP复合诱变的方法应用于裂殖壶菌诱变选育高产DHA菌株,并对复合诱变获得的DHA高产菌株与单因子诱变高产菌株进行比较分析得出,EMS-ARTP复合诱变高产菌株无论在DHA产量还是在遗传稳定性上,都优于单因子诱变。再加上后期的理性筛选技术及定向施压培养的应用,有望进一步提高裂殖壶菌合成DHA的产率,继而提高工业化生产DHA的效能。
[1] 中国科学院.能源科技领域发展观察[M].北京: 科学出版社, 2016: 303-315.
[2] REN Lu-jing, SUN Xiao-man, JI Xiao-jun, et al.Enhancement of docosahexaenoic acid synthesis by manipulation of antioxidant capacity and prevention of oxidative damage inSchizochytriumsp[J].Bioresource Technology, 2017, 223: 141-148.
[3] D'ELISEO D, VELOTTI F.Omega-3 fatty acids and cancer cell cytotoxicity: implications for multi-targeted cancer therapy[J].J Clin Med, 2016, 5(2): 15-43.
[4] HADLEY K B, BAUER J, MILGRAM N W.The oil-rich algaSchizochytriumsp.as a dietary source of docosahexaenoic acid improves shape discrimination learning associated with visual processing in a canine model of senescence[J].Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2017, 118: 10-18.
[5] JIANG Yue, FAN King-wai, WONG Rsz-yeung, et al.Fatty acid composition and squalene content of the marine microalgaSchizochytriummangrovei[J].Journal of Agricultural and Food Chemistry, 2004, 52(5): 1 196-1 200.
[6] HAUVERMALE A, KUNER J, ROSENZWEIG B, et al.Fatty acid production inSchizochytriumsp.: Involvement of a polyunsaturated fatty acid synthase and a type I fatty acid synthase[J].Lipids, 2006, 41(8): 739-747.
[7] GAUNT L F, BEGGS C B, GEORGHIOU G E.Bactericidal action of the reactive species produced by gas-discharge nonthermal plasma at atmospheric pressure: A review[J].Ieee Transactions on Plasma Science, 2006, 34(4): 1 257-1 269.
[8] REN Lu-jing, SUN Li-na, ZHUANG Xiao-yan, et al.Regula-tion of docosahexaenoic acid production bySchizochytriumsp.: effect of nitrogen addition[J].Bioprocess and Biosystems Engineering, 2014, 37(5): 865-872.
[9] SINGH D, BARROW C J, PURI M, et al.Combination of calcium and magnesium ions prevents substrate inhibition and promotes biomass and lipid production in thraustochytrids under higher glycerol concentration[J].Algal Research-Biomass Biofuels and Bioproducts, 2016, 15: 202-209.
[10] GANUZA E, ANDERSON A J, RATLEDGE C.High-cell-density cultivation ofSchizochytriumsp.in an ammonium/pH-auxostat fed-batch system[J].Biotechnology Letters, 2008, 30(9): 1 559-1 564.
[11] ZHAO Ben, LI Ya-fei, MBIFILE M D, et al.Improvement of docosahexaenoic acid fermentation fromSchizochytriumsp.AB-610 by staged pH control based on cell morphological changes[J].Engineering in Life Sciences, 2017, 17(9): 981-988.
[12] CHANG Gui-fang, WU Juan, JIANG Cui-hong, et al.The relationship of oxygen uptake rate and k(L)a with rheological properties in high cell density cultivation of docosahexaenoic acid bySchizochytriumsp.S31[J].Bioresource Technology, 2014, 152: 234-240.
[13] LEWIS K D, HUANG Wei-feng, ZHENG Xiao-hui, et al.Toxicological evaluation of arachidonic acid (ARA)-rich oil and dcosahexaenoic acid (DHA)-rich oil[J].Food and Chemical Toxicology, 2016, 96: 133-144.
[14] QU Liang, JI Xiao-jun, REN Lu-jing, et al.Enhancement of docosahexaenoic acid production bySchizochytriumsp.using a two-stage oxygen supply control strategy based on oxygen transfer coefficient[J].Letters in Applied Microbiology, 2011, 52(1): 22-27.
[15] HUANG Ting-yen, LU Wen-chang, CHU I-ming.A fermentation strategy for producing docosahexaenoic acid in AurantiochytriumlimacinumSR21 and increasing C22:6 proportions in total fatty acid[J].Bioresource Technology, 2012, 123: 8-14.
[16] JI Xiao-jun, MO Kai-qiang, REN Lu-jing, et al.Genome sequence ofSchizochytriumsp.CCTCC M209059, an effective producer of docosahexaenoic acid-rich lipids[J].Genome Announc, DOI: 10.1128/genomeA.00819-15.
[17] METZ J G, ROESSLER P, FACCIOTTI D, et al.Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J].Science, 2001, 293(5 528): 290-293.
[18] REN Lu-jing, ZHUANG Xiao-yan, CHEN Sheng-lan, et al.Introduction of omega-3 desaturase obviously changed the fatty acid profile and sterol content ofSchizochytriumsp[J].Journal of Agricultural and Food Chemistry, 2015, 63(44): 9 770-9 776.
[19] YAN Jin-fei, CHENG Ru-bin, LIN Xiang-zhi, et al.Overexpression of acetyl-CoA synthetase increased the biomass and fatty acid proportion in microalgaSchizochytrium[J].Applied Microbiology and Biotechnology, 2013, 97(5): 1 933-1 939.
[20] 崔清志, 刘晓虹, 陈惠明.EMS诱变技术研究进展[J].湖南农业科学, 2013(5): 7-9, 13.
[21] 敬樊, 王亮明, 武军, 等.利用甲基磺酸乙酯(EMS)诱导小麦-华山新麦草染色体易位的研究[J].农业生物技术学报, 2015(5): 561-570.
[22] 降云峰, 刘永忠, 李万星, 等.甲基磺酸乙酯诱变技术在大豆育种上的应用[J].园艺与种苗, 2012(6): 12-15.
[23] ZHANG Xue, ZHANG Xiao-fei, LI He-ping, et al.Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J].Applied Microbiology and Biotechnology, 2014, 98(12): 5 387-5 396.
[24] 张雪, 张晓菲, 王立言, 等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报, 2014(7): 2 676-2 684.
[25] 任少雄, 王丹.植物理化复合诱变育种技术研究进展[J].安徽农业科学, 2009(20): 9 345-9 349.
[26] DARLEY W M, PORTER D, FULLER M S.Cell wall composition and synthesis via Golgi-directed scale formation in the marine eucaryote,Schizochytriumaggregatum, with a note on Thraustochytrium sp[J].Archiv Für Mikrobiologie, 1973, 90(2): 89-106.
[27] 吕小义, 付杰, 尹佳, 等.高产DHA裂壶藻突变株的选育[J].中国酿造, 2015(4): 106-109.
[28] 梁园梅, 刘瑛, 李晶晶, 等.高产DHA破囊壶菌Aurantiochytriumsp.PKU#SW7诱变株的筛选[J].微生物学通报, 2016(2): 457-464.
[29] 罗玮, 顾秋亚, 钟湘南, 等.1种快速检测微藻油脂的新方法[J].食品与发酵工业, 2014(12): 165-168.
[30] FU Jie, CHEN Tao, LU Hao, et al.Enhancement of docosahexaenoic acid production by low-energy ion implantation coupled with screening method based on Sudan black B staining inSchizochytriumsp[J].Bioresource Technology, 2016, 221: 405-411.
[31] LI He-ping, WANG Zhi-bin, GE Nan, et al.Studies on the physical characteristics of the radio-frequency atmospheric-pressure glow discharge plasmas for the genome mutation of methylosinustrichosporium[J].Ieee Transactions on Plasma Science, 2012, 40(11): 2 853-2 860.
[32] ODA Y, NAKAMURA S, OKI I, et al.Evaluation of the new system (umu-test) for the detection of environmental mutagens and carcinogens[J].Mutation Research, 1985, 147(5): 219-229.
[33] 李慧玲, 刘永梅.诱变选育高产DHA裂殖壶菌突变株[J].食品科技, 2015(9): 12-16.
[34] 许永, 臧晓南, 徐涤, 等.裂殖壶菌诱变筛选的研究[J].中国海洋大学学报:自然科学版, 2012(12): 54-58.
[35] 袁军, 赵犇, 孙梦玉, 等.常压室温等离子体(ARTP)诱变快速选育高产DHA的裂殖壶菌突变株[J].生物技术通报, 2015(10): 199-204.
[36] CHEN Wei, ZHOU Peng-peng, ZHU Yuan-min, et al.Improvement in the docosahexaenoic acid production ofSchiz-ochytriumsp.S056 by replacement of sea salt[J].Bioprocess and Biosystems Engineering, 2016, 39(2): 315-321.
[37] CHANG Gui-fang, GAO Ni-si, TIAN Gui-wei, et al.Improvement of docosahexaenoic acid production on glycerol bySchizochytriumsp S31 with constantly high oxygen transfer coefficient[J].Bioresource Technology, 2013, 142: 400-406.

