不同猪肉组织在太赫兹衰减全反射光谱中的特性差异
齐 亮
赵茂程1,3
赵 婕1,4
唐于维一1
(1.南京林业大学机械电子工程学院,江苏 南京 210037;2.南京师范大学分析测试中心,江苏 南京 210046;3.泰州学院,江苏 泰州 225300;4.南京工业职业技术学院航空工程学院,江苏 南京 210023)
猪肉是中国主要的肉类消费品种。随着生活水平提高与科技进步,人们对猪肉品质的要求更加全面与精细。猪肉的品质包括营养成分、风味、嫩度、保水性和新鲜度等要素[1]71,不仅可以用有损检测方法细致精确地获得这些指标,还可以通过无损检测方法快速在线获取,其中光谱分析技术是一种重要的无损检测手段。目前,红外光谱分析技术比较成熟[2-3],而太赫兹(Terahertz,THz)光谱分析技术才刚刚起步[4]。
猪肉的各类组织——肌肉、脂肪、皮肤都能体现猪肉的品质。为了探索THz无损检测猪肉品质的可行性,需要首先观察不同组织在THz波段是否有显著区分,再进一步研究各组织的品质在THz波段的表达。
一般通过反射模式或透射模式测量肉组织的THz光学特性。但是水能强烈吸收THz波,使得含水丰富的鲜肉组织透射信号的信噪比低,影响THz光学参数的测量精确性。对于稍厚的组织样品,几乎无法探测到透射信号[5]。一般采用脱水[6]、冷冻切片[7]等方法,避免水对THz波的强烈吸收,但是这些预处理会影响新鲜组织的水合状态及组织结构,难以实现新鲜组织的快速无损检测。反射式虽然不需要复杂的预处理,对样品厚度没有要求,但是反射波的能量损失较多、信噪比低,需要通过试验尝试选择适合样本的特定反射角度,以获得最大的信噪比[8-9]。此方法的调试时间长,缺乏通用性。本研究拟引入衰减全反射 (attenuated total reflectance,ATR)检测模式,克服猪肉样本中水分的干扰,获取并分析猪肉的肌肉、脂肪和皮肤组织在ATR模式下的THz光谱,研究THz-ATR技术应用到组织类型鉴别的可行性以及在猪肉品质无损检测中的应用前景。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
猪肉:宰后排酸12 h的猪通脊肉,南京市学衡路苏果超市;
纯水:用Milli-Q Academic超纯水仪制备。
1.1.2 主要仪器设备
超纯水仪:Milli-Q Academic型,美国Millipore公司;
THz光谱分析仪:TAS7500SP型,使用钛宝石泵浦激光器,激光输出功率为20 mW,中心波长1 550 nm,脉冲宽度约50 fs,重复频率50 MHz,日本Advantest公司。
1.2 试验原理
1.2.1 THz光谱分析仪工作原理 THz光谱分析仪采用电控光学取样法(electronically controlled optical sampling,ECOPS)产生和探测THz脉冲信号[10-11]。如图1所示,它使用2个激励频率稍有差异的飞秒激光器同时泵浦光电导天线,其中激光器1通过光纤将飞秒激光脉冲入射到THz发生器,在偏置电场作用下利用光电导天线产生THz脉冲,经抛物面镜反射进入由硅晶体制成的ATR棱镜并产生全反射。载有样品信息的全反射波从棱镜射入探测端的光电导天线,与激光器2泵浦的飞秒激光脉冲相调制,产生激发电流,通过探测电流可以获得样品的THz-ATR时域波形。

1.由光电导天线构成的THz发生器 2.抛物面镜 3.偏置电压 4.样品 5.ATR晶体 6.由光电导天线构成的THz探测器 7.电流探测
图1 THz光谱仪的工作原理
Figure 1 Working principle of THz spectrometer
1.2.2 ATR的光学参数 图2是THz-ATR检测附件的光路示意图。THz波在ATR晶体与样品的紧密接触面发生了全反射,并产生隐失波(evanescent wave)穿入样品内部,其振幅随入射深度呈指数衰减,穿透深度dp为微米级[12]。
隐失波与样品的相互作用使得全反射波出现了幅度衰减(ΔA)和相位延迟(Δφ),可以用复折射率在频域范围综合表达这些变化[13-14]。复折射率又可以用折射率和消光系数来表示[15]:

图2 THz-ATR光学原理示意图Figure 2 Schematic illustration of THz-ATR optics

(1)
式中:

n(ω)——被测样品的折射率;
κ(ω)——被测样品的消光系数。
折射率反映光在样品中的传播速率,消光系数表示样品对光的吸收强度。复折射率能够表征THz波对样品成分的响应,是被测样品固有的光学常数,由样品微环境 (如温度、成分、物质构象、水合状态等)决定,同仪器的相关参数(如THz波的辐射强度以及隐失波的穿透深度)无关[16-17]。与透射、反射模式相比,ATR模式可以更加精确测得样品的复折射率[13, 18]。本研究使用折射率n(ω)和消光系数κ(ω)的THz光谱图来表达样品的复折射率。
1.3 方法
1.3.1 样本制备 样本采购后用冷藏箱以较快速度运回实验室。将样本中不同的组织——肌肉、脂肪和皮肤切割成2.5 cm×2.5 cm方形薄片,其中肌肉和脂肪的薄片厚度为0.5 cm,而皮肤厚度在分割前已经较薄,且皮肤组织较为坚硬,难于切薄,故保留皮肤组织的原始厚度,不再切薄。
1.3.2 THz光谱采集 THz光谱分析仪工作的环境温度为(25±1) ℃,相对湿度为50%~65%,频率分辨率为7.6 GHz,检测频率范围是0.1~2.0 THz,共250个采样频率点(波点),样品的谱线经2 048次自动扫描并平均后得到。该光谱仪自带样品腔,检测过程中外接气泵泵入干燥空气对样品腔除湿,以减少空气中水汽吸收干扰THz波。
本研究用纯水验证THz光谱分析仪在25 ℃下THz-ATR光谱数据的可靠性与有效性,因此分别采集了纯水和肉样的THz光谱。纯水的检测方法:用吸管将适量纯水滴入ATR检测窗,测量其THz光谱,检测完毕后用滤纸将残留的水分吸干;肉样的检测方法:将样本平整放入ATR检测窗表面,每份样品上下两面分别采集3次,共重复测量6次,获得6份THz光谱数据,算术平均后获得该样本的最终THz光谱数据。每检测完一份样品后,用纯水擦拭ATR检测窗表面,去除表面残留的油脂等,并用滤纸将残留的水分吸干。
2 结果与分析
2.1 纯水的THz光谱
纯水在0.2~2.0 THz下实测的折射率和消光系数与参考值[19]的比较结果见图3。由图3可知,两者的实测值和参考值基本一致。可见,此设备能够可靠、准确地获得纯水的THz光谱特性。

图3 纯水在0.2~2.0 THz的参考与实测折射率和消光系数Figure 3 The referenced and experimental refractive index and extinction coefficient of pure water in the 0.2~2.0 THz
2.2 不同猪肉组织的THz光谱
猪肉中不同的组织——肌肉、脂肪和皮肤的ATR时域波形图见图4。同空白样以及纯水的波形图进行比较,图4(a)中信号的峰值或者能量从高到低依次是:空白、脂肪、皮肤、肌肉、纯水。肉中各组织水分的含量从高到低依次是肌肉(70%~80%)、皮肤(60%~70%)、脂肪(10%~30%)[1]58。可见,猪肉组织中的水会显著吸收入射THz波的能量,使得ATR波能量出现不同程度的衰减,衰减程度和组织含水量呈显著关系,含水量越高衰减越多[7,20]。从图4(b)波峰在时间轴上的位置可以看出,脂肪、皮肤、肌肉、纯水的ATR信号和空白信号有一个明显的相位差,而这3种组织以及纯水在相位上区别相对较小。可见,不同组织在THz-ATR条件下主要体现为ATR信号的振幅衰减程度不同。
根据1.2所述,可以融合时域中幅度与相位的差异,将ATR信号进行傅里叶变换,获得猪肉组织在不同频率下的折射率与消光系数,见图5。其中,肌肉的折射率为1.9~2.5,脂肪的折射率为1.7~1.8,皮肤的折射率为1.7~2.1,与文献[7~8]报道基本吻合,而3种组织的消光系数目前尚没有研究报道。
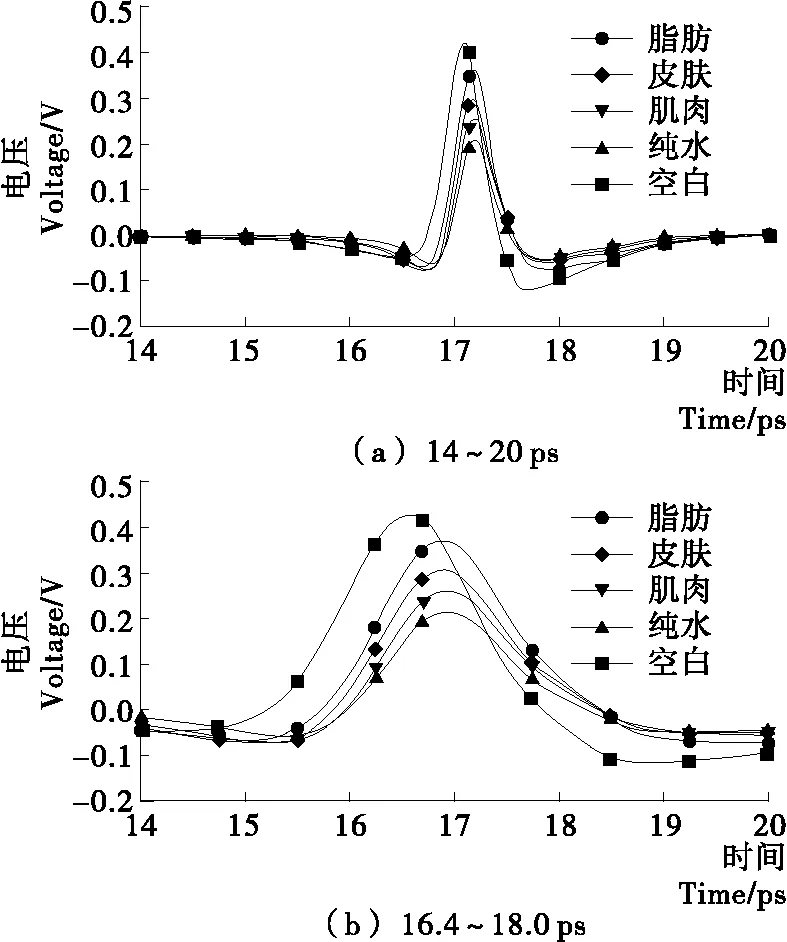
图4 空白、猪肉组织以及纯水的THz时域光谱图Figure 4 THz time-domain wave forms of no sample,porcine tissue and pure water
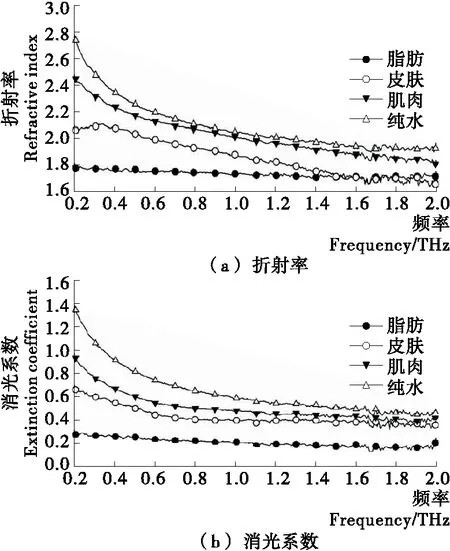
图5 脂肪组织、皮肤组织、肌肉组织和纯水的折射率和消光系数Figure 5 The refractive index and extinction coefficient of adipose, skin, muscle and pure water
从图5中各谱线的总体位置来看,折射率和消光系数从高到低依次是纯水、肌肉、皮肤、脂肪,与图4中各样本THz脉冲的峰值大小排序相一致。可见,在0.2~2.0 THz测量范围内,各组织的水分含量会极大地影响猪肉组织的折射率和消光系数,含水量越高,折射率以及消光系数就会越大。
2.3 不同组织的光谱差异
皮肤组织的主要成分为胶原蛋白,肌肉组织的基本成分为肌纤维蛋白。蛋白质的基本组成单位氨基酸在THz波段有特征吸收[21],蛋白质结构中的疏水键、氢键和静电力等一系列非共价键对THz波也比较敏感[22],在生物组织内蛋白质借助分子表面分布的极性基团与水分子之间的静电引力形成了水壳层结构[23],这些因素使得肌肉和皮肤组织对THz波吸收较强。动物的脂肪主要由甘油三酯的混合物构成,甘油三酯以脂滴的形式储存于脂肪细胞中。甘油三酯是非极性分子,表面没有羟基或氨基等亲水基团,分子周围储存的结合水很少,因此脂肪组织对THz波的吸收明显弱于皮肤、肌肉组织[5],主要组成分子及其结构的不同可能是除了含水量之外造成各组织光谱信号差异的另一个重要因素。
光谱中未见有明显的吸收峰或者特征波段,一方面是因为猪肉组织富含水,而因水分子集体平移导致其对THz无特征吸收[24],另一方面是因为猪肉成分十分复杂,生物大分子如氨基酸[21]、多肽[25]、DNA[26]等以及生物小分子如核苷酸[27]等都会对THz波有吸收,导致谱线相互重叠,无法分辨出特征峰。
不论从折射率还是消光系数来看,猪肉3种组织的谱线都具有较大区别。尤其在0.2~1.6 THz的低频段区分更明显。皮肤与脂肪的折射率在1.6~2.0 THz频段出现了重合,但是各组织的消光系数THz谱都有较好的区分度。进一步在0.2~1.6 THz对各组织样本的光谱数据做统计分析,结果(表1、2)表明,除了脂肪和皮肤组织的折射率最小值相同以外,各组织折射率和消光系数的统计值均有明显差异。其中,3种组织的平均值和标准差从低至高依次是脂肪、皮肤和肌肉组织。

表1 猪肉组织折射率统计值Table 1 Statistical values of refractive index in pork tissues

表2 猪肉组织消光系数统计值Table 2 Statistical values of extinction coefficient in pork tissues
可见在低频段,折射率或者消光系数可以作为鉴别组织类型的参数和指标。该方法可以推广到各种家禽(如牛、羊、鸡等)组织样本的鉴别。这是因为这些家禽的同类组织具有相似的化学组成,所以其THz光谱也具有相似性[9, 20]。
因此,猪肉组织的THz光谱是其组成成分在THz波段的共同表达。猪肉的品质不同,决定品质的生物分子也不相同,其THz光谱也会不相同。虽然无法通过特征峰来区分品质,但是可以对光谱进行综合分析,建立光谱数据与品质指标的数学关系模型,实现猪肉品质的快速无损检测。由于不同猪肉组织的THz光谱特性有明显差异,因此,需对同一种猪肉组织进行THz品质检测。
3 结论
利用THz-ATR技术,不需要复杂的预处理,就能够获得猪肉不同组织在THz波段下的折射率和消光系数,从而无损检测鲜猪的肌肉、皮肤和脂肪组织。本研究表明:含水量是影响新鲜组织对THz波吸收的主要因素,在0.2~1.6 THz 低频段下,猪肉不同组织的THz光谱区分较明显。虽然本研究的试验样本来自单一主体,要给出定量的结论尚需进一步的统计试验,但仍然可以看出用THz-ATR技术无损鉴别组织类型是可行的;可以预见,在对同一种猪肉组织取样的前提下,能够通过建立各样本的THz光谱与猪肉品质的关系数学模型,实现猪肉品质的无损检测。
[1] 孔保华, 马丽珍.肉品科学与技术[M].北京: 中国轻工业出版社, 2003.
[2] 杨智灵, 李涛, 任保增.近红外光谱技术在食品安全检测中的最新研究进展[J].食品与机械, 2013, 29(5): 237-240.
[3] 王龙, 朱荣光, 段宏伟, 等.光学快速分析技术在食品掺假检测中的应用[J].食品与机械, 2016, 32(3): 235-238.
[4] 齐亮, 赵婕, 赵茂程.冷鲜猪肉的新鲜度无损检测技术现状及THz检测技术展望[J].食品与机械, 2016, 32(9): 219-224.
[5] WANG Yu-ye, MINAMIDE H, TANG Ming, et al.Study of water concentration measurement in thin tissues with terahertz-wave parametric source[J].Optics Express, 2010, 18(15): 15 504-15 512.
[6] 郭力菡, 王新柯, 张岩.生物组织的太赫兹数字全息成像[J].光学精密工程, 2017, 25(3): 611-615.
[7] HOSHINA H, HAYASHI A, MIYOSHI N, et al.Terahertz pulsed imaging of frozen biological tissues[J].Applied Physics Letters, 2009, 94(12): 1-3.
[8] HE Yue-zhi, UNG B S, PARROTT E P, et al.Freeze-thaw hysteresis effects in terahertz imaging of biomedical tissues[J].Biomedical Optics Express, 2016, 7(11): 4 711-4 717.
[9] WILMINK G J, IBEY B L, TONGUE T, et al.Development of a compact terahertz time-domain spectrometer for the measurement of the optical properties of biological tissues[J].Journal of Biomedical Optics, 2011, 16(4): 1-10.
[10] KIM Y, YEE D S.High-speed terahertz time-domain spectroscopy based on electronically controlled optical sampling[J].Optics Letters, 2010, 35(22): 3 715-3 717.
[11] 刘龙海, 谢剑华, 陈媚媚, 等.太赫兹时域光谱成像系统及其检测应用[J].光电产品与资讯, 2015(9): 22-24.
[12] 翁诗甫.傅里叶变换红外光谱分析[M].北京: 化学工业出版社, 2010: 157-159.
[13] NAGAI M, YADA H, ARIKAWA T, et al.Terahertz time-domain attenuated total reflection spectroscopy in water and biological solution[J].International Journal of Infrared and Millimeter Waves, 2006, 27(4): 505-515.
[14] SHIRAGA K, OGAWA Y, KONDO N, et al.Evaluation of the hydration state of saccharides using terahertz time-domain attenuated total reflection spectroscopy[J].Food Chemistry, 2013, 140(1/2): 315-320.
[15] SMYE S W, CHAMBERLAIN J M, FITZGERALD A J, et al.The interaction between Terahertz radiation and biological tissue[J].Physics in Medicine & Biology, 2001, 46(9): 101-110.
[16] MARKELZ A G.Terahertz dielectric sensitivity to biomolecu-lar structure and function[J].IEEE Journal of Selected Topics in Quantum Electronics, 2008, 14(1): 180-190.
[17] HIRORI H, YAMASHITA K, NAGAI M, et al.Attenuated total reflection spectroscopy in time domain using terahertz coherent pulses[J].Japanese Journal of Applied Physics Part 2: Letters & Express Letters, 2004, 43(10A): L1 287-L1 289.
[18] JEPSEN P U, COOKE D G, KOCH M.Terahertz spectros-copy and imaging-Modern techniques and applications[J].Laser and Photonics Reviews, 2011, 5(1): 124-166.
[19] PALIK E D.Handbook of optical constants of solids II[M].California: Academic Press, 1991: 1 067-1 077.
[20] HE Ming-xia, AZAD A K, YE Sheng-hua, et al.Far-infrared signature of animal tissues characterized by terahertz time-domain spectroscopy[J].Optics Communications, 2006, 259(1): 389-392.
[21] LI Zhi, GUAN Ai-hong, GE Hong-yi, et al.Wavelength selection of amino acid THz absorption spectra for quantitative analysis by a self-adaptive genetic algorithm and comparison with mwPLS[J].Microchemical Journal, 2017, 132: 185-189.
[22] MERNEA M, CALBOREAN O, GRIGORE O, et al.Validation of protein structural models using THz spectroscopy: a promising approach to solve three-dimensional structures[J].Optical & Quantum Electronics, 2014, 46(4): 505-514.
[23] Ebbinghaus S, Kim S, Heyden M, et al.An extended dynami-cal hydration shell around proteins[J].Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(52): 20 749-20 752.
[24] 刘畅, 岳凌月, 王新柯, 等.利用太赫兹反射式时域光谱系统测量有机溶剂的光学参数[J].光谱学与光谱分析, 2012, 32(6): 1 471-1 475.
[25] ZHANG Ming-kun, WEI Dong-shan, TANG Ming-jie, et al.Molecular dynamics simulations of conformation and chain length dependent terahertz spectra of alanine polypeptides[J].Molecular Simulation, 2016, 42(5): 1-7.
[26] ZHANG Wei, BROWN E R, RAHMAN M, et al.Observation of terahertz absorption signatures in microliter DNA solutions[J].Applied Physics Letters, 2013, 102(2): 219-222.
[27] SHEN Y C, UPADHYA P C, LINFIELD E H, et al.Tempera-ture-dependent low-frequency vibrational spectra of purine and adenine[J].Applied Physics Letters, 2003, 82(14): 2 350-2 352.

