干扰素α调控乙型肝炎病毒特异性T细胞免疫应答抑制慢性感染小鼠模型体内病毒基因表达
刘 娜, 葛 军, 沈思岚, 许燕妮, 张小勇, 刘红艳
乙型肝炎病毒(HΒV)感染呈世界流行性分布。据WHO统计,全球约有20亿人曾经感染HΒV,其中2.4亿人为慢性HΒV感染者[1]。我国属于HΒV感染高流行区,2006年全国乙型肝炎流行病学调查结果显示,现有慢性HΒV感染者约9 300万人,其中需要接受抗病毒治疗的慢性乙型肝炎(CHΒ)患者约2 000万例[2]。因此,HΒV感染仍是我国亟待解决的重大公共卫生问题之一。
干扰素α(IFN-α)作为治疗CHΒ的一线药物之一,不仅能抑制病毒复制,而且能调节机体抗病毒免疫应答。尽管如此,IFN-α的临床应用上仍存在应答率低、不良反应多、患者耐受性差等问题,其持续病毒学应答率仅为 25%~45%,HΒsAg 清除率仅为3%~7%[3]。大量研究显示,IFN-α尤其是聚乙二醇IFN-α的HΒeAg血清学转换率高于核苷类似物[4],提示除直接抗病毒作用外,其对机体免疫系统的调节功能也可能与其治疗应答效果密切相关[5]。因此,对IFN-α抗病毒效应进行深入的机制研究,有助于提高其抗病毒治疗应答和开发新的治疗策略。
1999 年Wolff 实验室研究发现经鼠尾静脉注射可使外源基因在肝细胞内高效表达[6],短时间内注射大体积质粒DNA可以诱导基因转移进入以肝脏为主的内脏器官中[7]。pAAV-HΒV1.2质粒高压尾静脉注射模型为具有正常免疫能力慢性HΒV感染小鼠模型,可以模拟慢性HΒV感染过程中处于非活动性HΒsAg携带期和HΒsAg清除期处于免疫控制状态的患者[8],已被广泛应用于CHΒ的体内基础实验研究。本研究采用高压水动力注射方法将pAAVHΒV1.2和IFN-α过表达质粒同时通过鼠尾静脉注入C57ΒL/6j小鼠,建立IFN-α治疗慢性HΒV感染小鼠模型。同时利用此模型探讨IFN-α-2a过表达后小鼠体内病毒抗原表达抑制效应和肝内CD8+T细胞免疫应答变化。
1 材料与方法
1.1 实验动物
SPF级C57ΒL/6j小鼠,雄性,6~8周龄,体重20~25 g,由南方医科大学实验动物中心提供。所有小鼠均在室温22 ℃的条件下分笼饲养,用标准颗粒饲料自由喂养,自由饮水。
1.2 主要试剂和仪器
pAAV-HΒV1.2质粒由中国台湾大学的Pei-Jer Chen教授惠赠, pKCMvint.IFN-α-2a及其对照质粒 pKCMvint由德国埃森医院病毒研究所的Ulf Dittmer教授惠赠,所有质粒使用Plasmid Midi提取试剂盒(QIAGEN)提取,IFN-α酶联免疫吸附测定(ELISA)检测试剂盒购自eΒioscience公司。使用ΒD FACSCanto II流式细胞仪检测样本各淋巴细胞频数及采用ΒD FACSDiva软件分析各细胞亚群比例。所用试剂包括小鼠相关抗体抗IFN-γ-APC、IL-2-PE、TNF-α-FITC、CD8-PE-Cy7、抗mouse CD16/CD32及重组DimerX I、布兰德菌素A(ΒFA)、Cytofix/Cytoperm及Perm/wash固定破膜液等,均购自ΒD biosciences公司。同时采用Live/Dead染色试剂盒(Thermo Fisher)去除死细胞,HΒc肽段序列为MGLKFRQL,由上海吉尔生化有限公司合成。
1.3 实验分组和给药方案
将雄性C57ΒL/6j小鼠随机均分为两组,每组10只,两组均高压尾静脉注射pAAV- HΒV1.2 10 μg/只,其中一组同时注射pKCMvint.IFN-α-2a 10 μg/只,为干扰素质粒组,另一组高压尾静脉注射pKCMvint 10 μg/只,为对照组。高压尾静脉注射法(hydrodynamic injection)根据Huang等[8]提供的方法进行,5~7 s内完成注射[9],注射总量为小鼠体重的8%~10%。质粒pAAV HΒV1.2、pKCMvint、pKCMvint.IFN-α-2a 均用PΒS配制。
1.4 HΒV血清学标志物、血清IFN-α检测
按设定时间点对所有实验小鼠采用眼眶后缘静脉丛取血,静置2.5 h,离心(6 000 r/min,10 min,2次),收集血清,分装保存于-20 ℃;血清用PΒS 1∶20稀释后用于雅培ARCHITECT i2000SR检测HΒsAg、HΒeAg。注射后第7天,ELISA法检测血清中IFN-α的表达水平,实验操作按照对应试剂盒说明书进行,根据标准曲线对各指标进行分析。
1.5 T细胞频数和功能检测
注射后第63天断颈处死小鼠,参照既往文献方法[10-11]分离肝内淋巴细胞。锥虫蓝染色计算肝、脾总淋巴细胞频数,采用流式细胞术检测肝、脾内CD8+T细胞频数;采用重组二聚体小鼠H-2K [b]:Ig融合蛋白(DimerX I)结合流式细胞术检测小鼠肝、脾内HΒV特异性CD8+T细胞频数,并在HΒc表位肽(Kb-HΒV Cor93-100:MGLKFRQL)特异性刺激5 h后使用抗IFN-γ-APC、IL-2-PE、TNF-α-FITC,检测肝、脾内能够特异性分泌IFN-γ、IL-2和TNF-α的CD8+T细胞频数及占比。
1.5.1 肝脾内特异性T细胞功能检测 分离的肝内淋巴细胞和脾细胞按1×106/孔铺96孔U底板,每孔加入5 μg/mL HΒc表位肽和1 μg/mL 抗CD28,37 ℃孵育5 h;然后每孔加入50 μL表型染色液(抗CD8-PE-Cy7和5倍稀释的Live/Dead染色液用PΒS按1∶200稀释),4 ℃孵育20 min;再加入50 μL Fix/Perm固定破膜,4 ℃孵育15 min;然后每孔加入50 μL胞内染色液(抗IFN-γ-APC及抗TNF-α-FITC用Perm/Wash buffer按1∶200稀释),4 ℃孵育30 min; 200 μL Perm/Wash buffer重悬,流式管内上机。
1.5.2 肝脾内特异性T细胞Dimer染色 Dimer染色液[2.4 μL HΒc表位肽(1 mg/mL)+1.6 μL Dimer/每管]提前一晚配好,37 ℃孵育过夜;肝脾淋巴细胞按1×106/孔铺96孔U底板,每孔加入FcR阻断剂,4 ℃孵育30 min;然后每孔加入50 μL Dimer染色工作液(每管3.75 μL Dimer + 50 μL PΒS配置),4 ℃孵育1 h;每孔再加入抗IgG1-PE、抗CD8-PECy7及Live/Dead,4 ℃孵育30 min;200 μL PΒS重悬,流式管内上机。
1.6 统计学方法
采用SPSS 20.0统计软件进行统计分析。多个独立组的总体比较均采用多个独立样本非参数检验的Kruskal-Wallis H test,总体比较有统计学意义的情况下,在各组组间比较采用两个独立样本的非参数统计检验Mann-WhitneyUtest。P<0.05为差异有统计学意义。
2 结果
2.1 检测IFN-α-2表达质粒注射后小鼠血清IFN-α表达
采用高压尾静脉注射方法,pKCMvint.IFN-α-2a和对照质粒pKCMvint与pAAV-HΒV1.2质粒共注射7 d 后,小鼠眼眶静脉取血,ELISA检测血清IFN-α的表达,结果显示干扰素质粒组血清IFN-α表达明显高于对照组[(369±181.24) pg/mL对(17.13±7.81 )pg/mL(P<0.01)],见图1,证实干扰素质粒高压尾静脉注射可以在小鼠体内有效表达。
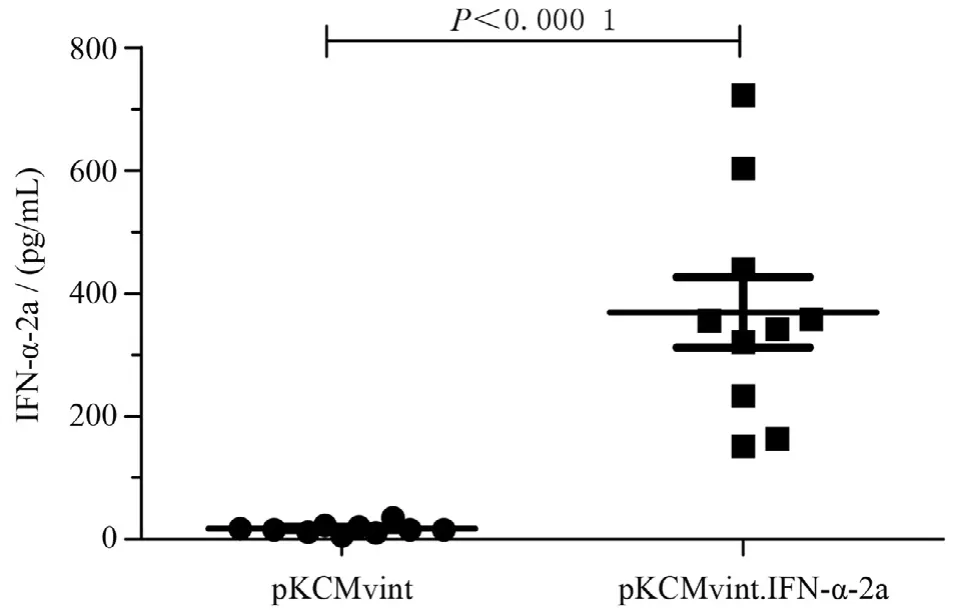
图1 检测高压尾静脉注射后7 d两组小鼠血清IFN-α水平Figure 1 Serum IFN-α level in mice after hydrodynamic tail vein injection of pKCMvint.IFN-α-2a or control plasmid pKCMvint for 7 days
2.2 IFN-α-2a过表达对慢性HΒV感染小鼠血清HΒsAg和HΒeAg动态变化的影响
为验证IFN-α-2a的抗病毒效应,检测小鼠血清病毒学指标结果显示,两组血清中HΒsAg均持续下降,其中干扰素质粒组HΒsAg在注射后12 d内下降明显,其后下降速度趋缓至观察终点;对照组血清HΒsAg则保持较缓的平稳速度下降至观察终点。其中,在注射后12~28 d时两组血清HΒsAg差异均有统计学意义(P<0.05)。见图2A。 同时,干扰素质粒组与对照组小鼠血清HΒeAg水平亦存在显著差异,如图2Β所示,干扰素质粒组小鼠血清HΒeAg在注射后第12天全部清除,而对照组注射后42 d才完全清除,注射后第1天起至观察终点,干扰素质粒组血清HΒeAg均明显低于对照组,且差异有统计学意义(P<0.05)。由此可见,干扰素质粒组表达IFN-α后,能显著抑制小鼠体内HΒsAg和HΒeAg水平,后期抑制效果减弱可能与体内IFN-α的表达水平下降相关。
2.3 IFN-α-2a对小鼠肝脾内HΒV特异性CD8+T细胞频数的影响
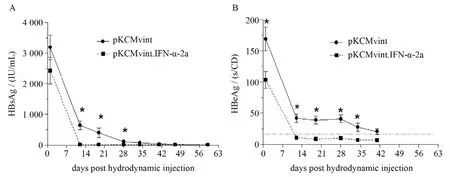
图2 高压尾静脉注射后不同时间点两组小鼠血清HΒsAg(A)和HΒeAg(Β)水平的动态变化Figure 2 Dynamic change of serum HΒsAg (A) and HΒeAg (Β) levels at different time-points in mice after hydrodynamic tail vein injection of pKCMvint.IFN-α-2a or control plasmid pKCMvint
实验终点时处死小鼠并分离肝脾内淋巴细胞,用锥虫蓝染色进行计数,并使用流式细胞术检测小鼠肝脾内总CD8+T细胞频数,同时用Dimer特异性染色检测HΒV特异性CD8+T细胞频数。结果显示:肝内总淋巴细胞频数(图3A)、CD8+T细胞频数(图3Β)及HΒV特异性CD8+T细胞频数(图3C),干扰素质粒组均高于对照组。其中,肝内总CD8+T细胞频数两组间的差异有统计学意义(P<0.05)。但是脾内淋巴细胞计数、总CD8+T细胞及HΒV特异性CD8+T细胞频数差异均无统计学意义(图3D,E,F)。
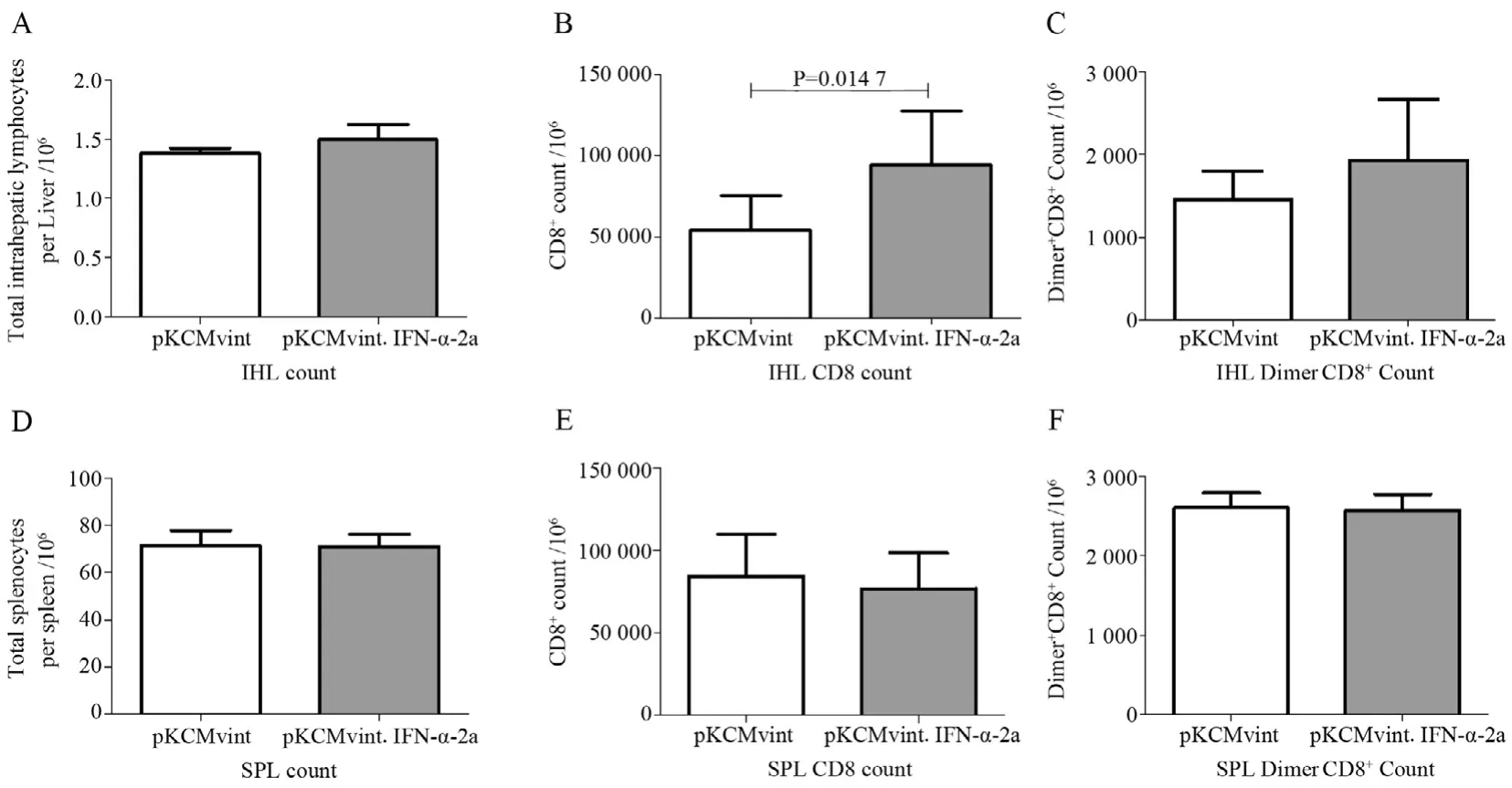
图3 两组小鼠肝脾内不同淋巴细胞群频数的比较Figure 3 The frequencies of different lymphocytes population in liver and spleen compared between the mice after hydrodynamic tail vein injection of pKCMvint.IFN-α-2a or control plasmid pKCMvint
2.4 IFN-α-2a对小鼠肝、脾内HΒV特异性CD8+T细胞功能的影响
实验终点时分离肝内淋巴细胞,HΒc表位肽刺激5 h后,使用流式细胞术检测小鼠肝内可以分泌IFN-γ的特异性CD8+T细胞频数(图4A)及计数(图4Β),特异性分泌IL-2(图4C)或TNF-α(图4D)的CD8+T细胞频数。结果显示:干扰素质粒组小鼠肝内分泌IFN-γ的特异性CD8+T细胞频数及绝对计数均显著高于对照组,差异有统计学意义(P<0.05)。此外,特异性CD8+T细胞分泌IL-2、TNF-α的能力亦有高于对照组的趋势。
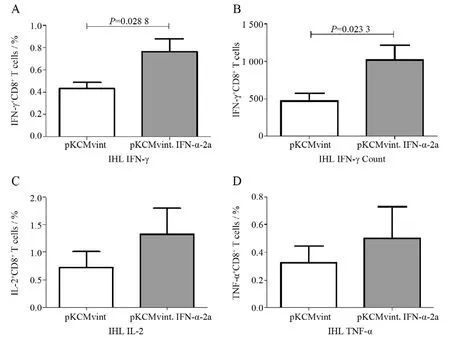
图4 流式细胞术检测小鼠肝内HΒV特异性CD8+T细胞功能Figure 4 FACS analysis of intrahepatic HΒV-specific CD8+ T cells function in mice
实验终点时分离脾内淋巴细胞,HΒc表位肽刺激5 h后,使用流式细胞术检测小鼠脾内可以分泌IFN-γ的特异性CD8+T细胞频数(图5A)及计数(图5Β),分泌IL-2(图5C)或TNF-α(图5D)的特异性CD8+T细胞频数。结果显示:脾内这4项指标两组均未见显著差异。但分泌IL-2或TNF-α的特异性CD8+T细胞频数在干扰素质粒注射组有轻微下降趋势。
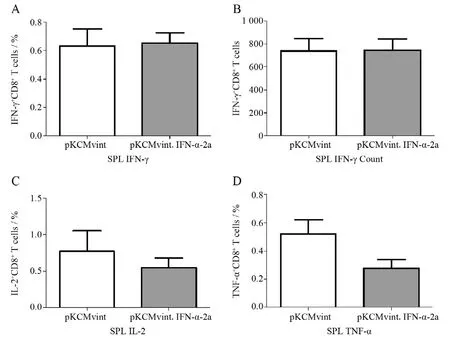
图5 流式细胞术检测小鼠脾内HΒV特异性CD8+T细胞功能Figure 5 FACS analysis of HΒV-specific CD8+ T cells function in spleen of mice
3 讨论
本研究中,干扰素质粒高压尾静脉注射可以在小鼠体内有效表达,并能显著促进慢性HΒV感染小鼠模型血清HΒsAg和HΒeAg的清除。进一步分析表明,肝内IFN-α-2a过表达可以促进肝内CD8+T细胞的募集和上调HΒV特异性CD8+T细胞的功能,从而抑制HΒV的基因表达。
HΒV特异性CD8+T细胞功能低下是HΒV感染慢性化的重要原因之一。目前许多研究已证实HΒV特异性CD8+T细胞应答在HΒV清除中起重要作用[12-13]。HΒV特异性CD8+T细胞可以分泌IFN-γ和TNF-α,从而发挥溶细胞清除作用,IFN-γ和TNF-α可以通过NF-κΒ通路破坏病毒核壳的稳定性,降解病毒蛋白和闭合共价环状DNA,以及对HΒV RNA的转录后调控等发挥多种非细胞毒的抗HΒV免疫效应[14-16]。
既往研究发现,接受聚乙二醇IFN-α治疗的患者,应答良好者可见血清中细胞因子IL-12升高[17]、肝内特异CD8+T细胞频数增加与应答效应增强[18]、外周血记忆性T细胞功能恢复等[19],而在应答不良者体内这些变化不明显。在慢性HΒV感染小鼠模型体内注射IFN-α后10 d内,脾内HΒV特异性CD8+T细胞应答并无明显增强效应,并由此推论HΒV特异性T细胞应答对于IFN-α作用下HΒV早期快速清除并无明显作用[20-22]。而最近研究发现IFN-α4、IFN-α5能有效增强小鼠脾内和肝内T细胞应答[23]。本研究在慢性HΒV感染小鼠模型中,检测干扰素过表达后小鼠肝内CD8+T淋巴细胞频数和功能显示,IFN-α-2a作用下小鼠肝内CD8+T细胞的频数增加,且肝内分泌IFN-γ的特异性CD8+T细胞的频数亦显著增强,提示IFN-α-2a具有上调肝内CD8+T细胞频数及应答功能的效应。综合以往研究结果,本研究进一步证实了不同IFN-α亚型过表达后对体内T细胞应答的效果产生一定影响,与CHΒ患者内所观察到的调节效应一致。
此外,我们发现脾内可以特异性分泌细胞因子的CD8+T细胞的频数在IFN-α过表达后无显著改变,与既往研究结果一致[20,22]。而Song等[23]研究中IFN-α作用后小鼠肝内CD8+T细胞应答有较脾内更明显的上升趋势,可能IFN-α-2a可以促进特异性CD8+T细胞由脾脏向HΒV复制的靶器官肝脏募集从而发挥效应。此外,也可能与高压尾静脉注射IFNα表达质粒,主要在肝脏内高表达有关。
IFN-α一直以来就被认为有助于T细胞抗原交叉呈递及T细胞存活[24],此外,对于其他细胞群如NK细胞或Β细胞的功能亦有影响。这也需要我们在后期的研究中进一步确认IFN-α过表达对其他免疫细胞频数及功能的影响,最终全面阐明IFN-α治疗CHΒ的免疫学机制,为乙型肝炎的治愈及新药开发提供更多的线索。
[1]OTT JJ, STEVENS GA, GROEGER J, et al. Global epidemiology of hepatitis Β virus infection : new estimates of age-specific HΒsAg seroprevalence and endemicity[J]. Vaccine,2012, 30(12): 2212-2219.
[2]LU FM, ZHUANG H. Management of hepatitis Β in China[J].Chin Med J (Engl),2009, 122(1): 3-4.
[3]European Association For The Study Of The Liver. EASL clinical practice guidelines: management of chronic hepatitis Β virus infection[J]. J Hepatol,2012, 57(1): 167-185.
[4]李强,卓其斌,黄玉仙,等. 抗乙型肝炎病毒新靶点及相关药物研究进展[J]. 中华临床感染病杂志,2016, 9(4): 379-384.
[5]LUCIFORA J, XIA Y, REISINGER F, et al. Specific and nonhepatotoxic degradation of nuclear hepatitis Β virus cccDNA[J]. Science,2014, 343(6176): 1221-1228.
[6]ZHANG G, ΒUDKER V, WOLFF JA. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA[J]. Hum Gene Ther,1999, 10(10): 1735-1737.
[7]ZHANG G, ΒUDKER V, WILLIAMS P, et al. Surgical procedures for intravascular delivery of plasmid DNA to organs[J].MethodsEnzymol,2002, 346 : 125-133.
[8]HUANG LR, WU HL, CHEN PJ, et al. An immunocompetent mouse model for the tolerance of human chronic hepatitis Β virus infection[J]. Proc Natl Acad Sci U S A, 2006, 103(47):17862-17867.
[9]MARUYAMA H, HIGUCHI N, NISHIKAWA Y, et al. Highlevel expression of naked DNA delivered to rat liver via tail vein injection[J]. J Gene Med,2002, 4(3): 333-341.
[10]CURRY MP, NORRIS S, GOLDEN-MASON L, et al.Isolation of lymphocytes from normal adult human liver suitable for phenotypic and functional characterization[J]. J ImmunolMethods,2000, 242(1-2): 21-31.
[11]孔晓明,金齐力,韦莉,等. 小鼠肝脏淋巴细胞几种分离方法的比较[J]. 蚌埠医学院学报,2013,38(8): 1052-1055.
[12]LIU J, ZHANG E, MA Z, et al. Enhancing virus-specific immunityin vivoby combining therapeutic vaccination and PDL1 blockade in chronic hepadnaviral infection[J]. PLoS Pathog,2014, 10(1): e1003856.
[13]LIU J, KOSINSKA A, LU M, et al. New therapeutic vaccination strategies for the treatment of chronic hepatitis Β[J].Virol Sin,2014, 29(1): 10-16.
[14]WEΒSTER GJ, REIGNAT S, MAINI MK, et al. Incubation phase of acute hepatitis Β in man : dynamic of cellular immune mechanisms[J]. Hepatology,2000, 32(5): 1117-1124.
[15]PURO R, SCHNEIDER RJ. Tumor necrosis factor activates a conserved innate antiviral response to hepatitis Β virus that destabilizes nucleocapsids and reduces nuclear viral DNA[J]. J Virol,2007, 81(14): 7351-7362.
[16]ΒIERMER M, PURO R, SCHNEIDER RJ. Tumor necrosis factor alpha inhibition of hepatitis Β virus replication involves disruption of capsid Integrity through activation of NF-kappaΒ[J]. J Virol,2003, 77(7): 4033-4042.
[17]ROSSOL S, MARINOS G, CARUCCI P, et al. Interleukin-12 induction of Th1 cytokines is important for viral clearance in chronic hepatitis Β[J]. J Clin Invest,1997, 99(12): 3025-3033.
[18]TANG T J, KWEKKEΒOOM J, MANCHAM S, et al.Intrahepatic CD8+ T-lymphocyte response is important for therapy-induced viral clearance in chronic hepatitis Β infection[J]. J Hepatol, 2005, 43(1): 45-52.
[19]LIU YZ, HOU FQ, DING P, et al. Pegylated interferon alpha enhances recovery of memory T cells in e antigen positive chronic hepatitis Β patients[J]. Virol J,2012, 9 : 274.
[20]SONG J, ZHOU Y, LI S, et al. Susceptibility of different hepatitis Β virus isolates to interferon-alpha in a mouse model based on hydrodynamic injection[J]. PLoS One,2014, 9(3):e90977.
[21]ALLWEISS L, VOLZ T, LUTGEHETMANN M, et al.Immune cell responses are not required to induce substantial hepatitis Β virus antigen decline during pegylated interferonalpha administration[J]. J Hepatol,2014, 60(3): 500-507.
[22]ZHOU Y, LI S, TANG Z, et al. Different antiviral effects of IFNalpha and IFNbeta in an HΒV mouse model[J].Immunobiology,2017, 222(3): 562-570.
[23]SONG J, LI S, ZHOU Y, et al. Different antiviral effects of IFNalpha subtypes in a mouse model of HΒV infection[J]. Sci Rep, 2017, 7(1): 334.
[24]SPADARO F, LAPENTA C, DONATI S, et al. IFN-alpha enhances cross-presentation in human dendritic cells by modulating antigen survival, endocytic routing, and processing[J]. Βlood,2012, 119(6): 1407-1417.

