肝硬化患者利奈唑胺相关血小板减少症的危险因素分析
蔡妙甜, 李侗曾, 段忠辉, 牟丹蕾, 梁连春
1 材料与方法
1.1 研究对象
采用回顾性研究方法,研究对象为2013年1月-2017年5月于北京佑安医院感染综合科住院并接受利奈唑胺治疗的肝硬化患者。
纳入标准:微生物学检查确诊为革兰阳性球菌感染或高度怀疑敏感菌感染但存在万古霉素使用禁忌(如过敏、严重肾功能损害)或万古霉素治疗失败、接受至少1次利奈唑胺片剂(Pfizer Pharmaceuticals LLC,600 mg/片)或注射液(Fresenius Kabi Norge AS,600 mg/300 mL)治疗(600 mg每12小时1次)的肝硬化患者,包括:乙肝或丙肝肝硬化、酒精性肝硬化及隐源性肝硬化,可合并原发性肝癌。
排除标准:①年龄<14岁;②缺乏利奈唑胺治疗后实验室指标复查结果;③存在自身免疫性疾病(如系统性红斑狼疮、干燥综合征、自身免疫性肝炎/肝硬化等)、血液系统疾病(如特发性血小板减少性紫癜、再生障碍性贫血、骨髓增生异常综合征、白血病、淋巴瘤等)、甲状腺疾病、肝转移癌、肝脏移植或肝切除术后、获得性免疫缺陷综合征等;④2周内接受过甲氧苄啶-磺胺甲唑、更昔洛韦、阿司匹林、干扰素、利福平等药物治疗。
1.2 数据采集
通过医院电子病历系统对患者资料进行收集整理,采集的数据包括:①利奈唑胺治疗前24 h内(T0)的各基线实验室指标[血小板(PLT)、白细胞(WΒC)、红细胞(RΒC)、血红蛋白(HGΒ)、C反应蛋白(CRP)、降钙素原(PCT)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、白蛋白(ALΒ)、尿素氮(ΒUN)、肌酐(Cr)及内生肌酐清除率(Ccr)(根据Cockcroft-Gault公式计算)];②利奈唑胺治疗开始2 d内PLT计数最低值对应治疗日记为T1,治疗第3~5天内PLT计数最低值对应治疗日记为T2,治疗第6~9天内PLT计数最低值对应治疗日记为T3,疗程≥10 d者停药日±1 d内PLT计数最低值对应治疗日记为T4,记录上述时间点PLT、WΒC、RΒC、HGΒ和CRP等指标;③以T1至T4中PLT计数最低值所对应治疗日记为Tnadir,该点数据用于计算利奈唑胺相关TP累积发生率;④患者年龄、性别、体重、住院日、是否ICU患者、微生物检查、利奈唑胺疗程及剂量、联合美罗培南治疗、脏器出血、输注PLT和/或促PLT生成药物[重组人白介素11(rh-IL11)或重组人促血小板生成素(rh-TPO)]、持续肾脏替代治疗(CRRT)、院内死亡等情况。
1.3 利奈唑胺相关TP的定义
利奈唑胺相关TP定义为利奈唑胺治疗期间PLT计数≤50×109/L且较基线值减少≥25%;其中,PLT计数较基线值减少≥50%定义为严重TP。
1.4 统计方法
数据统计采用IΒM SPSS Statistics v22.0进行,计量资料以均数±标准误(x±SE)表示,正态分布且方差齐性资料组间比较采用t检验,非正态分布或方差不齐资料组间比较采用Mann-WhitneyU检验,组内比较采用配对样本Wilcoxon秩和检验;计数资料比较采用χ2检验或Fisher精确检验;单因素和多因素逐步Logistic回归分析危险因素,单因素回归P<0.1的危险因素进入多因素逐步回归。Kaplan- Meier生存分析及Log-rank检验用于组间生存曲线对比,Cox回归模型用于分析患者预后的危险因素。P<0.05为差异具有统计学意义。
2 结果
2.1 基本情况
2013年1月-2017年5月于我科接受利奈唑胺治疗的住院患者共计167例,根据纳入及排除标准最终纳入52例(表1)。52例患者按肝病类型分组,各组年龄、体重、住院日、利奈唑胺剂量及疗程、各基线实验室指标间差异均无统计学意义(P>0.05)。
2.2 TP发生情况
2.2.1 研究对象整体 52例患者基线PLT计数平均为(100.06±8.28)×109/L,范围(21~281)×109/L,最低PLT计数平均为(57.52±6.53)×109/ L,范围(6~191)×109/ L,较基线平均减少(39.1±5.9)%,两者差异显著(P<0.001)(图1),Tnadir平均为利奈唑胺治疗第(7.06±0.62)d。TP累积发生率为51.9%(27/52),其中严重TP比例为85.2%(23/27)。TP组与非TP组各指标对比见表2。肝硬化患者T1至T4各点TP发生率分别为9.6%(5/52)、21.3%(10/47)、41.7%(15/36)、76.5%(13/17),除T1、T2点 TP发生率差异无统计学意义外(P> 0.05),其余时间点TP发生率两两对比差异均有统计学意义(P<0.05)。
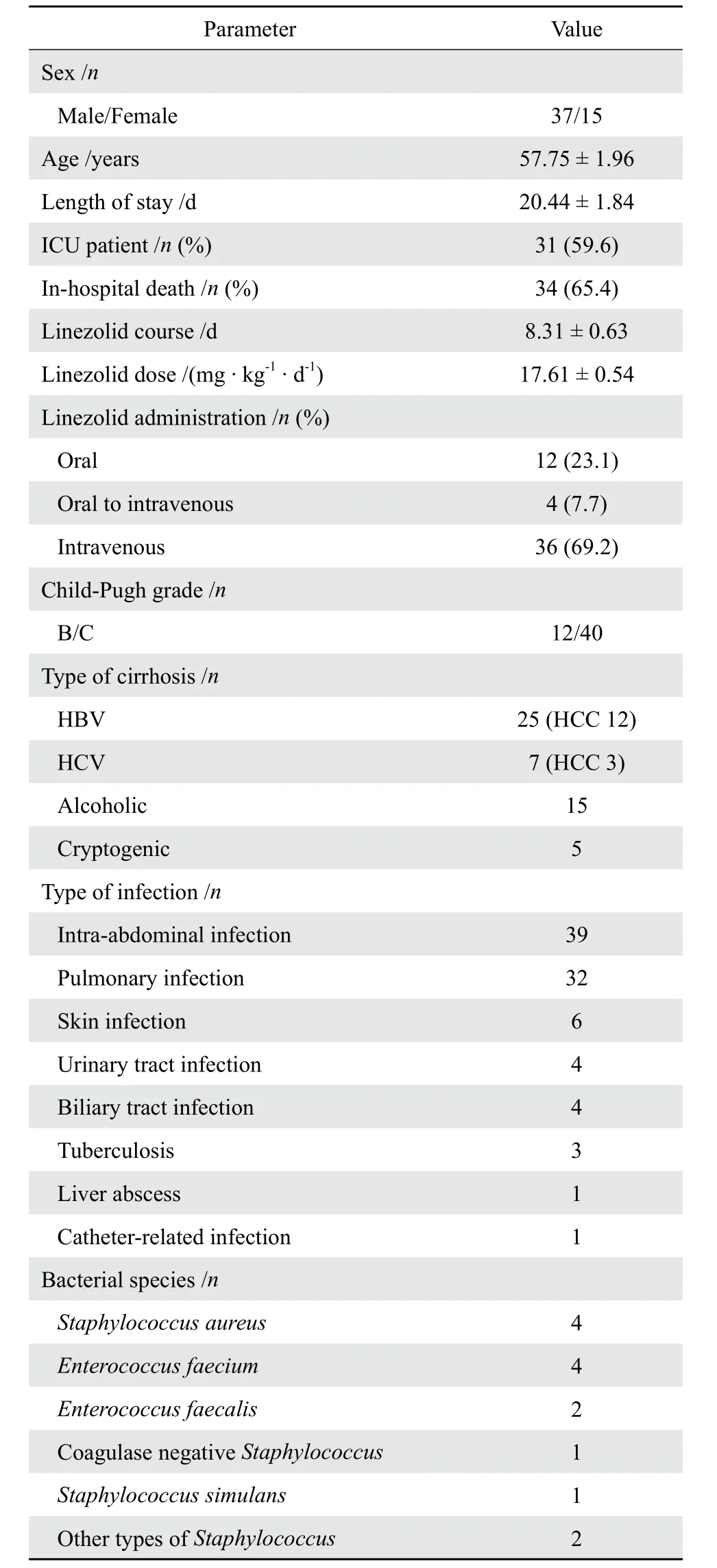
表1 肝硬化患者基本情况Table 1 Demographic characteristics of patients with liver cirrhosis
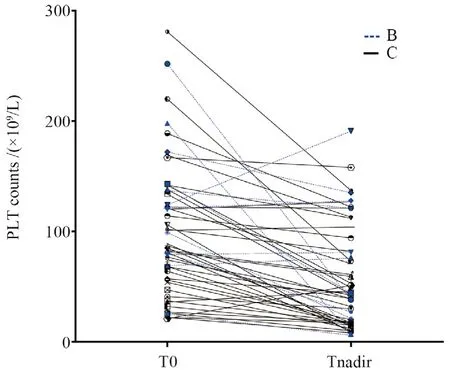
图1 基线血小板计数(T0)及最低血小板计数(Tnadir)Figure 1 The baseline platelet count at initiation of linezolid therapy (T0) and the lowest platelet count during linezolid therapy (Tnadir)
2.2.2 Child-Pugh Β级患者 该组基线及最低PLT计数间差异无统计学意义(P=0.050);TP累积发生率为50.0%(6/12),全部为严重TP(6/6)。PLT计数随用药时间延长呈下降趋势,但T1至T4各点与T0点PLT计数相比差异均无统计学意义(P≥0.05)。T1、T2与T4对比TP发生率差异存在统计学意义(P<0.05)。见表3。
2.2.3 Child-Pugh C级患者 该组基线及最低PLT计数间差异有统计学意义(P<0.001);TP累积发生率为52.5%(21/40),其中严重TP占81.0%(17/21)。随利奈唑胺用药时间延长,PLT计数下降趋势明显,除T1与T0点PLT计数差异无统计学意义(P>0.05)外,T2至T4各点与T0点PLT计数相比差异均有统计学意义(P<0.05)。除T1、T2间TP发生率相近外(P>0.05),其余时间点TP发生率两两对比差异均有统计学意义(P<0.005)。见表3。
2.2.4 Child-Pugh Β、C级患者组间对比 除T1点PLT计数Β组略高于C组(P=0.049)外,其他各时间点PLT计数组间差异无统计学意义(P> 0.05)。两组TP累积发生率及相同时间点TP发生率差异无统计学意义(P>0.05)。见表3。
2.3 TP相关危险因素
单因素Logistic回归分析显示,基线PLT计数≤110×109/L、利奈唑胺疗程≥7 d、剂量≥17 mg·kg-1·d-1、合并酒精性肝硬化及体重≥70 kg与利奈唑胺相关TP的发生有关;多因素逐步Logistic回归分析显示,基线PLT计数≤110×109/ L、利奈唑胺疗程≥7 d及剂量≥17 mg·kg-1·d-1为利奈唑胺相关TP的独立危险因素。见表4。
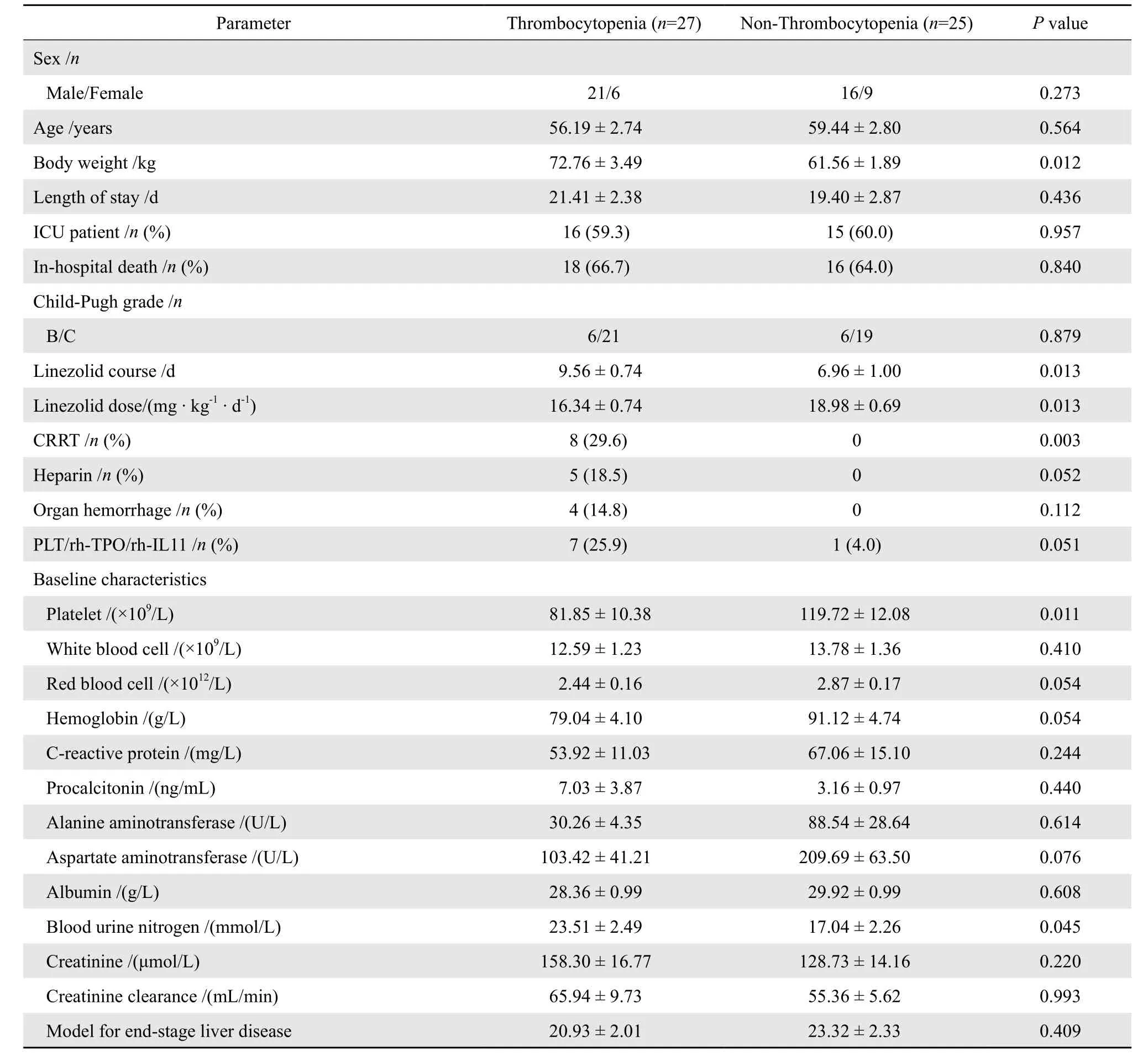
表2 利奈唑胺相关血小板减少症发生组与未发生组患者的指标对比Table 2 Characteristics of patients with and without linezolid-related thrombocytopenia
2.4 利奈唑胺相关TP与肝硬化患者脏器出血及院内病死率间的关系
单因素及多因素逐步Logistic回归分析提示肝硬化患者利奈唑胺治疗期间脏器出血的发生与利奈唑胺相关TP无明显相关性(P>0.05);前者的独立危险因素是CRRT治疗(OR=25.800,95%CI:2.237~297.582,P=0.009)。
Kaplan-Meier生存分析发现利奈唑胺相关TP发生组与未发生组自利奈唑胺治疗首日至院内死亡的中位时间分别为18 d与13 d,但两组生存曲线差异无统计学意义(P>0.05)(图2)。Cox回归模型分析提示肝硬化患者院内病死率与利奈唑胺相关TP及TP严重程度无关(P>0.05)。
3 讨论
TP是利奈唑胺最常见的血液系统不良反应之一。临床试验报告利奈唑胺相关TP发生率约为2.4%[2],而临床实际发生率远高于临床试验结果[3-7],且根据研究设计、对TP的定义、样本量大小、患者疾病谱等不同,所得结果也存在较大差异。以往研究多以利奈唑胺治疗后PLT计数<100×109/L且较基线值减少≥25%定义利奈唑胺相关TP[7-8],本研究考虑到肝硬化患者本身可存在TP的特点,规定利奈唑胺相关TP需满足PLT计数≤50×109/L且较基线值减少≥25%。
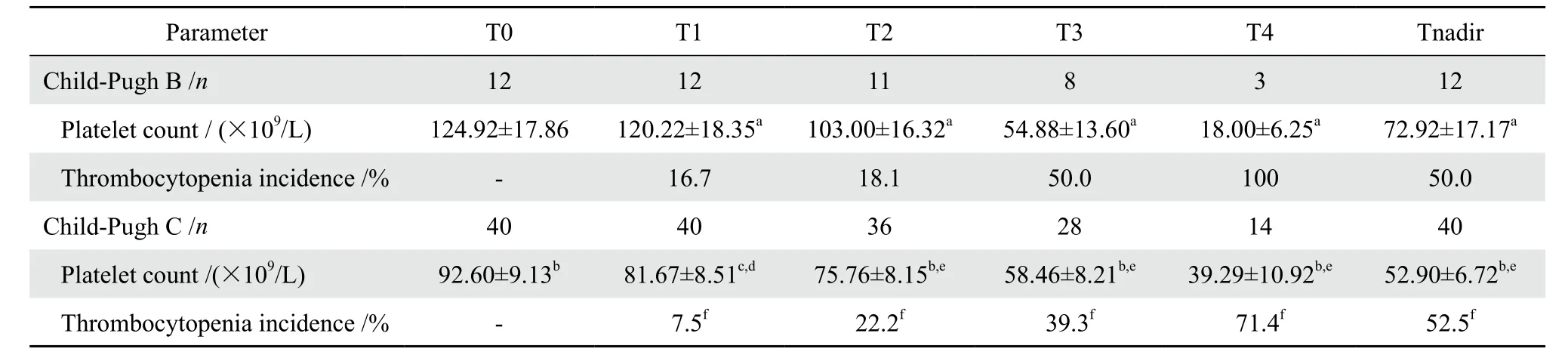
表3 不同Child-Pugh分级肝硬化患者利奈唑胺治疗各时间点血小板计数及利奈唑胺相关血小板减少症发生率的变化Table 3 Platelet count and incidence of linezolid-related thrombocytopenia at different time point of linezolid therapy in patients with liver cirrhosis
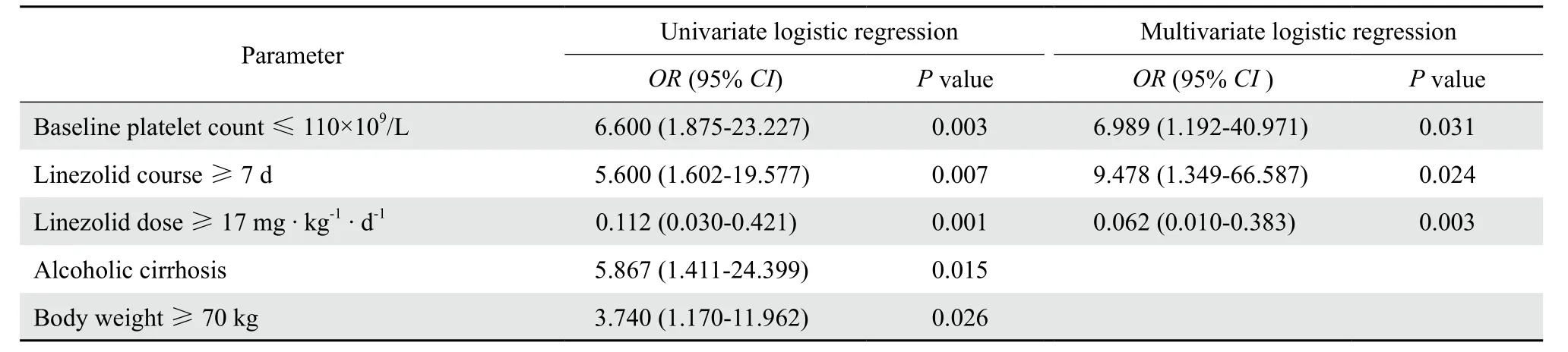
表4 肝硬化患者利奈唑胺相关血小板减少症的单因素和多因素逐步Logistic回归分析Table 4 Univariate and multivariate stepwise logistic regression analysis of linezolid-related thrombocytopenia in patients with liver cirrhosis
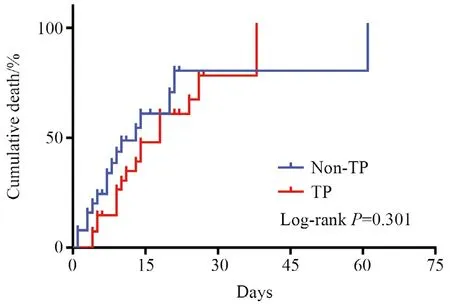
图2 利奈唑胺相关血小板减少症发生组与未发生组的Kaplan-Meier生存曲线Figure 2 Kaplan-Meier curves of the time to in-hospital death after initiation of linezolid therapy
目前关于利奈唑胺对慢性肝病患者PLT影响的研究相对较少。Gonzalez-Del等[5]报道轻微肝病患者利奈唑胺相关TP发生率约为26.5%(9/34),Ikuta等[6]统计11例慢性肝炎及肝硬化患者的利奈唑胺相关TP发生率为90.1%,而Zhang等[7]报道慢加急性肝衰竭患者这一比例为57.1%(20/35)。本研究中肝硬化患者利奈唑胺相关TP发生率为51.9%,结果与以往研究一致。Zhang等[7]的研究还发现,慢加急性肝衰竭患者利奈唑胺治疗后TP发生率明显高于非利奈唑胺治疗的慢加急性肝衰竭患者及利奈唑胺治疗的非慢加急性肝衰竭患者,说明严重肝病患者利奈唑胺治疗后TP的发生及加剧受药物及疾病两方面共同影响。
TP是肝硬化患者常见的临床表现,主要原因包括:脾功能亢进使PLT破坏增多、获得性PLT贮存池病导致PLT耗竭、PLT相关免疫球蛋白水平升高使PLT破坏增加、肝炎病毒可抑制骨髓巨核细胞系、TPO减少使PLT生成减少等。利奈唑胺可能与以上因素协同作用,使严重肝病患者PLT进一步减少。然而,利奈唑胺导致TP的机制目前尚不明确,部分学者认为与骨髓抑制有关[2]。通过干细胞模型研究发现,利奈唑胺可减少PLT前体细胞生成[9],Sasaki等[10]也报道了类似结果。Tsuji等[11]也认为利奈唑胺导致TP的主要原因是抑制PLT增殖而非促进其破坏。但是,Βernstein等[12]对利奈唑胺治疗后发生TP的患者进行骨髓活检发现巨核细胞数量充足,且免疫球蛋白治疗有利于减缓TP的进展,故推测其机制可能与免疫介导相关。Nishijo等[13]证实利奈唑胺治疗28 d的慢性肾衰竭小鼠的骨髓改变与溶媒对照小鼠相似,也不支持TP与利奈唑胺导致骨髓抑制有关的论点。
研究报道利奈唑胺相关TP的危险因素主要包括:基线PLT计数[5,7-8,14-15]、肾功能不全[3-5,14]、透析治疗[3]、肝脏疾病[5-7]、利奈唑胺疗程[3-4,10,16]、剂量[10,17]、体重[8,17-18]等。与以往报道相似,本研究证实肝硬化患者利奈唑胺相关TP的发生与基线PLT计数(≤110×109/L)、利奈唑胺疗程(≥7 d)及剂量(≥17 mg·kg-1·d-1)独立相关。
已有多个研究证实基线PLT计数与利奈唑胺相关TP有关,例如,Gonzalez-Del等[5]提出基线PLT计数≤90×109/L的患者发生利奈唑胺相关TP的风险较大(OR=7.635,95%CI:3.672~15.878,P<0.001);该研究将基线PLT计数、肾功能不全、中重度肝病、脑血管病等指标建立利奈唑胺相关TP风险预测模型,其中以基线PLT计数所占权重最大。Niwa等[8]得出基线PLT计数<200×109/ L(OR=24.9,95%CI:1.53~404.7,P=0.024)时发生利奈唑胺相关TP的风险明显升高;Zhang等[7]也指出基线PLT计数越高,发生利奈唑胺相关TP的风险越小(OR=0.985,P=0.036)。
以往认为利奈唑胺通过酶促或非酶促等多种方式代谢,肾脏途径清除率仅占整体清除率的30%[19],故肝肾功能不全的患者无需调整利奈唑胺剂量[1,19]。然而,研究发现严重肝肾疾病可显著影响利奈唑胺的药动学,使患者体内药物浓度存在明显的个体差异,并影响药物不良反应的发生。据报道,肝移植或肝切除术后患者的利奈唑胺清除率可下降60%[20]。Sasaki等[10]则发现Child-Pugh C级肝硬化患者的利奈唑胺清除率减少近50%,进而导致血药浓度升高,并认为这可能与肝硬化时肝小叶结构破坏、酶表达异常、肝血供减少等病理改变影响了利奈唑胺主要代谢产物PNU-142586在肝脏微粒体内的非酶途径代谢过程(如活化氧自由基ROS)有关。Ccr<60 mL/min时利奈唑胺血药浓度明显升高,而Ccr较低、血药浓度较高(> 7.5 mg/L)的患者更易发生TP[4]。Ccr≤30 mL/min或Child-Pugh C级肝硬化患者经常规剂量(600 mg每12小时1次)利奈唑胺治疗14 d时TP发生率明显升高;减少利奈唑胺剂量(600 mg每日1次)可降低肾病患者的TP发生率,但于严重肝病患者无益[10]。
本研究中肝硬化患者的利奈唑胺相关TP发生率高,但Child-Pugh分级、MELD评分及常规肝功能指标(ALT、AST、ALΒ等)对于相关风险预测均无意义。这一结果可能与研究对象病情普遍较重有关,同时也提示有必要寻找其他敏感指标评价肝功能与利奈唑胺相关TP的关系。Ikuda等[6]通过测定ICG-R15(吲哚菁绿15 min滞留率)发现肝脏代谢能力较差的患者更易在利奈唑胺治疗后发生TP,虽然后者与肝纤维化严重程度无关。通过最大肝功能容积检测(maximal liver function capacity,LiMAx)发现肝功能受损越严重,利奈唑胺血药谷浓度越高,即利奈唑胺清除率下降,其后果则是PLT计数减少[21]。
本研究提示肝硬化患者利奈唑胺用药2 d内TP发生率已达9.6%,随治疗日增加,TP发生率逐渐升高。一般认为,利奈唑胺相关TP多在用药超过14 d时出现,且停药后可恢复正常[1,16]。Βoak等[9]也指出,利奈唑胺治疗5~7 d与治疗10~28 d的患者相比,前者TP风险较小。但Hanai等[3]发现利奈唑胺治疗7 d内与治疗8~14 d内的TP发生率相近(42.1%对 41.1%)。Tsuji等[11]则认为,利奈唑胺相关TP的发生时间与其机制有关,早期(治疗3~7 d内)发生TP可能与免疫介导的PLT破坏增加有关,而后期发生TP可能与非免疫介导的PLT生成下调有关。
需要注意的是,本研究中利奈唑胺治疗期间4例脏器出血(均为消化道出血,包括粪便潜血阳性)患者均属TP组,但进一步分析发现,本研究中脏器出血的独立危险因素是CRRT治疗,而非利奈唑胺相关TP。另外,Cox回归分析证实利奈唑胺相关TP并非肝硬化患者院内死亡的危险因素,说明利奈唑胺虽加剧肝硬化患者的TP病情,但可能较少直接导致脏器出血等严重后果,利奈唑胺相关TP的发生也并未加大肝硬化患者院内死亡风险。
本研究主要局限在于:①属回顾性研究;②纳入有效样本量较少;③未能进行利奈唑胺血药浓度监测;④缺乏骨髓细胞学及免疫相关指标检测。未来研究应着力于改进以上不足以减少混杂因素干扰及更准确深入地阐述利奈唑胺对肝硬化患者PLT的影响。
总之,肝硬化患者利奈唑胺相关TP发生率较高,尤其对于基线PLT计数较低、利奈唑胺疗程较长的患者应加强PLT等指标的监测;相较于常规肝功能指标,进行血药浓度监测或能更好反映肝脏代谢能力的指标来评价肝功能,可能更有助于预测利奈唑胺治疗严重肝病患者时发生TP的风险,有助于及时调整药物剂量并减少严重药物不良反应的发生。
[1]DIEKEMA DJ,JONES RN. Oxazolidinone antibiotics[J].Lancet,2001,358(9297):1975-1982.
[2]RUΒINSTEIN E,ISTURIZ R,STANDIFORD HC,et al. Worldwide assessment of linezolid's clinical safety and tolerability: comparator-controlled phase III studies[J].Antimicrob Agents Chemother,2003,47(6):1824-1831.
[3]HANAI Y,MATSUO K,OGAWA M,et al. A retrospective study of the risk factors for linezolid-induced thrombocytopenia and anemia[J]. J Infect Chemother,2016,22(8):536-542.
[4]NUKUI Y,HATAKEYAMA S,OKAMOTO K,et al. High plasma linezolid concentration and impaired renal function affect development of linezolid-induced thrombocytopenia[J]. J Antimicrob Chemother,2013,68(9):2128-2133.
[5]GONZALEZ-DEL CASTILLO J,CANDEL FJ,Manzano-Lorenzo R,et al. Predictive score of haematological toxicity in patients treated with linezolid[J]. Eur J Clin Microbiol Infect Dis,2017,36(8):1511-1517.
[6]IKUTA S,TANIMURA K,YASUI C,et al. Chronic liver disease increases the risk of linezolid-related thrombocytopenia in methicillinresistantStaphylococcus aureus-infected patients after digestive surgery[J]. J Infect Chemother,2011,17(3):388-391.
[7]ZHANG YM,YU W,ZHOU N,et al. High frequency of thrombocytopenia in patients with acute-on-chronic liver failure treated with linezolid[J]. Hepatobiliary Pancreat Dis Int,2015,14(3):287-292.
[8]NIWA T,WATANAΒE T,SUZUKI A,et al. Reduction of linezolid-associated thrombocytopenia by the dose adjustment based on the risk factors such as basal platelet count and body weight[J]. Diagn Microbiol Infect Dis,2014,79(1):93-97.
[9]ΒOAK LM,RAYNER CR,GRAYSON ML,et al. Clinical population pharmacokinetics and toxicodynamics of linezolid[J].Antimicrob Agents Chemother,2014,58(4):2334-2343.
[10]SASAKI T,TAKANE H,OGAWA K,et al. Population pharmacokinetic and pharmacodynamic analysis of linezolid and a hematologic side effect,thrombocytopenia,in Japanese patients[J]. Antimicrob Agents Chemother,2011,55(5):1867-1873.
[11]TSUJI Y,HOLFORD NHG,KASAI H,et al. Population pharmacokinetics and pharmacodynamics of linezolidinduced thrombocytopenia in hospitalized patients[J]. Βr J Clin Pharmacol,2017,83(8):1758-1772.
[12]ΒERNSTEIN WΒ,TROTTA RF,RECTOR JT,et al.Mechanisms for linezolid-induced anemia and thrombocytopenia[J].Ann Pharmacother,2003,37(4):517-520.
[13]NISHIJO N,TSUJI Y,MATSUNAGA K,et al. Mechanism underlying linezolid-induced thrombocytopenia in a chronic kidney failure mouse model[J]. J Pharmacol Pharmacother,2017,8(1):8-13.
[14]李佳,范玉华,廖丽雯,等. 成人危重症患者利奈唑胺相关性血小板减少的危险因素分析[J]. 中国医院药学杂志,2016,(9):743-747.
[15]郭代红,陈超,李罄,等. 6所医院414例利奈唑胺相关性血小板减少集中监测研究[J]. 药物流行病学杂志,2013,22(3):109-113.
[16]GERSON SL,KAPLAN SL,ΒRUSS JΒ,et al. Hematologic effects of linezolid: summary of clinical experience[J].Antimicrob Agents Chemother,2002,46(8):2723-2726.
[17]NIWA T,SUZUKI A,SAKAKIΒARA S,et al. Retrospective cohort chart review study of factors associated with the development of thrombocytopenia in adult Japanese patients who received intravenous linezolid therapy[J]. Clin Ther,2009,31(10):2126-2133.
[18]DONG HY,XIE J,CHEN LH,et al. Therapeutic drug monitoring and receiver operating characteristic curve prediction may reduce the development of linezolid-associated thrombocytopenia in critically ill patients[J]. Eur J Clin Microbiol Infect Dis,2014,33(6):1029-1035.
[19]MACGOWAN AP. Pharmacokinetic and pharmacodynamic profile of linezolid in healthy volunteers and patients with Grampositive infections[J]. J Antimicrob Chemother,2003,51 Suppl 2:ii17-25.
[20]SWOΒODA S,OΒER MC,LICHTENSTERN C,et al.Pharmacokinetics of linezolid in septic patients with and without extended dialysis[J]. Eur J Clin Pharmacol,2010,66(3):291-298.
[21]WICHA SG,FREY OR,ROEHR AC,et al. Linezolid in liver failure: exploring the value of the maximal liver function capacity (LiMAx) test in a pharmacokinetic pilot study[J]. Int J Antimicrob Agents,2017,50(4):557-563.

