碳青霉烯类耐药肺炎克雷伯菌血流感染的临床特征与死亡危险因素分析
杨修文, 崔俊昌, 赵 进, 倪文涛
肺炎克雷伯菌是人体呼吸道和肠道重要的条件致病菌,可引起机体多个部位感染。碳青霉烯类药物是治疗肺炎克雷伯菌感染的强效β内酰胺类药物[1],一旦对碳青霉烯类药物耐药,临床治疗此类菌株感染将面临极大困难。该耐药菌对目前常用的抗生素几乎都表现为耐药,使其所致感染病死率高。美国CDC细菌耐药威胁报告中将其列为最高级别“紧急威胁”,我国与全球各国都面临该耐药菌的挑战,它已成为一个极其重要的公共卫生安全问题。为了解碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistantK.pneumoniae,CRKP)血流感染情况,本研究对解放军总医院近5年来60例CRKP血流感染患者进行回顾性分析,探讨患者的死亡危险因素及抗菌治疗方案的选择对患者预后的影响。
1 材料与方法
1.1 研究对象
连续收集我院2011年6月-2016年8月鉴定为CRKP血流感染患者60例。病例纳入标准:年龄≥18岁,入院48 h后抽取的血样标本血培养阳性,至少1次血培养肺炎克雷伯菌阳性,并达到血流感染诊断标准。若患者多次血培养阳性,则取第1次阳性时资料。本研究根据血流感染28 d预后将CRKP血流感染患者分为存活组(36例)和死亡组(24例),比较两组患者之间的差异,分析CRKP血流感染的死亡预测因素;将其中46例接受抗菌治疗方案的CRKP血流感染患者分为联合用药组(32例)与单药组(14例),比较两组患者之间的差异,初步探讨抗菌药物治疗方案的选择对患者预后的影响。
1.2 方法
1.2.1 收集资料 收集患者的人口学资料[包括年龄、性别、体质量指数(ΒMI)、入住科室],总住院天数,血流感染时间,血流感染前住院天数,合并的基础疾病(糖尿病、高血压、急慢性心功能不全、呼吸系统疾病、慢性肾功能不全、实质脏器肿瘤、血液系统肿瘤、慢性肝功能不全、脑血管疾病、急性胰腺炎、造血干细胞移植),抗菌药物的暴露(抗菌药物暴露定义为发病前2周内使用该抗菌药物时间超过5 d),过去30 d糖皮质激素及免疫抑制剂应用(糖皮质激素的使用定义为泼尼松龙≥20 mg/d,时间超过5 d),过去3 d侵袭性操作(胃镜、逆行胰胆管造影、支气管镜、有创机械通气、血液透析、中心静脉导管留置、尿管留置、胃管留置、胸腔置管、腹腔置管),过去30 d的手术史、化疗与放疗,过去1年住院情况,发病时急性生理与慢性健康Ⅱ(APACHE Ⅱ)评分,发病时临床表现及实验室指标(白细胞、C反应蛋白、降钙素原、血清白蛋白),合并其他微生物血流感染阳性情况,血流感染的可能来源,细菌耐药性,抗菌药物治疗方案。
1.2.2 相关定义 血流感染诊断标准采用我国2001年卫生部医院感染诊断标准(试行),体温>38 ℃或<36 ℃,可伴有寒战,合并下列情况之一:①有入侵门户或者迁移病灶;②有全身中毒症状而无明显感染灶;③有皮疹或出血点、肝脾肿大、血液中性粒细胞增多伴有核左移,且无其他原因可解释;④收缩压<90 mmHg或较原收缩压下降40 mmHg;⑤血培养分离出病原微生物或血液中检测到病原体的抗原物质[2]。血流感染时间定义为最早送检血样标本血培养阳性的时间。原发性血流感染定义为患者在诊断血流感染时未寻找到明确血流感染的来源;继发性血流感染是指血流感染发生时存在其他部位感染的证据,且血培养分离出的病原体为其相应感染部位常见的致病菌,认为此次血流感染继发于相应感染部位病原体播散入血[3];导管相关性血流感染指留置血管内装置的患者出现菌血症,经外周静脉抽取血液培养至少1次结果阳性,同时伴有感染的临床表现[4]。脓毒性休克定义为患者多脏器功能衰竭且经积极液体复苏后仍有顽固性低血压[5]。APACHE Ⅱ评分用于评估患者在血流感染时病情危重程度。合理的经验性抗菌治疗定义为血流感染48 h内使用至少1种对肺炎克雷伯菌具有体外抗菌活性的药物;抗菌药物治疗定义为在得到体外抗菌结果后使用对革兰阴性杆菌有活性的抗菌药物,无论该抗菌药物是否符合体外药敏试验结果;联合治疗定义为在得到体外药敏结果后48 h内使用2种或以上对革兰阴性杆菌有活性的抗菌药物,无论该药物是否符合体外药敏试验结果;所有治疗方案中抗菌药物的使用时间均需大于48 h。
1.2.3 细菌鉴定及药物敏感试验 采用ΒacT/A-lbert3D全自动血培养仪对血标本进行培养,经VITEK 2-Compact(法国生物梅里埃公司)全自动细菌分析仪对菌种进行鉴定。药敏试验采用琼脂稀释法,药敏结果判断符合美国临床与实验室标准化协会(CLSI)标准。
1.2.4 统计学方法 统一记录原始数据,以SPSS16.0软件进行分析,符合正态分布的连续变量以±s表示,采用t检验;非正态分布数据采用两独立样本秩和检验;计数资料的比较采用χ2检验或Fisher确切概率法比较组间差异;对APACHEⅡ评分进行受试者工作特征(ROC)曲线分析,寻找最佳截断点;单因素分析中P<0.05的变量纳入多元Logistic回归分析,计算死亡危险因素的P值、优势比(OR)、95%CI。P<0.05为差异有统计学意义。
2 结果
2.1 CRKP血流感染患者的临床特点
60例CRKP血流感染患者从住院到发生血流感染的平均天数为41 d,发生血流感染时均有不同程度发热,其中体温≥40 ℃有5例(8.3%),39~40 ℃有25例(41.7%),38~39 ℃有30例(50.0%)。其他伴随症状包括畏寒、寒战,意识改变。13例(21.7%)患者在血流感染同时发生感染性休克。发生血流感染时患者血白细胞总数(0.2~37)×109/L,降钙素原0.07~100 μg/L,其中白细胞>14×109/L患者占38.3%(23/60),<4×109/L患者占8.3%(5/60)。CRKP血流感染同时合并的其他病原菌有:鲍曼不动杆菌、铜绿假单胞菌各5例,屎肠球菌、白念珠菌、大肠埃希菌各4例,金黄色葡萄球菌、粪肠球菌、阴沟肠杆菌、洋葱伯克霍尔德菌、奇异变形杆菌、光滑念珠菌、近平滑念珠菌各1例。继发性下呼吸道感染14例,继发腹腔及胆道系统感染15例,继发尿路感染1例,继发盆腔感染1例,导管相关性感染10例,原发性血流感染19例。
2.2 CRKP血流感染的死亡危险因素分析
本研究共纳入CRKP血流感染患者60例,以血流感染诊断后28 d为观察终点,结果显示24例死亡,36例存活,CRKP血流感染患者28 d病死率为40.0%,血流感染发生到死亡的时间平均8.5 d。两组患者在年龄、性别、总住院天数、血流感染前住院天数等方面的差异无统计学意义;单因素分析结果显示,偏低的ΒMI、高APACHEⅡ评分、合并呼吸系统疾病以及感染性休克是CRKP血流感染患者死亡的危险因素,且存活组中原发性血流感染的患者显著高于死亡组,结果见表1。多因素回归分析结果提示高APACHE Ⅱ评分(OR=1.15,95%CI为1.0~1.3,P=0.048)为CRKP血流感染患者28 d死亡独立危险因素。以APACHE Ⅱ评分≥16.5分为分界值,ROC曲线下面积0.848,差异有统计学意义(P<0.001);敏感度75.0%,特异度80.6%,结果见图1。经统计,死亡组中有18例(75.0%)患者APACHEⅡ评分≥16.5分,存活组7例(19.4%)患者APACHE Ⅱ评分≥16.5分。
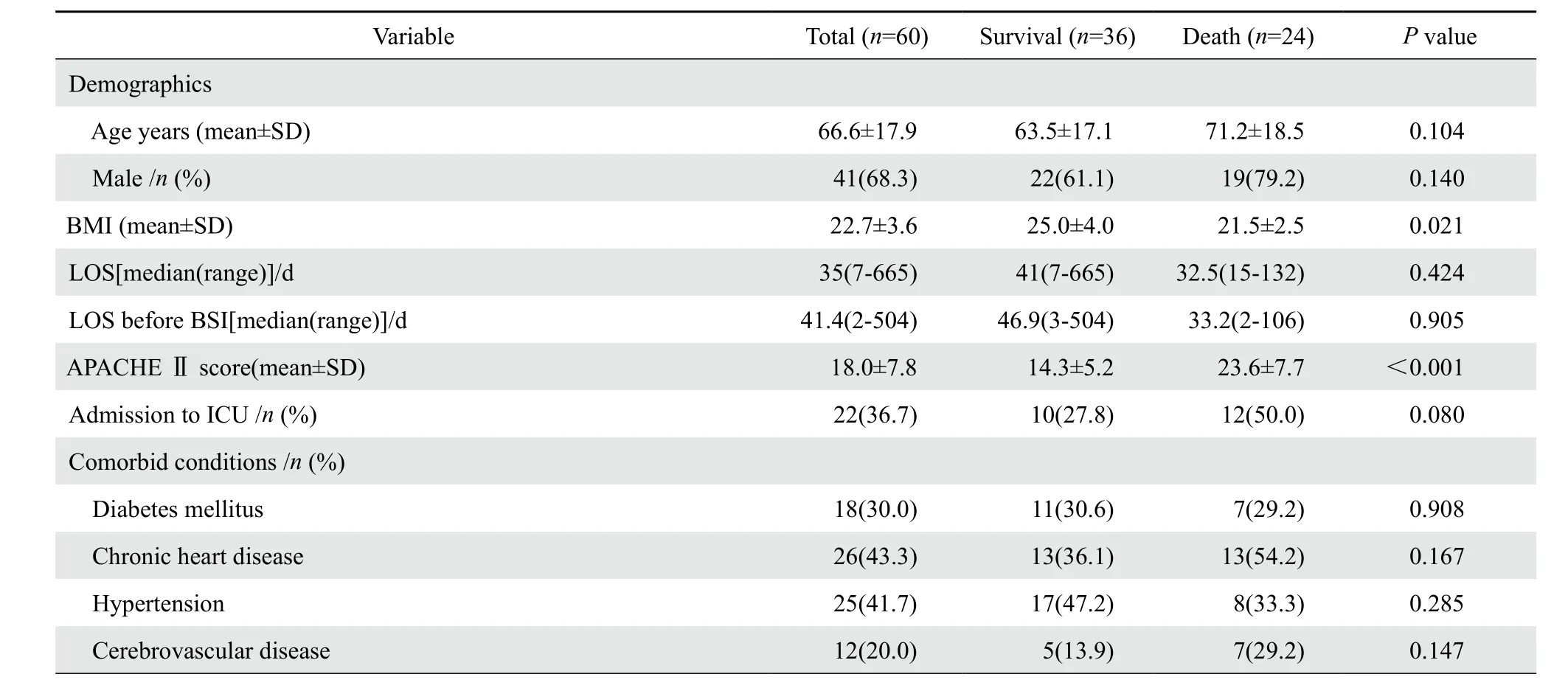
表1 CRKP血流感染死亡危险因素(单因素)分析Table 1 Univariate analysis of the risk factors for mortality in patients with carbapenem-resistant Klebsiella pneumoniae bloodstream infection
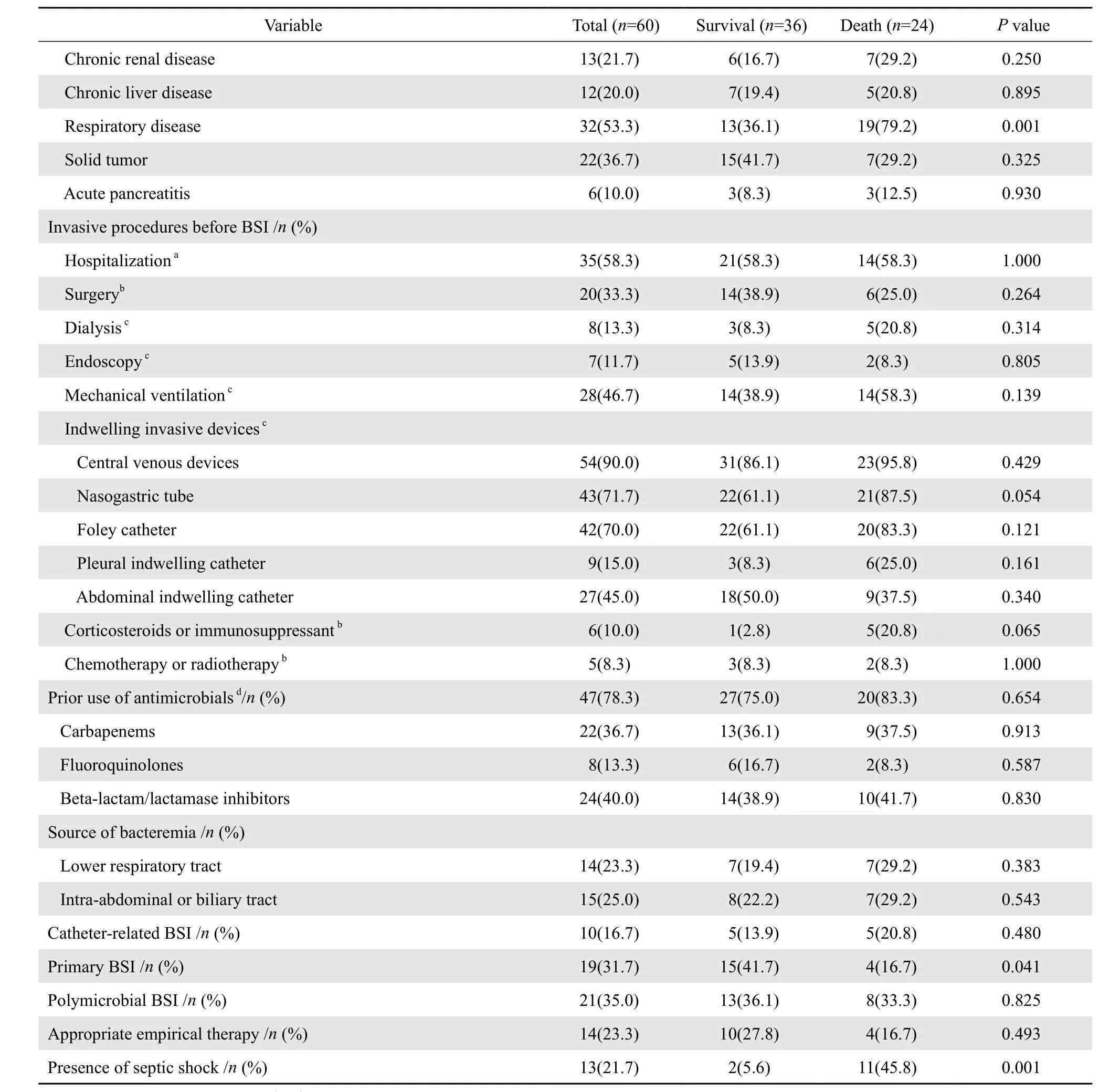
表1(续)Table 1(continued)
2.3 抗菌药物的治疗
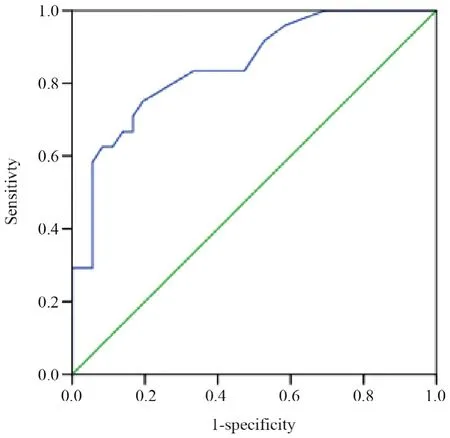
图1 APACHE Ⅱ评分≥16.5分预测血流感染患者死亡的ROC曲线Figure 1 The receiver operating characteristic curve of APACHE II score ≥16.5 in predicting death of patients with carbapenem-resistant Klebsiella pneumoniae bloodstream infection
60例CRKP血流感染患者中,14例患者在药敏结果报告前出院、死亡或抗菌药物使用时间小于48 h,对46例接受抗菌治疗方案的CRKP血流感染患者进行分组分析,28 d病死率为34.8%,其中联合用药组32例,28 d病死率为34.4%(11/32),单药组14例,28 d病死率为35.7%(5/14)。经单因素分析,两组患者在性别、年龄、入住ICU、APACHE Ⅱ评分和28 d病死率等方面的差异均无统计学意义,见表2。接受联合用药的32例患者中,20例接受二联抗菌治疗方案,11例接受三联抗菌治疗方案,1例接受四联抗菌治疗方案;接受替加环素联合其他药物治疗方案的患者13例,其中2例患者接受替加环素维持剂量为100 mg每12小时1次,均存活,余11例患者接受替加环素的维持剂量均为50 mg每12小时1次,结果6例存活,5例死亡;以碳青霉烯类药物(23例)为基础的联合用药是本研究中最常见的联合用药方案,病死率为30.4%,具体用药方案见表3。同时,14例患者接受了单药治疗,其中10例为碳青霉烯类药物,余4例分别接受了头孢他啶-他唑巴坦、头孢哌酮-舒巴坦、庆大霉素、阿米卡星。
本研究对以碳青霉烯类药物为基础的联合用药患者进行了亚胺培南MIC值分析,结果显示共有23例CRKP血流感染患者使用了以碳青霉烯类药物为基础的联合用药,其中19例患者分离细菌亚胺培南MIC>16 mg/L,28 d病死率为36.8%;2例亚胺培南MIC≤1 mg/L,2例亚胺培南MIC=2 mg/L,28 d存活率100%。见表4。
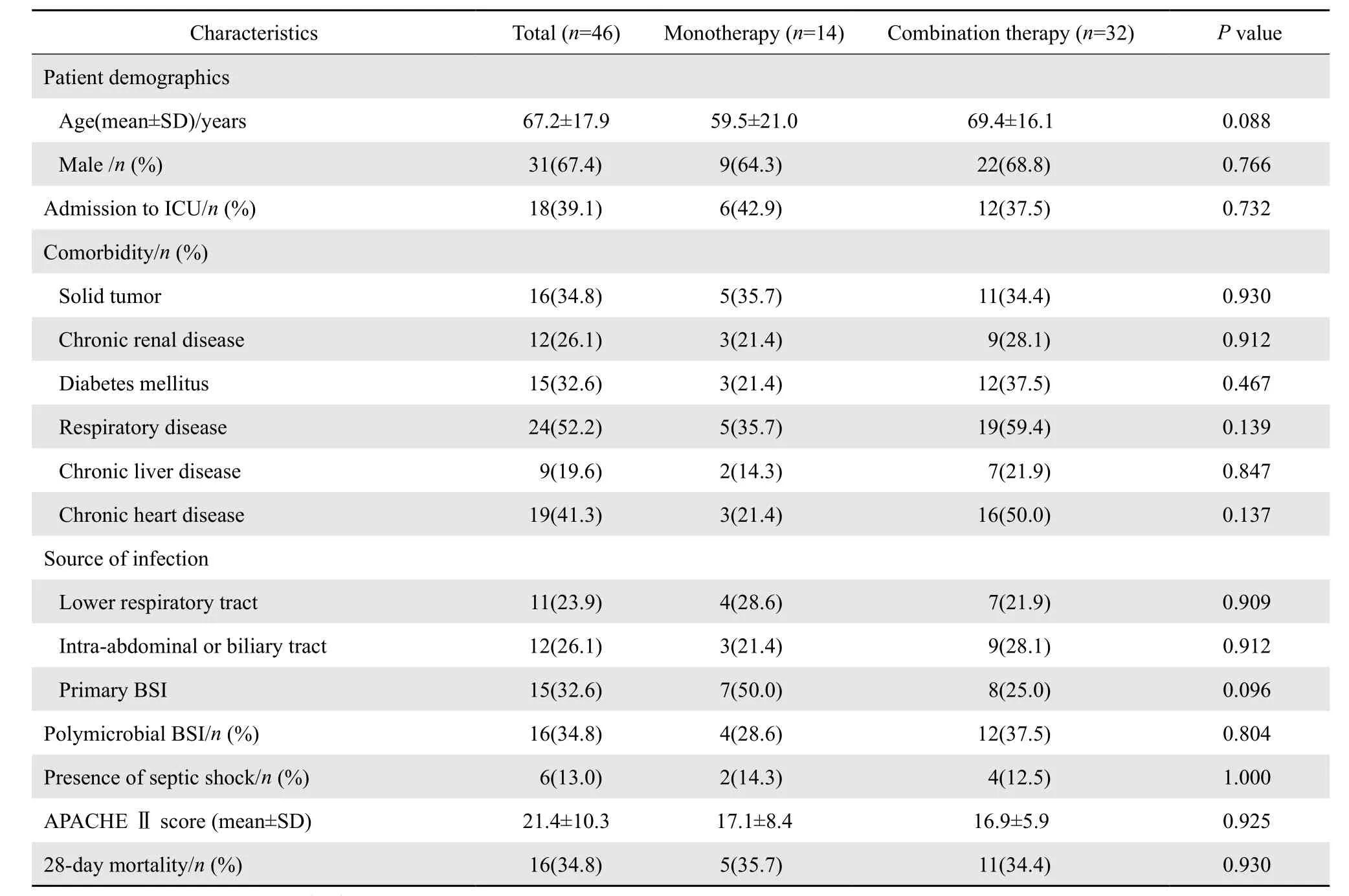
表2 46例CRKP血流感染患者的抗菌治疗方案分层分析Table 2 Characteristics of patients with carbapenem-resistant Klebsiella pneumonia bloodstream infection in terms of antimicrobial regimen
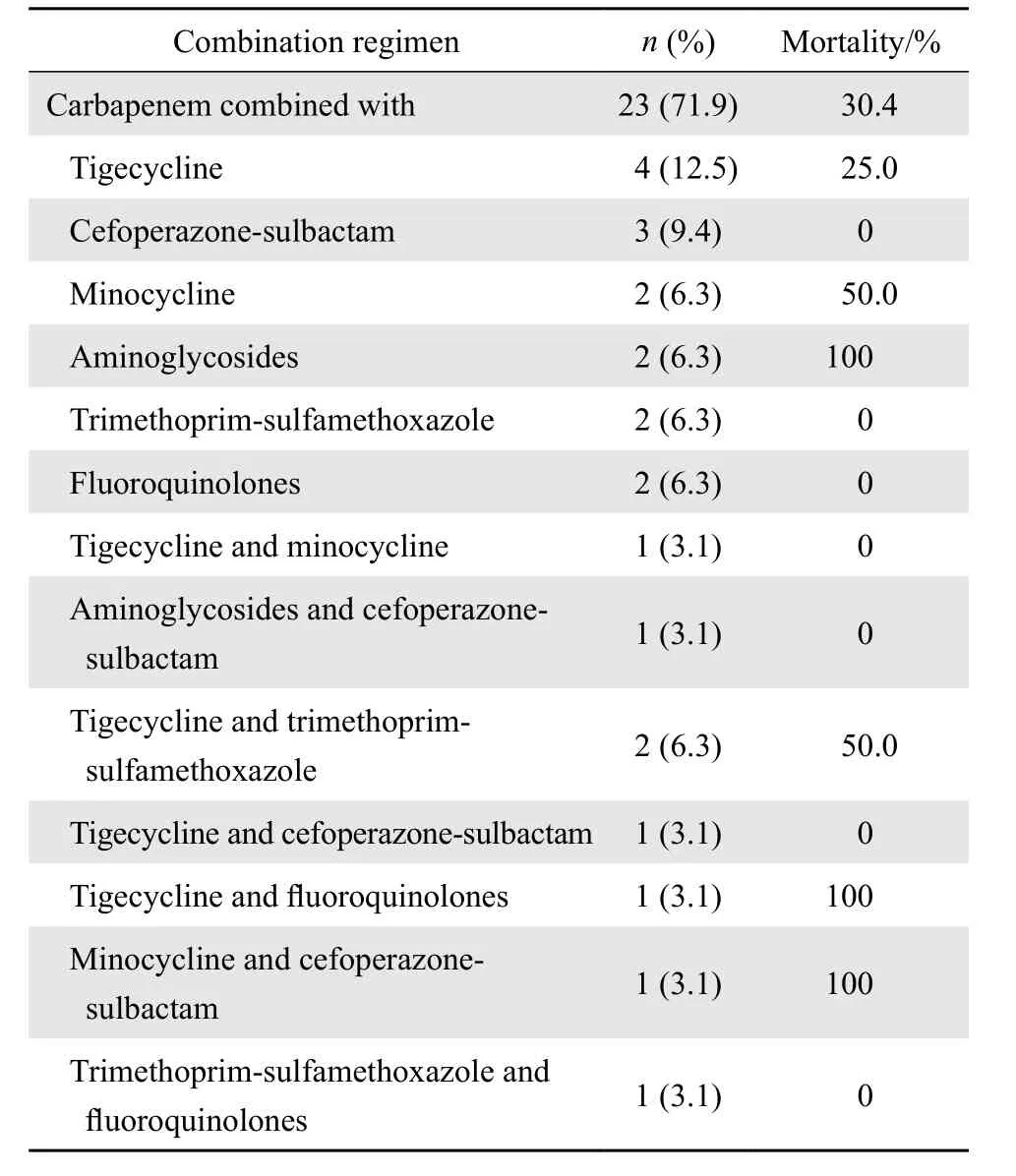
表3 23例以碳青霉烯类药物为基础的联合用药治疗方案及临床结局Table 3 Outcomes of the 23 cases of carbapenem-resistant Klebsiella pneumoniae bloodstream infections treated with carbapenem-based regimen
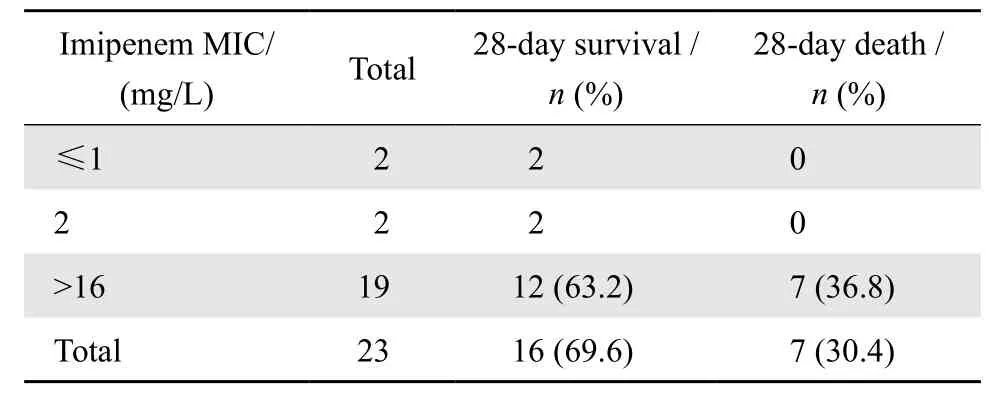
表4 23例CRKP血流感染患者使用以碳青霉烯类药物为基础联合用药的MIC值分析Table 4 The 28-day survival of 23 cases of carbapenemresistant Klebsiella pneumoniae bloodstream infection treated with carbapenem-based combination therapy in terms of imipenem MIC
3 讨论
肺炎克雷伯菌为兼性厌氧的革兰阴性杆菌,是重要的条件致病菌,也是临床上最常见的耐药菌之一。近年来随着侵袭性诊疗技术的广泛应用、大量抗菌药物不合理使用以及细菌在医院内患者之间传播等因素,CRKP的检出率不断升高,我国CHINET历年监测资料结果显示,2005-2015年肺炎克雷伯菌对碳青霉烯类的耐药率呈快速上升趋势,从最开始的3%上升至2015年的15%左右[6]。由CRKP引发的血流感染病死率高,已成为医院内死亡的独立危险因素[7-9]。而由于CRKP对包括碳青霉烯类、青霉素类、头孢菌素类、氨曲南在内的几乎所有β内酰胺类抗生素耐药,同时伴有病死率的增加,为临床治疗带来极大困难。本研究就CRKP血流感染的死亡危险因素对我院60例患者进行了回顾性分析,同时初步探讨抗菌治疗方案对患者预后的影响。
本研究纳入我院近5年CRKP血流感染患者60例,28 d病死率为40.0%,与国内外报道结果基本一致[10-12]。Tumbarello等[13]在2015年报道了一项包括661例产碳青霉烯酶肺炎克雷伯菌感染患者的多中心回顾性队列研究,结果显示产碳青霉烯酶肺炎克雷伯菌血流感染患者病死率(41.1%,271/661)显著高于其他部位该菌感染(24.3%,52/214)。国外文献报道CRKP感染患者病死率在22%~72%[12,14-15],而CRKP血流感染患者病死率超过40%[16]。分析CRKP血流感染所致的高病死率原因是多方面的,如与患者基础状况、病原菌对宿主的致病性以及接受的抗菌药物治疗等因素密切相关。
本研究根据血流感染28 d预后分为存活组与死亡组,经过单因素分析结果显示偏低的ΒMI、高APACHE Ⅱ评分、合并呼吸系统疾病以及感染性休克是CRKP血流感染患者死亡相关危险因素。我国台湾一项关于17所医院多中心研究[17]报道碳青霉烯类耐药肠杆菌科细菌(CRE)感染病死率约50%,单因素回归分析发现,糖尿病患者、感染性休克、接受不合理的治疗,APACHE Ⅱ评分为死亡相关因素,与本研究结果类似。本研究统计结果显示入住ICU患者病死率(50.0%)明显高于非ICU患者(27.8%),可能原因是ICU内收治的患者病情更严重、基础疾病更多、住院时间更长、需要的医疗支持手段更多,患者获得感染的机会增加,导致病死率明显增高。本研究发现血流感染时出现感染性休克患者占21.7%,是CRKP血流感染患者重要死亡危险因素,以往多宗文献得出此结论[5,10,12-13],多因素回归分析结果显示高APACHE Ⅱ评分是CRKP血流感染患者的死亡独立危险因素,与以往研究结果基本一致[5,12,18],提示患者病情的危重,如发病时出现感染性休克、高APACHE Ⅱ评分预示着CRKP血流感染患者不良预后。此外,本研究结果显示存活组中原发性血流感染的患者显著高于死亡组。单因素分析结果提示合理的经验性治疗与CRKP血流感染患者的存活率无相关性,类似的结果在国外文献中也有报道[5]。
本文研究结果显示28 d病死率在联合用药组与单药组之间的差异无统计学意义。与本研究结果不同的是,目前国内外多数学者证实联合用药组较单药组在提高患者生存率方面具有统计学差异[10,12,19-21]。仍有部分研究显示联合用药较单药治疗在提高患者生存率方面无明显优势[17,22-23]。本研究中较常见的联合用药方案为以碳青霉烯类药物为基础的联合用药,因此本研究对23例以碳青霉烯类药物为基础的联合用药患者进行了碳青霉烯类药物MIC值分析,结果提示19例亚胺培南MIC> 16 mg/L,28 d病死率达36.8%,而亚胺培南MIC≤2 mg/L的4例患者28 d均存活。Daikos等[10]研究结果显示当碳青霉烯类药物体外药敏提示MIC值≤8 mg/L时死亡率为19.3%,而碳青霉烯类药物MIC值>8 mg/L时死亡率将上升至35.5%。Daikos等[20]2012年报道了一项包括432例CRKP血流感染患者的系统评价也得出类似的结论。本研究中19例亚胺培南MIC>16 mg/L,可解释当其与替加环素或米诺环素等其他药物联合应用时未能明显降低患者死亡率的原因,同时,替加环素的浓度在人体血流中分布较低,在治疗血流感染时疗效不佳,本研究结果提示接受联合用药患者中当替加环素维持剂量为100 mg每12小时1次,存活率为100%,较维持剂量为50 mg每12小时1次相比更有利于改善患者的预后。
然而,本研究仍有以下不足:①收集病例为单中心样本,上述结论不能代表本区域的整体情况;②本研究为回顾性研究,易出现偏倚;③所研究样本量相对不足,因此所得出的研究结果及结论仅供参考;④因条件所限未对文中CRKP株进行耐药基因的检测。
总之,CRKP血流感染患者病死率高,且缺乏有效的抗菌药物控制该耐药菌,近年来体内外研究进展提示联合用药疗效优于单药,但目前尚无大样本的随机对照研究来为制定CRKP感染治疗提供有力的证据。本研究结果提示高APACHE Ⅱ评分是CRKP血流感染患者死亡独立危险因素,建议在临床治疗过程中积极改善患者基础状况,对降低CRKP血流感染患者病死率有显著意义。
[1]RAHAL JJ. The role of carbapenems in initial therapy for serious Gram-negative infections[J]. Crit Care, 2008, 12(Suppl 4): s5.
[2]中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5):314-320.
[3]GARNER JS, JARVIS WR, EMORI TG, et al. CDC definitions for nosocomial infections,1988[J]. Am J Infect Control, 1988,16(3): 128-140.
[4]中华医学会重症医学分会. 血管内导管相关感染的预防与治疗指南(2007)[J]. 中国实用外科杂志, 2008, 28(6): 413-421.
[5]ZARKOTOU O, POURNARAS S, TSELIOTI P, et al.Predictors of mortality in patients with bloodstream infections caused by KPC-producingKlebsiella pneumoniaeand impact of appropriate antimicrobial treatment[J]. Clin Microbiol Infect,2011, 17(12): 1798-1803.
[6]胡付品, 朱德妹, 汪复, 等. 2015年CHINET细菌耐药性监测 [J]. 中国感染与化疗杂志, 2016, 16(6): 685-694.
[7]SCHWAΒER MJ, KLARFELD-LIDJI S, NAVON-VENEZIA S, et al. Predictors of carbapenem-resistantKlebsiella pneumoniaeacquisition among hospitalized adults and effect of acquisition on mortality[J]. Antimicrob Agents Chemother,2008, 52(3): 1028-1033.
[8]XU L, SUN X, MA X. Systematic review and meta-analysis of mortality of patients infected with carbapenem-resistantKlebsiella pneumoniae[J]. Ann Clin Microbiol Antimicrob,2017, 16(1): 18.
[9]CAPONE A, GIANNELLA M, FORTINI D, et al. High rate of colistin resistance among patients with carbapenem-resistantKlebsiella pneumoniaeinfection accounts for an excess of mortality[J]. Clin Microbiol Infect, 2013, 19(1): E23-E30.
[10]DAIKOS GL, TSAOUSI S, TZOUVELEKIS LS, et al.Carbapenemase-producingKlebsiella pneumoniaebloodstream infections: lowering mortality by antibiotic combination schemes and the role of carbapenems[J]. Antimicrob Agents Chemother, 2014, 58(4): 2322-2328.
[11]PAPADIMITRIOU-OLIVGERIS M, MARANGOS M,CHRISTOFIDOU M, et al. Risk factors for infection and predictors of mortality among patients with KPC-producingKlebsiella pneumoniaebloodstream infections in the intensive care unit[J]. Scand J Infect Dis, 2014, 46(9): 642-648.
[12]TUMΒARELLO M, VIALE P, VISCOLI C, et al. Predictors of mortality in bloodstream infections caused byKlebsiella pneumoniaecarbapenemase-producingK. pneumoniae:importance of combination therapy[J]. Clin Infect Dis, 2012, 55(7): 943-950.
[13]TUMΒARELLO M, TRECARICHI EM, DE ROSA FG, et al.Infections caused by KPC-producingKlebsiella pneumoniae:differences in therapy and mortality in a multicentre study[J]. J Antimicrob Chemother, 2015, 70(7): 2133-2143.
[14]ΒORER A, SAIDEL-ODES L, RIESENΒERG K, et al.Attributable mortality rate for carbapenem-resistantKlebsiella pneumoniaebacteremia[J]. Infect Control Hosp Epidemiol,2009, 30(10): 972-976.
[15]HIRSCH EΒ, TAM VH. Detection and treatment options forKlebsiella pneumoniaecarbapenemases (KPCs): an emerging cause of multidrug-resistant infection[J]. J Antimicrob Chemother, 2010, 65(6): 1119-1125.
[16]Centers for Disease Control and Prevention(CDC). Vital signs: carbapenem-resistantEnterobacteriaceae[J]. MMWR Morb Mortal Wkly Rep, 2013, 62(9): 165-170.
[17]CHANG YY, CHUANG YC, SIU LK, et al. Clinical features of patients with carbapenem nonsusceptibleKlebsiella pneumoniaeandEscherichia coliin intensive care units: a nationwide multicenter study in Taiwan[J]. J Microbiol Immunol Infect,2015, 48(2): 219-225.
[18]NGUYEN M, ESCHENAUER GA, ΒRYAN M, et al.Carbapenem-resistantKlebsiella pneumoniaebacteremia:factors correlated with clinical and microbiologic outcomes[J].Diagn Microbiol Infect Dis, 2010, 67(2): 180-184.
[19]QURESHI ZA, PATERSON DL, POTOSKI ΒA, et al.Treatment outcome of bacteremia due to KPC-producingKlebsiella pneumoniae: superiority of combination antimicrobial regimens[J]. Antimicrob Agents Chemother, 2012, 56(4):2108-2113.
[20]DAIKOS GL, MARKOGIANNAKIS A, SOULI M, et al.Βloodstream infections caused by carbapenemase-producingKlebsiella pneumoniae: a clinical perspective[J]. Expert Rev Anti Infect Ther, 2012, 10(12): 1393-1404.
[21]倪文涛, 赵进, 王睿, 等. 联合用药治疗产KPC肠杆菌科细菌感染研究进展[J]. 中华医院感染学杂志, 2017,27(4):953-956.
[22]KONTOPIDOU F, GIAMARELLOU H, KATERELOS P,et al. Infections caused by carbapenem-resistantKlebsiella pneumoniaeamong patients in intensive care units in Greece: a multi-centre study on clinical outcome and therapeutic options[J].Clin Microbiol Infect, 2014, 20(2): O117-123.
[23]KATSIARI M, PANAGIOTA G, LIKOUSI S, et al.Carbapenem-resistantKlebsiella pneumoniaeinfections in a Greek intensive care unit: Molecular characterisation and treatment challenges[J]. J Glob Antimicrob Resist, 2015, 3(2):123-127.

