UPLC-MS法同时检测大鼠血浆中6种CYP450探针药物浓度
景 娴, 江 海,2, 陈 琛,2,3
(1.陕西理工大学 生物科学与工程学院, 陕西 汉中 723000;2.陕西省陕南秦巴山区生物资源综合开发协同创新中心, 陕西 汉中 723000;3.陕西理工大学 中德天然产物研究所, 陕西 汉中 723000)
在治疗疾病过程中,为了促进治疗效果,通常会采用联合用药技术,联合用药通常会对疾病的治疗和临床反应产生不同程度的改变,这种改变主要通过肝脏中的CYP450酶进行代谢。CYP450酶是重要的Ⅰ相代谢酶,参与内源性物质和包括药物、环境化合物在内的外源性物质的氧化代谢和还原代谢,主要负责近90%的药物在人体的肝脏和肠道代谢[1-2],因此CYP450酶的活性变化能够反映出联合用药时药物间的代谢关系及药物的相互作用[3]。目前欧美各国已将CYP450酶活性的测定用于新药研发及药物代谢研究,并将其列为新药申报时必须进行的一项试验,而在试验过程中通常采用探针药物法来评价药物在体内对CYP450酶活性变化的影响[4]。探针药物法“Cocktail”即鸡尾酒法,是一种同时给予两种或多种低剂量的探针药物,测定生物样本中每个探针药物的代谢率,从而一次反映多个CYP450同工酶活性变化的一种方法[5-6]。
非那西丁、甲苯磺丁脲、奥美拉唑、睾酮、右美沙芬、氯唑沙宗作为CYP450酶系中CYP1A2、CYP2C9、CYP2C19、CYP3A4、CYP2D6、CYP2E1使用最广泛的专属性底物[7],且这6种药物是国际上普遍认可的可作为探针药物的药品。对上述6种药物在体内的血药浓度精确、稳定检测,可以准确了解药物的代谢状况,准确判定CYP1A2、CYP2C9、CYP2C19、CYP3A4、CYP2D6、CYP2E1酶的活性状况,科学指导合理用药。现常见的药物检测方法HPLC-UV法[8]检测时间慢,样品处理复杂,检测限高;LC-MS法[9]检测限有所降低,但不能同时检测多种探针底物,试验结果不稳定。本文在液质联用分析的基础上建立了一种准确、快速、稳定、灵敏度高的超高效液相色谱-串联质谱(UPLC-MS)法,并将其应用到药动学的研究中,为临床药动学检测技术提供一种快速可行的检测方法。
1 材 料
1.1 仪 器
ACQUITY UPLC超高效液相色谱串联ACQUITY TQD三重四极杆质谱仪(美国Waters公司);Masslynx V4.1数据采集分析软件;AUW220D十万分之一电子天平、AUY220万分之一电子天平(日本岛津公司);Thermo 21微量高速冷冻离心机(美国Thermo公司);Milli-Q制水机(美国Millcoper公司);微量移液器(德国Eppendorf公司)。
1.2 药品与试剂
奥美拉唑、右美沙芬、氯唑沙宗、非那西汀、睾酮(上海源叶生物科技公司,纯度≥98%);甲苯磺丁脲(上海毕得医药科技公司,纯度≥97%);纯水(实验室制水机自制);乙腈、甲酸均为色谱纯(天津科密欧试剂);其余试剂均为色谱纯。
2 方法与结果
2.1 液相条件
ACQUITY UPLC BEH C18色谱柱(50 mm×2.5 mm,1.7 μm),柱温30 ℃,流速0.25 mL/min,进样量5 μL,检测波长为270 nm。流动相为:有机相A为乙腈,水相B为0.1%甲酸,采用梯度洗脱方式,乙腈洗脱梯度为0~2 min(10%→20%),2~5 min(20%→31%),5~6 min(31%→60%),6~7 min(60%→10%),7~7.5 min(10%)。
2.2 质谱条件
电喷雾离子源(ESI),非那西汀、甲苯磺丁脲、奥美拉唑、睾酮、右美沙芬均为正离子模式检测(electrospray ionization,ESI+),氯唑沙宗为负离子模式检测(ESI-)。锥孔电压25 kV,离子源温度130 ℃,脱溶剂气温度250 ℃,脱溶剂气流量500 L/h,采用单离子监测(single ion monitoring,SIM),非那西汀m/z 180,甲苯磺丁脲m/z 271,奥美拉唑m/z 346,睾酮m/z 289,右美沙芬m/z 272,氯唑沙宗m/z 168。
2.3 血浆样品的制备
吸取大鼠血浆200 μL,加入乙腈800 μL,涡旋振荡1 min,离心(8000g,4 ℃)10 min,取上层清液400 μL转移至新离心管,4 ℃静置24 h,再次离心(8000g,4 ℃)5 min,取上清300 μL,过0.22 μm滤膜后备用。
2.4 对照品溶液的制备及标准曲线的确定
取空白大鼠血浆1000 mL,按2.3方法处理后,分别加入0.3 mg的不同标准品,得到6种标准品母液,按比例稀释后,使其浓度分别为5,50,100,250,500,750,1500 ng/mL。按2.1方法进行进样检测,以标准溶液的浓度(μg/mL)为横坐标,各组分峰面积值为纵坐标,绘制各标准物质的标准工作曲线,得到6种药物的线性方程见表1。
2.5 方法学考察
2.5.1 专属性
本试验条件下,非那西丁、甲苯磺丁脲、奥美拉唑、睾酮、右美沙芬、氯唑沙宗这6种物质均有较大的色谱峰,且血浆中杂质峰不影响样品的测定,6种物质均有较好的分离度,保留时间分别为3.84,6.50,3.16,6.63,4.46,4.97 min。如图1所示。

表1 6种底物的线性方程
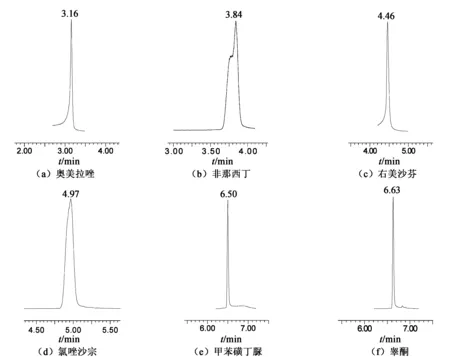
图1 6种底物的色谱图
2.5.2 精密度与准确度
取空白血浆适量,按2.3方法处理,加入不同量的标准品,配制低、中、高各5份样品,使各药浓度分别为5,50,100 ng/mL。按照2.1的方法操作,连续3天进行测定,根据当日标准曲线计算各待测物的实测质量浓度,考察各质量浓度下的精密度与准确度,结果见表2。
2.5.3 稳定性
取空白血浆适量,按2.3处理后,配制6种药物分别为低、中、高3个浓度各5份,分别置于室温6 h及-20 ℃下反复冻融3次。根据2.1进行测定,考察6种样品的稳定性。计算各理论值与实测值,RSD值均小于10%,表明该方法稳定性良好。
2.5.4 基质效应
取空白血浆适量,加入相应质量浓度的6种药物标准工作液进样测定,得相应色谱峰峰面积(C);另取同体积相应质量分数的标准工作液,使最终质量分数与前者相对应,进样测定,得相应色谱峰峰面积(B);基质效应(%)=C/B×100%。结果如表3所示,基质效应为88%~106%,RSD<7%,表明基质效应基本不影响各个药物的血药浓度的测定[10]。
2.5.5 提取回收率
分别处理低、中、高样品各5份,按2.3方法处理后进样测定,得相应色谱峰峰面积(A1);取空白血浆适量,按2.3方法处理后,加入相应质量浓度的不同药物标准工作液,使最终质量浓度与前者相对应,进样测定,得相应色谱峰峰面积(A2);提取回收率(%)=A1/A2×100%,结果见表3。
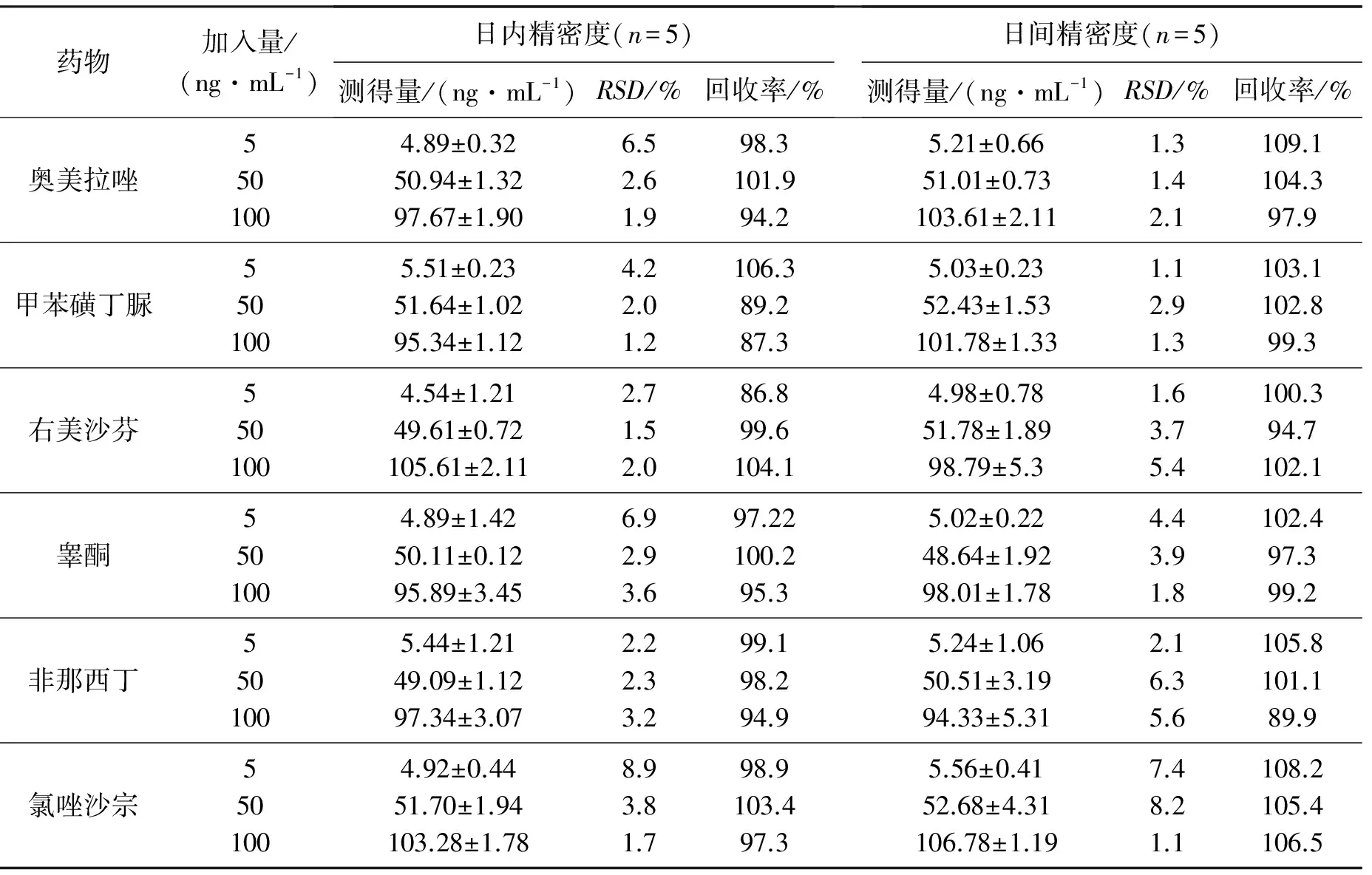
表2 大鼠血浆中6种底物的精密度与准确度
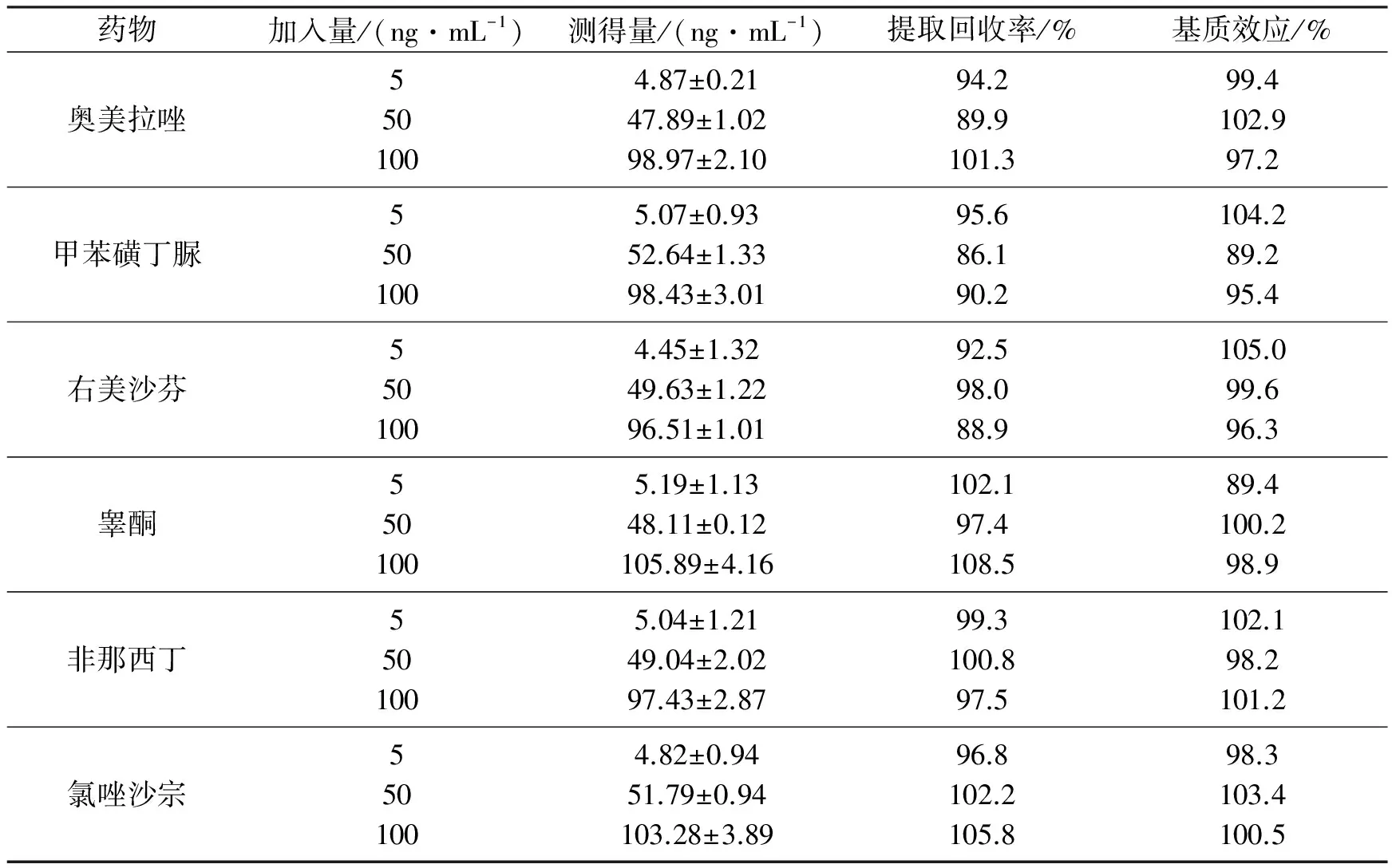
表3 大鼠血浆中6种底物的提取回收率与基质效应测定
在建立试验方法和质谱条件优化的过程中,将每一个待测物进行扫描时发现,奥美拉唑、甲糖宁、右美沙芬、睾酮、非那西丁正离子模式反应强,而氯唑沙宗负离子模式反应强,故最后采用两种不同模式。但在质谱参数优化过程中,由于6种物质极性具有不同的差异性及试验条件所限,故最终选择SIM模式进行试验。而后期试验中,将根据前期试验进行优化,以便能采用MRM(多反应检测)模式,这样检测得到的浓度更精密,专一性更高,试验结果更准确。
3 血药浓度测定及药动学参数
3.1 动物试验
雄性SD大鼠12只,随机分为给药组与空白试验组,大鼠体重约为(250±6.58) g,将称取好的6种药物溶于羧甲基纤维素钠,给予大鼠灌胃给药,给药剂量为甲苯磺丁脲(5 mg/kg),氯唑沙宗(20 mg/kg),睾酮(10 mg/kg),右美沙芬(20 mg/kg),奥美拉唑(20 mg/kg)。于给药后0,0.25,0.5,0.75,1,1.5,2,4,6,12,24 h由颈静脉丛取血0.3 mL于肝素化试管中,静置2~4 h后,4 ℃离心,取上层血浆于-20 ℃冷冻保存,备用。
3.2 药物代谢动力学结果
按2.3方法处理已采血浆后测定各时间点血药浓度,绘制探针药物药-时曲线,如图2所示。
将血药浓度测定结果用DAS2.1.1软件进行自动拟合,求得6种探针底物的主要药物代谢动力学(以下简称药动学)参数,见表4。
表4与图2结果为本文所建立的UPLC-MS法测定奥美拉唑、甲糖宁、右美沙芬、睾酮、非那西丁及氯唑沙宗浓度方法所应用的结果。将上述结果与所查文献[11-12]进行对比,本研究所得结果与文献报道基本一致。即这6种药物在同时给予大鼠时,并没有产生药物间的相互影响,它们达到血药浓度最高时的时间也互不影响。主要由于这6种药物在作为探针底物时,其给予大鼠的药量少,且这6种药物针对不同的CYP450同工酶进行代谢,故并没有产生药物间相互作用。
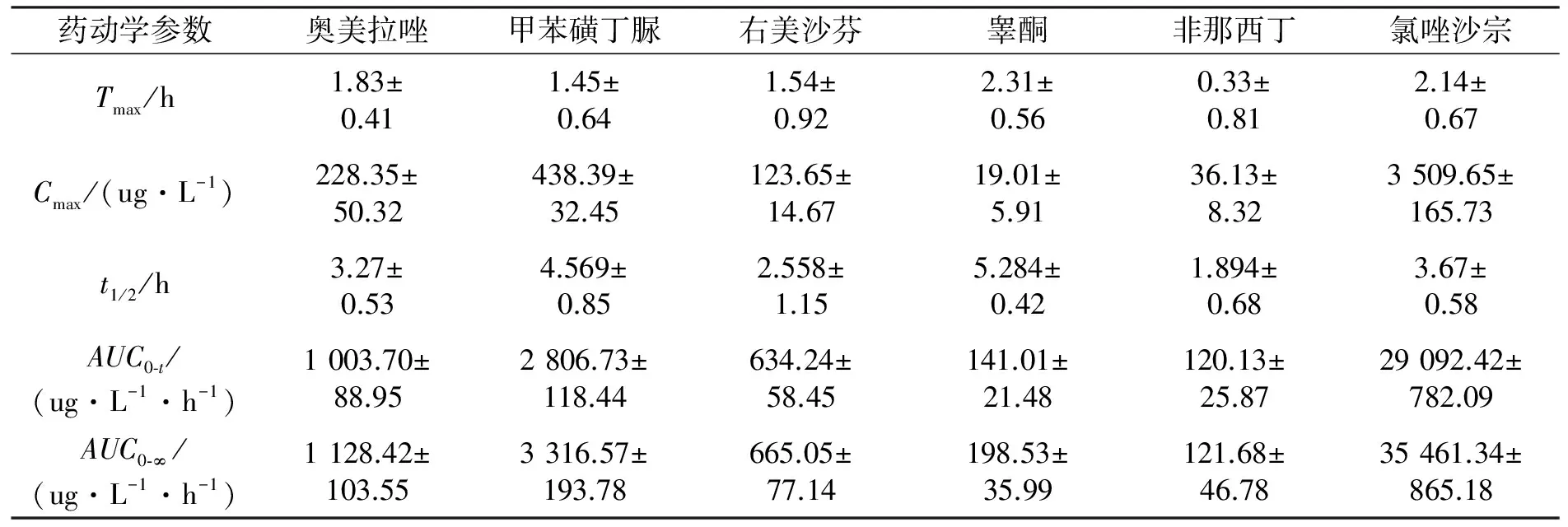
表4 给予大鼠6种底物后的主要药动学参数
4 结 论
通过方法学验证,UPLC-MS同时检测大鼠血浆中常用CYP450探针药物奥美拉唑、甲糖宁、右美沙芬、睾酮、非那西丁和氯唑沙宗浓度,该方法具有准确性高、专属性强、分析速度快、检出限低等优点,能够准确地对药物进行代谢分析,并利用CYP450酶活性的变化状况来对药物的药代动力学进行系统研究。
本次试验构建的检测方法采用测定探针药物代谢的变化情况来确定肝脏中代谢酶的活性变化,并以此确定药物的代谢状况。这种技术也可用于其他代谢酶含量变化分析,能为其他药物的药代动力学研究提供参考。
[参考文献]
[1] 王亮,郭姣,石忠峰,等.“Cocktail”探针药物法的研究思路与应用[J].辽宁中医药大学学报,2010,12(11):30-34.
[2] 侯丛颂,杨志宏,孙晓波.“cocktail”探针药物法及其在研究中药对细胞色素P450影响中的应用进展[J].中国药理学与毒理学杂志,2013,27(3):445-450.
[3] 郭宇松,李文雅,何朝兴,等.盐酸双苯氟嗪对大鼠CYP450酶活性的影响[J].中国药学杂志,2016,51(16):1407-1410.
[4] HARUKA Nishimuta,TETSUYA Nakagawa,NARUAKI Nomura,et al.Species differences in hepatic and intestinal metabolic activities for 43 human cytochrome P450 substrates between humans and ratsor dogs[J].Xenobiotica,2013,43(11):948-955.
[5] 武洁,钟荣玲,王大为,等.HPLC-MS-MS法测定大鼠血浆中6种CYP450探针药物及甘草对CYP450酶活性的影响[J].中国实验方剂学杂志,2014,20(23):110-116.
[6] 高志伟,施孝金,余琛,等.混合探针底物法同时预测细胞色素P450酶5种亚型的抑制作用[J].药学学报,2007,42(6):589-594.
[7] GUENGRICH F P.Role of cytochrome P450 enzymes in drug-drug interactions [J].Adv Pharmacol,1997,43:27-35.
[8] 宋佳伟.“鸡尾酒法”检测异甘草酸镁对大鼠P450酶影响[D].蚌埠:蚌埠医学院,2014.
[9] Guidance for Industry.Drug interaction studies-study design,data analysis,and implications for dosing and labeling recommendations[EB/OL].Food and drug administration[2014-08-18].http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM292362.
[10] 《化学药物临床药代动力学研究技术指导原则》课题研究组.化学药物临床药代动力学研究技术指导原则[S/OL].[2005-03-18].http://www.sda.gov.cn/WS01/CL1616/83420.html.
[11] 许潇,谢林,梁艳,等.LC-MS法同时测定大鼠血浆中咪达唑仑、右美沙芬及奥美拉唑的浓度[J].中国药科大学学报,2006,37(3):246-250.
[12] HUANG Y, ZHENG S L,ZHU H Y,et al.Effects of aescin on cytochrome P450 enzymes in rats[J].Journal of Ethnopharmacology,2014,151(1):583-590.

