基态原子的价层电子构型与元素周期表修正
王先闻
(汉中职业技术学院, 陕西 汉中 723002)
现行的元素周期表中除Li、Be、Na、Mg及P区元素之外,其他元素基态原子的价层电子构型都较为复杂,而且没有和谐的递变规律[1-3]。原因是对这些元素基态原子的价层电子构型确认错误[4-6]。关于重新确认基态原子的价层电子构型并对元素周期表修正,国内外尚无相关的研究报道。为此,依据能量最低原理及各元素基态原子的电子个数,在科顿原子轨道能级图[7]上标出表示各元素基态原子最高能级(能量最高的价层能级)的点,并将在同一条能级线上且相邻的串联成线段。每条这种线段所在闭区间上的有序元素组,都有一个简洁而完整的基态原子价层电子构型通式。并且这些价层电子构型通式恰好可以依原子核外电子个数递增顺序分组串联。串联后显示出,各种元素重新确认后的基态原子价层电子构型有周期性。这种周期性就是元素性质出现周期性的原因。据此可以从根本上修正元素周期表[8-10]。修正后的元素周期表周期从3号元素Li开始,周期依据重新确认的各种元素基态原子价层电子构型出现的周期性界定,不另列镧系和锕系。
1 重新确认各种元素基态原子的价层电子构型
1.1 依 据
重新确认各种元素基态原子的价层,依据是:美国无机结构化学家科顿总结了前人所做的关于光谱实验的数据和依据量子理论计算的结果,采用笛卡儿坐标系(纵坐标是能级的能量值,横坐标是原子序数,曲线为能级线——表示各元素同层同名能级能量的点连成的曲线)。所画出的准确的原子轨道能量随原子序数而变化的图——科顿原子轨道能级图(图1)。该图定量记录了原子序数从1—100的100种元素,原子基态及激发态的各个能级的能量值。
1.2 方 法
1.2.1 在科顿原子轨道能级图上标出一条辅助线
在科顿原子轨道能级图上,将记录各元素原子处于基态时能量最高能级的点,依原子序数递增顺序,沿能级线描成曲线段,笔者将这种曲线段命名为“王氏线段”,在图2中用粗虚曲线段标示。为了显示各条“王氏线段”之间的联系,再用平行于纵轴的直线段(在图2中用细虚直线段标示),连接每两条“王氏线段”相近的端点,串联成一条阶梯状折线,笔者将这条阶梯状折线命名为“王氏线”(图2)。
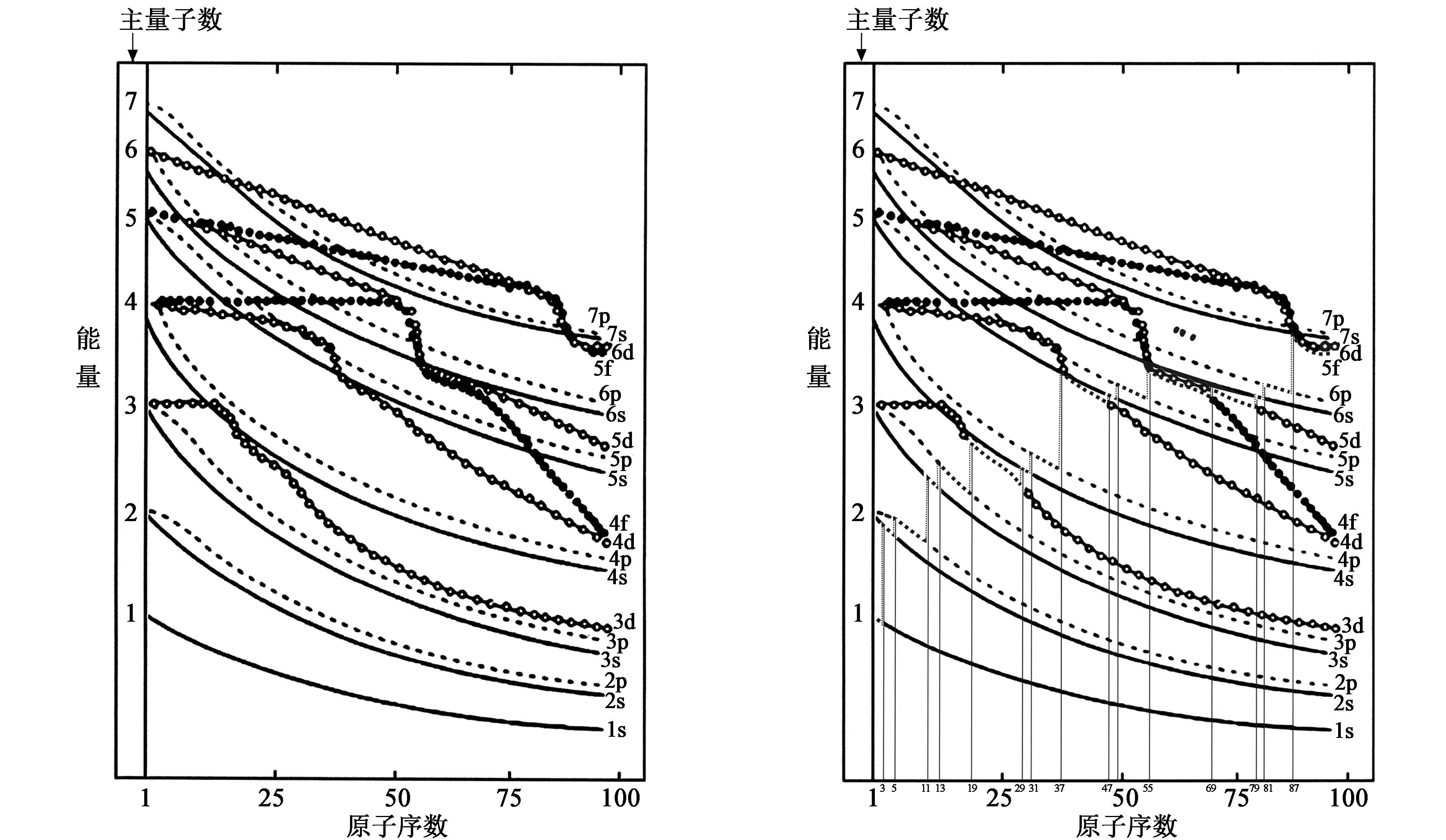
图1 科顿原子轨道能级图 图2 标出了王氏线的科顿原子轨道能级图
1.2.2 分析标出了王氏线的科顿原子轨道能级图
在图2上,王氏线段所在的位置有两类:一类分别“附着”在主量子数n为1—7的正整数的各条ns线上;另一类分别“邻近”主量子数是2—7的正整数的各条ns线。这里“邻近”ns线的界定是:在科顿原子轨道能级图中,一条不是附着于s线的王氏线段,在过其所在闭区间上任意一个原子序数且平行于纵轴的直线上,若其与一条ns线共同截出的线段长度等于或小于ns线与np线共同截出的线段长度,则该王氏线段“邻近”ns线。
从图2中可以看到,若主量子数n是2—7的正整数,则每一条ns线上都有包含被王氏线段“附着”和王氏线段“邻近”的一段。这一段ns线所在闭区间上的原子序数数列对应的有序元素组,称为“元素周期律”概念中的“周期”,编序为n-1,即“第n-1周期”。
在图2中,一条王氏线段之下,若无与其在同区间上且“邻近”的能级线段,则其所“附着”的能级线段就是“价层能级线段”;一条王氏线段之下,若有与其在同区间上且“邻近”的能级线段,则该王氏线段所“附着”及“邻近”的两条能级线段都是“价层能级线段”。由同一个闭区间上的“价层能级线段”(一条或两条)所组成的线段组,称为“价层能级线段组”。一种元素的原子序数所对应的“价层能级线段组”上的能级(亚层),就是该元素基态原子的“价层能级”。
在图2中,有相同基态原子价层能级的元素,原子序数在同一个闭区间上。由此得出各种元素的基态原子价层能级为:[3,4]上是2s;[5,10]上是2s2p;[11,12]上是3s;[13,18]上是3s3p;[19,28]上是3d;[29,30]上是3d4s;[31,36]上是4s4p;[37,46]上是4d;[47,48]上是4d5s;[49,54]上是5s5p;[55,68]上是4f;[69,70]上是4f5d;[71,78]上是5d;[79,80]上是5d6s;[81,86]上是6s6p;[87,100]上是5f;[101,102]上是5f6d;[103,110]上是6d;[111,112]上是6d7s;[113,118]上是7s7p。基态原子的价层若有两个能级时,根据能量最低原理,能量较低的能级上各条轨道必定电子全满。据此可以写出这些闭区间上,原子序数数列对应的有序元素组的基态原子“价层电子构型通式”。
综上所述,列表如表1。
表1王氏线段表

2 修正元素周期表
将各种元素依其基态原子核外电子个数递增顺序排列之后,元素的基态原子价层电子构型出现了周期性(见表1),这就是元素性质出现周期性的原因。因此,元素基态原子核外电子个数、1.2.2中关于元素周期的划分方法、表1中所列价层电子构型通式及各元素基态原子价层电子构型式(依据能量最低原理、基态原子核外电子个数及递增顺序,按价层电子构型通式即可确认各种元素基态原子的价层电子构型式)等,就是修正元素周期表的依据。
首先从第3号元素Li起,将所有的元素依其基态原子核外电子个数递增顺序排列,再依据1.2.2中关于元素周期的划分方法所确定的周期分段,并依周期编序由小到大,右端对齐,从上至下横置;最后载入各元素新确认的基态原子价层电子构型式,即可得出修正后的元素周期表,如表2所示。
表2元素周期表
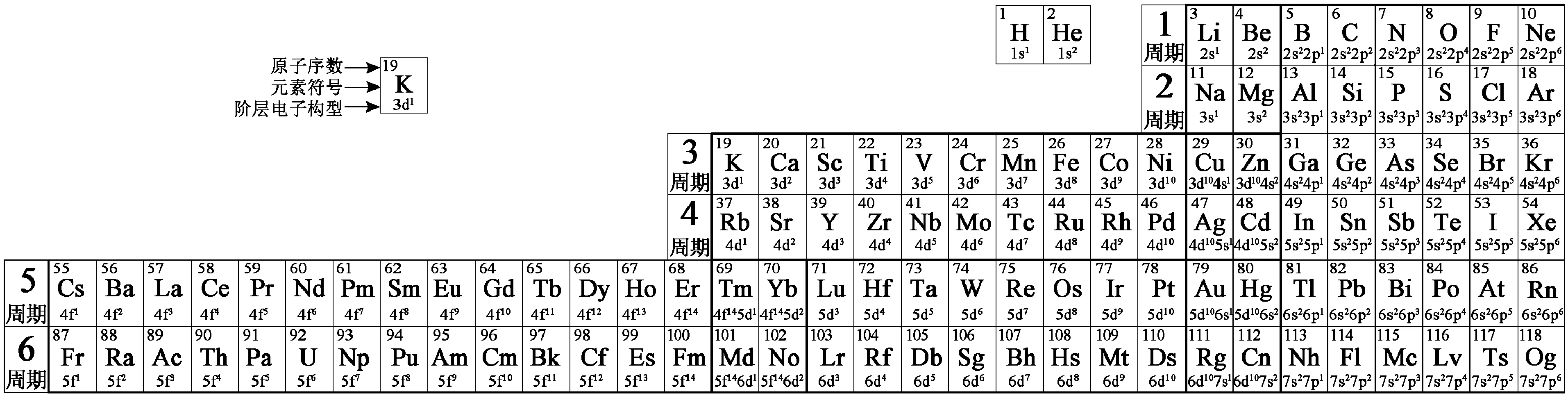
修正后的元素周期表不再将H和He两元素列为第一周期,因此只有6个周期,其中第一、第二两个周期是短周期;第三、第四两个周期是中周期;第五、第六两个周期是长周期;不再单列镧系和锕系,原镧系元素归入第五周期,原锕系元素归入第六周期。
3 讨 论
在现行的元素周期表中,元素以核电荷数排序,按元素性质出现的周期性界定周期,并将元素区分为主族、副族、镧系及锕系,侧重对元素性质的分类归纳,因此是局部规律的集合,而不是以原子结构为依据得出的整体规律。
修正后的元素周期表,是以原子结构为依据得出的元素集合的整体规律,原子结构决定元素性质。这个因果关系使得对元素性质的研究和对原子结构的研究更能相互印证。
[参考文献]
[1] 王日为.无机及分析化学[M].北京:化学工业出版社,2013:41-45.
[2] 黄永义.原子物理学教程[M].西安:西安交通大学出版社,2013:172-178.
[3] 王庆飞,姚玉钦.普通物理学[M].西安:西北工业大学出版社,2007:417-423.
[4] 刘月成,杨占森.原子轨道能级与原子电子组态[J].雁北师范学院学报(自然科学版),1994(2):37-39.
[5] 刘林,朱斌.徐光宪原子核外电子排布近似规律及其应用[J].化学教育,2016,37(2):14-17.
[6] 杨唐靖.原子核外电子排布规律解析[J].中学化学,2010(5):11-12.
[7] 傅献彩.大学化学[M].北京:高等教育出版社,1999:524-527.
[8] 夏少武,夏树伟.结构化学[M].北京:科学出版社,2012:73-75.
[9] 李瑞祥,曾红梅,周向葛.无机化学[M].北京:化学工业出版社,2013:159-163.
[10] 唐敬友.原子物理与量子力学[M].北京:北京大学出版社,2011:211-221.

