维生素D3与雌性生殖
徐 欢, 何琳琳
(1.陕西理工大学 维生素D生理与应用研究所, 陕西 汉中 723000;2.陕西理工大学 生物科学与工程学院, 陕西 汉中 723000)
维生素D(vitamin D,VD)是一种人体必需的脂溶性维生素,属于类固醇衍生物。VD家族成员中与人类密切相关的是VD2和VD3,VD2主要存在于部分植物和真菌中,以食物的形式被人体吸收。维生素D3(vitamin D3,VD3)主要通过皮肤产生,与维生素D受体(vitamin D receptor,VDR)结合后发挥其生物学作用。VD3的经典作用是调节体内钙、磷代谢平衡和维持骨的健康,目前VD3的作用已延伸至雌性生殖系统[1]。近年来由于VD3缺乏导致的不孕女性逐年增多,促使对VD3和雌性生殖的研究不断深入。VD3经维生素D代谢酶即维生素D合成酶和降解酶催化可产生一系列代谢产物,其中1,25(OH)2D3(1,25D3)是VD3在动物体内的活性形式,主要通过VDR发挥其生物学作用[2]。VDR和维生素D代谢酶广泛分布于雌性生殖系统,表明VD3参与调节雌性生殖。目前对于VD3/VDR在雌性生殖系统中的功能研究较少,主要集中在对卵泡生成比较重要的雌性激素的产生和分泌的调控部分。本文主要讨论大鼠、小鼠、人雌性生殖系统中VDR和维生素D代谢酶的表达和分布、VD3与雌性生殖的相关性及其分子机制,以期为推进VD3影响雌性生殖的分子机制和临床治疗女性生殖相关疾病的研究提供理论依据。
1 VD3的代谢和作用机制
人体中VD3主要通过皮肤产生,极少部分通过食物吸收。当人体皮肤暴露在阳光紫外线下时,皮肤中的7-脱氢胆固醇转变为VD3前体,在肝脏细胞的内质网和线粒体中经25-羟化酶作用生成25OHD3(25D3)。25D3通过血液转运至肾,经1α-羟化酶作用生成活性VD3即1,25D3,其中部分1,25D3和少数25D3分别经肾脏中的24-羟化酶转化成1α,24,25(OH)2D3和24,25(OH)2D3。25-羟化酶和1α-羟化酶为维生素D合成酶,25-羟化酶主要由CYP2R1和CYP27A1编码,1α-羟化酶主要由CYP27B1编码,主要参与活性VD3的合成。CYP27A1除催化产生主要代谢物25D3外,还产生至少7种形式的次要代谢物,而CYP27B1似乎只催化25D3的C-1α位置的羟基化反应[3]。24-羟化酶是维生素D分解酶,主要由CYP24A1编码,它除了能使1,25D3和25D3的24位羟基化,还可将VD3代谢为VD3-23羧酸(calcitroic acid)后经胆汁由粪便排出[4]。
VD3在机体中的反应非常复杂,其发挥作用不仅受VD3摄入量的影响,还受VD3代谢酶和VDR是否表达以及表达水平高低的影响[5]。VD3代谢酶合成的1,25D3主要通过VDR发挥其生物学作用,VDR属于配体依赖性转录因子超家族,VD3与VDR结合后,VD3/VDR与核受体视黄酸X受体(Retinoid-X-Receptor,RXR)相互作用形成VD3/VDR/RXR复合物,复合物结合靶基因的维生素D应答元件(vitamin D response element,VDRE),激活或抑制靶基因的转录表达,从而实现VD3的基因组作用[2]。而VD3的非基因组作用主要是指其激活信号分子以及伴随着蛋白激酶快速产生第二信使,也包括Ca2+和Cl-通道的开放[6],还包括位于膜或细胞质中的VDR通过其与细胞中的各种靶蛋白相互作用而介导的快速非基因组作用[7]。
2 维生素D代谢酶和VDR在雌性生殖系统中的分布
雌性生殖系统是雌性动物体内完成生殖过程的器官总称。高等脊椎动物的雌性生殖系统包括卵巢、输卵管、子宫、阴道和外生殖器,外生殖器主要腺体为阴核腺和乳腺,而且胎生的雌性高等脊椎动物在生殖过程中有胎盘产生。目前研究发现VDR和维生素D代谢酶广泛分布于雌性生殖系统(如表1所示),说明VD3参与雌性生殖过程。
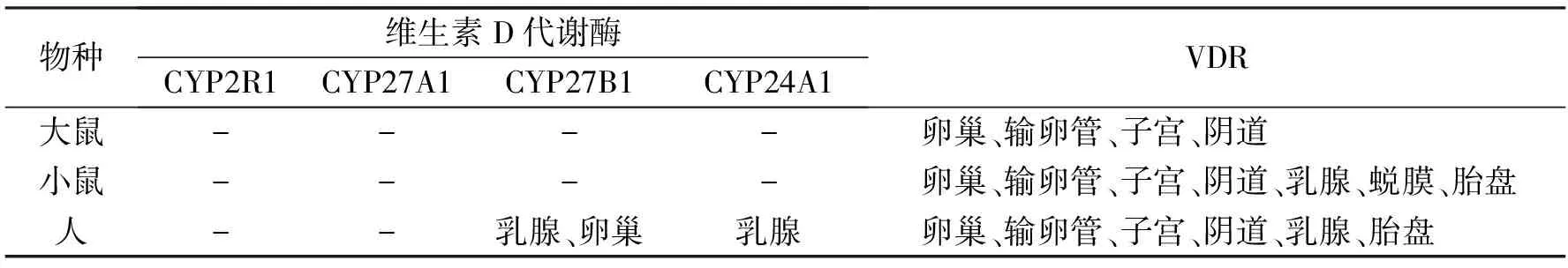
表1 VDR和维生素D代谢酶在大鼠、小鼠和人雌性生殖系统中的分布
注:“-”代表未发现

研究显示,VDR主要分布在雌性大鼠卵巢基质中的生发上皮细胞、卵巢的颗粒细胞、黄体细胞、滤泡细胞、输卵管和子宫的上皮细胞以及阴道上皮细胞中。VDR在大鼠发情前期和发情周期的阴道上皮中呈现规律性的表达与不表达,切除卵巢大鼠的阴道上皮中没有VDR表达。如Yildirim等[10]比较了各发情周期大鼠和卵巢切除大鼠阴道上皮中VDR的分布,发现处于发情周期大鼠的阴道基底和上皮细胞中有VDR,在发情周期中VDR对阴道鳞状上皮的增殖和分化有着重要的作用,与雌激素的作用相似,而发情前期大鼠阴道并未检测到VDR,卵巢切除大鼠在阴道上皮和阴道基底未检测到VDR,研究结果表明VDR在大鼠阴道中存在具有特殊性。VD3可使切除卵巢大鼠的阴道上皮层中产生角化层并使阴道上皮中VDR的表达从无到有。如Basak等[11]研究发现,VD3注射治疗的卵巢切除大鼠阴道上皮是高度分层的角化层,其阴道免疫组织化学染色显示有VDR存在,而卵巢切除大鼠对照组的阴道上皮层没有角化层存在,其阴道免疫组织化学染色显示没有VDR存在,表明VD3能够诱导阴道上皮增生,并上调阴道上皮中的VDR的表达。
研究显示,VDR主要分布在雌性小鼠的卵巢、输卵管、子宫、阴道、乳腺、蜕膜、胎盘中。Zarnani等[12]发现VDR存在于小鼠雌性生殖系统中,其表达在整个发情周期有差异。与发情间期相比,发情期前期、发情期、发情后期小鼠的树突状细胞、巨噬细胞和子宫内膜的腺体、卵巢的颗粒细胞、上皮细胞、卵丘细胞和输卵管上皮细胞强烈表达VDR,并且在发情期表达量最高。Tavera-Mendoza等[13]通过VD3激活VDR诱导的乳腺癌细胞自噬,提高患者生存率,在乳腺癌转移患者中VD3激活VDR诱导的乳腺癌细胞自噬作用逐渐丧失,表明在小鼠补充膳食VD3会增加其正常乳腺细胞中癌细胞自噬的基础水平。Shahbazi等[14]研究怀孕小鼠不同妊娠时期的蜕膜、胎盘和卵巢中VDR表达,发现小鼠整个怀孕时期蜕膜、胎盘和卵巢中的VDR mRNA和蛋白表达均显著,与妊娠中期相比妊娠晚期胎盘VDR基因表达显著增加,妊娠早期到中期蜕膜中的VDR表达水平显著上升,与非怀孕小鼠的子宫内膜相比,怀孕小鼠蜕膜中VDR表达较高,研究结果显示怀孕期间VDR在生殖器官中的表达显著升高,表明其在雌性生殖生物学中的重要作用。
研究显示,VDR主要分布在女性的卵巢、输卵管、子宫、阴道、乳腺、胎盘中。Kim T H等[15]通过免疫组化研究发现,无论月经周期和血清25D3水平如何变化,VDR在人阴道上皮和基底层均有分布。张纯等[16]发现VDR在人输卵管黏膜上皮有表达。Ranjzad等[17]研究表明VDR基因多态性通过影响其对促黄体生成素和性激素结合球蛋白水平以及胰岛素抵抗来参与女性多囊卵巢综合征(polycystic ovary syndrome,PCOS)的发病。Sayegh等[18]发现VDR、CY24A1和CYP27B1分布在子宫内膜异位症妇女的正常循环子宫内膜以及异位和异位子宫内膜中。Pospechova等[19]研究VDR在胎盘、人胎盘绒毛癌细胞BeWo和人绒毛膜滋养层细胞JEG-3的表达,发现VDR位于人胎盘滋养细胞中,并在分离的滋养细胞中表达,然而VDR在绒毛膜细胞系中表达低且无转录活性。Zhalehjoo等[20]通过比较正常乳腺组织和肿瘤组织中VDR mRNA和蛋白的表达水平发现,正常乳腺组织有VDR表达,肿瘤组织中VDR mRNA和蛋白表达明显高于癌旁正常组织。
3 VD3与雌性生育力
雌性生育力指雌性动物每个排卵周期妊娠的可能性,主要体现在雌性动物妊娠、产子、子代成活率3个方面,其中人类还涉及到体外受精。VD3对大鼠、小鼠和人类的雌性生育力具有重要影响。
VDR是活性VD3结合发挥其生物学作用的关键受体,CYP27B1基因是编码产生活性VD3的关键酶1α-羟化酶的基因。VDR和CYP27B1基因敲除小鼠是研究VD3与雌性生育的重要动物模型。Kinuta等[21]通过敲除小鼠VDR基因建立VDR缺失小鼠模型,发现VDR缺失小鼠性腺功能不足,雌性小鼠表现为子宫发育不良、卵泡发育受损、促黄体生成素和卵泡刺激素的血清含量升高,说明VDR是雌性小鼠维持正常生殖功能的重要因子;VDR缺乏小鼠卵巢芳香化酶基因表达量较低,芳香化酶活性降低,血清中雌二醇含量较低,说明VDR参与小鼠雌激素产生的调节并发挥着重要的作用。Yoshizawa等[22]发现,断奶前VDR基因敲除小鼠的生长发育正常,断奶后VDR基因敲除的小鼠不能正常生长发育,出现如发育不全、脱毛、低钙血症和不育症,证明VDR在雌性动物生殖中起重要的作用。Panda等[23]研究通过敲除VD3的关键酶1α-羟化酶的编码基因CYP27B1构建维生素D缺乏的动物模型,研究显示CYP27B1基因敲除小鼠断奶后出现低钙血症和不孕,子宫发育不全且缺乏黄体。
研究证实VD3对雌性大鼠生育力有重要影响。Halloran等[24]研究VD3缺乏对生育能力、生殖能力、胎儿和新生儿发育的影响,给刚断乳大鼠喂食缺乏VD3的食物一直喂至交配,发现VD3缺乏的雌性大鼠可以生育,然而与正常饲喂的大鼠相比,VD3缺乏雌性大鼠整体生育率降低了75%,产仔数减少了30%,哺乳期第6天到第15天的新生儿生长发育迟缓。Kwiecinksi等[25]发现,VD3缺乏导致雌性大鼠生育力大幅下降,而这与血清中的钙、磷含量无关。此外VD3缺乏对子代雌性小鼠的生殖也产生一定的影响,Nicholas等[26]通过对3组母鼠孕期、哺乳期喂食缺乏VD3的食物,研究了孕期VD3缺乏对子代生殖的影响,发现孕期VD3缺乏的小鼠其子代雌性小鼠的阴道开口时间推后,发情周期不规则,排卵过少。上述研究表明VD3对小鼠生育力具有非常重要的作用,然而也有一些研究认为VD3与生殖并没有直接关系。如Halloran等[27]通过给母鼠喂食维生素D缺乏的食物,其生产的仔鼠断奶后血浆中钙、磷浓度正常,发育正常,认为VD3及其代谢物与大鼠胎儿发育没有直接关系;Johnson等[28]通过给VDR基因敲除的小鼠饲喂高钙食物,发现雌性小鼠恢复正常的生殖能力,认为雌性小鼠的生殖与VD3无直接关系。造成这一分歧的主要原因是没有考虑血液中钙、磷和VD3代谢物的作用,另外血清和滤泡液中VD3水平对怀孕和子代活产率的影响仍不清楚。
VD3对女性生育力有重要影响,女性妊娠期25D3充足对其生殖有益,而25D3不足对其生殖会产生不利的影响。Kiely等[29]在爱尔兰一个大型的前瞻性队列研究发现,女性妊娠期血清中25D3浓度大于75 nmol/L时可降低子宫胎盘功能障碍的风险。Lepsch等[30]研究女性妊娠早期VD状态与妊娠期血脂变化的关系,证明了妊娠早期25D3不足导致怀孕期间血脂浓度升高,表明在怀孕初期补充并确保孕妇体内有足够的VD3以预防妊娠高血脂综合征非常重要。Tabatabaei等[31]发现加拿大孕妇VD3水平与早产风险之间呈现反比关系,VD3缺乏会导致胎儿早产风险增加,表明孕妇早期维生素D缺乏与加拿大妇女早产风险增加有关。然而,也有观点认为25D3状态与生殖无关。如Neville等[32]采用横向前瞻性研究显示,妊娠期和非妊娠期25D3无显著性差异(P=0.222)证明VD3与雌性生育无关。此外,孕妇补充VD3对其下一代有益,如Wolsk等[33]发现孕妇产前补充VD3可降低儿童患哮喘的风险。然而研究表明,25D3不足对下一代生长发育没有影响。Eggemoen等[34]研究多种族女性怀孕期间的维生素D水平与新生儿出生体重和身体组成的关系,发现在VD3缺乏的患病率高的孕妇中,母体VD3水平与任何一种新生儿出生体重和身体组成之间没有独立的关系。
VD3对女性生育力的影响还体现在体外受精方面,体内VD3水平直接影响到体外受精(in vitro fertilization,IVF)的成功率。Ozkan等[35]研究了25D3水平和IVF周期参数与结果的关系,发现血清和卵泡液25D3浓度较高的不育妇女体外受精更容易成功,受精卵容易着床并最终怀孕。Rudick等[36]发现VD3缺乏的捐卵者的卵母细胞经体外受精后,移入VD3健康的代孕者即受精卵接受者后其妊娠率正常,而VD3健康的捐卵者的卵母细胞经过体外受精后,移入VD3缺乏的代孕者即受精卵接受者后其妊娠率较低,表明VD3健康与否直接影响到体外受精的妊娠率,推测也许VD3通过子宫内膜发挥作用。Paffoni等[37]调查血清25D3水平低于20 ng/mL的女性,发现血清25D3水平最高的女性IVF后怀孕几率最高。Farzadi等[38]研究卵泡液中25D3水平和辅助生殖结果的关系,发现辅助生殖技术下可怀孕组卵泡液中25D3水平比非怀孕组显著升高。然而有一些观点认为VD3不影响IVF成功率。Lv等[39]发现,不孕妇女血清VD3水平的高低与其体外受精后的临床妊娠率差异没有显著相关性。Neville等人[32]采用横向前瞻性研究IVF/卵胞浆内单精子注射(ICSI)的男性和女性的维生素D状况,显示妊娠结果与男女双方的VD3状态没有相关性。造成这一分歧的主要原因是研究方法的问题,如研究的样本量较小,研究的样本具有特异性,如女性高度不育,研究设计存在差异,如前瞻性与回顾性设计等。
4 VD与雌激素
雌性生殖系统中存在着大量且复杂的信号通路,目前尚且没有较为明确的特征或者机制能够评价雌性生殖系统生长、发育、孕育的过程。雌激素分为两大类,即雌性激素和孕激素。其中雌性激素包括雌酮、雌二醇等,主要为雌二醇,由卵巢颗粒细胞产生。孕激素包括黄体酮、异炔诺酮、甲炔诺酮、已酸孕酮等,主要为孕酮即黄体酮,由卵巢的黄体细胞产生。另外女婴胚胎期产生一定数量的原始卵泡,出生后原始卵泡数量不再增加,女性卵巢皮质内含有的原始卵泡被称为卵巢储备。近年研究表明卵巢的颗粒细胞产生的抗苗勒管激素(Anti-Mullerian hormone,AMH)作为新的卵巢储备标志物对雌性生殖也有非常重要的影响[40]。
雌二醇是一种甾体雌激素,主要由卵巢成熟滤泡分泌,能增进和调节雌性生殖器官及副性征的正常发育。细胞色素P450是卵巢雌激素包括雌二醇生成过程中的重要酶,由CYP19编码。Kinuta等[21]研究发现,VDR敲除的雌性小鼠中CYP19的表达受抑制,细胞色素P450活性降低,导致雌激素缺乏,这表明VD3可调控雌激素的生成。Potashnik等[41]研究卵巢刺激体外受精-胚胎移植过程中内源性雌二醇与血清及卵泡液中的VD3水平之间的关系时发现,雌二醇增加时,血清中VD3水平也增加,而VD3的其他代谢产物如25D3、1α24,25(OH)2D3、24,25(OH)2D3并没有变化;首次发现卵泡液中也存在VD3代谢产物,当雌二醇增加时卵泡液中VD3代谢产物也有所变化,因此在促性腺激素诱导的卵巢刺激时提高循环雌二醇含量可显著增加血清中1,25D3水平。然而也有不同的观点,Merhi等[42]研究维生素D改变参与人卵巢颗粒细胞滤泡发育和类固醇生成的基因,通过收集女性滤泡中的颗粒细胞进行培养,发现培养液中VD3增加时雌二醇的产生没有变化,造成这种观点差异的原因可能是由于滤泡中VD3代谢物的影响。另外朱建林[43]通过添加不同梯度浓度VD3体外培养卵巢颗粒细胞,发现VD3对雌二醇的分泌产生抑制作用,且随VD3浓度增加抑制作用更加明显,这表明VD3对雌性生殖的性腺毒性作用。
孕激素(progesterone)由卵巢的黄体细胞生成,主要为孕酮,是一种促进和维持妊娠的类固醇激素。Thangamani等[44]研究表明孕酮直接上调T细胞中VDR基因的表达,增加T细胞对1,25D3的敏感性,从而调节1,25D3在T细胞中的作用,这对于防止妊娠期间的不良免疫反应有重要影响。Kim C H等[45]发现孕酮直接上调T细胞中VDR基因的表达,这一发现提示可将孕酮与1,25D3的功能相结合,两种激素协同作用可对免疫系统进行连续和有效的调节。Hong等[46]从猪卵巢中分离出颗粒细胞,进行实时定量PCR和蛋白免疫印迹分析,结果显示VD3显著改变颗粒细胞中孕酮生物合成相关基因的转录和翻译,ELISA检测猪颗粒细胞培养基中的孕酮浓度随VD3的反应降低,表明VD3通过调节类固醇生成酶从而影响猪卵巢颗粒细胞的孕酮分泌。Merhi等[42]培养女性滤泡中的颗粒细胞,发现VD3增加孕酮生成酶(3β-hydroxysteroid dehydrogenase,3β-HSD)的mRNA水平,表明VD3可通过提高3β-HSD的活性而增加孕酮的释放。
抗苗勒管激素(Anti-Mullerian hormone,AMH)属于转化生长因子β家族成员,是一种二聚糖蛋白,由围绕雌性动物卵泡的颗粒细胞产生,主要功能是调控胚胎的性别分化。Xu等[47]分离恒河猴卵巢的卵泡细胞进行离体培养,将卵泡随机分配到对照组、低剂量VD3(LVD3,25 pg/mL)和高剂量VD3(HVD3,100 pg/mL),结果显示第5周时LVD3组的AMH浓度比HVD3高36%,低剂量VD3上调AMH mRNA表达,表明1,25D3补充促进卵母细胞离体培养时的卵泡发育。Dennis等[48]研究发现血清25D3与AMH呈季节性变化,冬季AMH水平与夏季相比减少18%(P≤0.01),血清AMH与25D3呈正相关表明VD3补充防止季节性AMH变化。Merhi等[42]体外培养女性卵巢颗粒细胞发现,VD3含量升高时AMH受体mRNA表达降低,说明VD3下调AMH的作用。然而Chang等[49]的一个样本量为70的横向研究显示,血清VD3水平与AMH水平无关。造成这种差异的原因可能是没有考虑滤泡液中VD3代谢物对结果的影响及横向研究设计的局限性。后续研究应排除季节引起的变化,同时兼顾卵泡液和血清中VD3代谢物对AMH的影响。
5 结语和展望
VDR在雌性生殖系统的存在以及VD3对雌性生育力,雌激素的影响等证据表明VD3在雌性生殖中的作用非常重要,但部分研究认为VD3对雌性生殖没有直接的影响,这种分歧在VD3与雌性激素以及AMH的研究中被进一步放大。造成这种分歧的主要原因可能有,一是在啮齿类动物的研究中,未能排除一些影响因素,如没有考虑VD3的性腺毒性,VD3对血液中钙、磷和VD3代谢物的作用等;二是可能研究设计存在差异,样本量较小,选择的样本具有特异性,这部分主要体现在对女性生殖方面,如选择研究的女性高度不育;三是没有考虑VD3或是其代谢物不仅直接参与雌性生殖,在雌性生殖系统大量复杂信号通路的上游是否有作用,值得我们进一步研究。总之,VD3与雌性生殖是近年研究的热点,然而VD3在雌性生殖系统大量复杂的信号通路中究竟扮演怎样的角色还需要进一步深入的研究。
[参考文献]
[1] JOHNSON J A,GRANDE J P,ROCHE P C,et al.Immunohistochemical detection and distribution of the 1,25-dihydroxyvitamin D3receptor in rat reproductive tissues[J].Histochem Cell Biol,1996,105(1):7-15.
[2] NANDI A,SINHA N,ONG E,et al.Is there a role for vitamin D in human reproduction[J].Horm Mol Biol Clin Investig,2016,25(1):15-28.
[3] SAKAKI T.Recent studies on vitamin D metabolizing enzymes[J].Clin Calcium,2006,16(7):1129-1135.
[4] ZHU J,DELUCA H F.Vitamin D 25-hydroxylase-Four decades of searching,are we there yet?[J].Arch Biochem Biophys,2012,523(1):30-36.
[5] 何琳琳,兰飞,徐欢,等.维生素D3与雄性生殖[J].生理科学进展,2015(5):334-340.
[6] NORMAN A W.Minireview:vitamin D receptor:new assignments for an already busy receptor[J].Endocrinology,2006,147(12):5542-5548.
[7] HII C S,FERRANTE A.The Non-Genomic Actions of Vitamin D[J].Nutrients,2016,8(3):135.
[8] LOPES N,SOUSA B,MARTINS D,et al.Alterations in Vitamin D signalling and metabolic pathways in breast cancer progression:a study of VDR,CYP27B1 and CYP24A1 expression in benign and malignant breast lesions[J].BMC Cancer,2010(10):483.
[10] YILDIRIM B,ABBAN G,ERDOGAN B S.Immunohistochemical detection of 1,25-dihydroxyvitamin D receptor in rat vaginal epithelium[J].Fertil Steril,2004,82(6):1602-1608.
[11] YILDIRIM B N,METE G A,ROTA S,et al.Immunohistochemical Detection and Distribution of Cornifin Alpha and Vitamin D Receptor Expression in Vaginal Epithelium Treated with Vitamin D3[J].Journal of the Turkish German Gynecological Association,2007,8(1):33-37.
[12] ZARNANI A H,SHAHBAZI M,SALEK-MOGHADDAM A,et al.Vitamin D3receptor is expressed in the endometrium of cycling mice throughout the estrous cycle[J].Fertil Steril,2010,93(8):2738-2743.
[13] TAVERA-MENDOZA L E,WESTERLING T,LIBBY E,et al.Vitamin D receptor regulates autophagy in the normal mammary gland and in luminal breast cancer cells[J].Proc Natl Acad Sci,2017,114(11):2186-2194.
[14] SHAHBAZI M,JEDDI-TEHRANI M,ZAREIE M,et al.Expression profiling of vitamin D receptor in placenta,decidua and ovary of pregnant mice[J].Placenta,2011,32(9):657-664.
[15] KIM T H,LEE H H,PARK J.Immunohistochemical detection of the 1,25-dihydroxy vitamin D receptor in the human vagina[J].Iranian Journal of Reproductive Medicine,2014,12(12):805-810.
[16] 张纯,朱伟杰,徐建平.维生素D受体蛋白及其mRNA在人输卵管黏膜上皮的表达[J].暨南大学学报(自然科学与医学版),2009,30(2):170-175.
[17] RANJZAD F,MAHBAN A,SHEMIRANI A I,et al.Influence of gene variants related to calcium homeostasis on biochemical parameters of women with polycystic ovary syndrome[J].J Assist Reprod Genet,2011,28(3):225-232.
[18] SAYEGH L,GEL-H F,NASSAR A H.Vitamin D in endometriosis:a causative or confounding factor[J].Metabolism,2014,63(1):32-41.
[19] POSPECHOVA K,ROZEHNAL V,STEJSKALOVA L,et al.Expression and activity of vitamin D receptor in the human placenta and in choriocarcinoma BeWo and JEG-3 cell lines[J].Mol Cell Endocrinol,2009,299(2):178-187.
[20] ZHALEHJOO N,SHAKIBA Y,PANJEHPOUR M.Alterations of Vitamin D Receptor(VDR)Expression Profile in Normal and Malignant Breast Tissues[J].Clin Lab,2016,62(8):1461-1468.
[21] KINUTA K,TANAKA H,MORIWAKE T,et al.Vitamin D is an important factor in estrogen biosynthesis of both female and male gonads[J].Endocrinology,2000,141(4):1317-1324.
[22] YOSHIZAWA T,HANDA Y,UEMATSU Y,et al.Mice lacking the vitamin D receptor exhibit impaired bone formation,uterine hypoplasia and growth retardation after weaning[J].Nat Genet,1997,16(4):391-396.
[23] PANDA D K,MIAO D,TREMBLAY M L,et al.Targeted ablation of the 25-hydroxyvitamin D 1alpha-hydroxylase enzyme:evidence for skeletal,reproductive,and immune dysfunction[J].Proc Natl Acad Sci,2001,98(13):7498-7503.
[24] HALLORAN B P,DELUCA H F.Effect of vitamin D deficiency on fertility and reproductive capacity in the female rat[J].J Nutr,1980,110(8):1573-1580.
[25] KWIECINKSI G G,PETRIE G I,DELUCA H F.1,25-Dihydroxyvitamin D3restores fertility of vitamin D-deficient female rats[J].Am J Physiol,1989,256(1):483-487.
[26] NICHOLAS C,DAVIS J,FISHER T,et al.Maternal Vitamin D Deficiency Programs Reproductive Dysfunction in Female Mice Offspring Through Adverse Effects on the Neuroendocrine Axis[J].Endocrinology,2016,157(4):1535-1545.
[27] HALLORAN B P,DELUCA H F.Vitamin D deficiency and reproduction in rats[J].Science,1979,204(4388):73-74.
[28] JOHNSON L E,DELUCA H F.Vitamin D receptor null mutant mice fed high levels of calcium are fertile[J].J Nutr,2001,131(6):1787-1791.
[29] KIELY M E,ZHANG J Y,KINSELLA M,et al.Vitamin D status is associated with uteroplacental dysfunction indicated by pre-eclampsia and small-for-gestational-age birth in a large prospective pregnancy cohort in Ireland with low vitamin D status[J].American Journal of Clinical Nutrition,2016,104(2):354-361.
[30] LEPSCH J,ESHRIQUI I,FARIAS D R,et al.Association between early pregnancy vitamin D status and changes in serum lipid profiles throughout pregnancy[J].Metabolism,2017,70:85-97.
[31] TABATABAEI N,AUGER N,HERBA C M,et al.Maternal Vitamin D Insufficiency Early in Pregnancy Is Associated with Increased Risk of Preterm Birth in Ethnic Minority Women in Canada[J].J Nutr,2017,147(6):1145-1151.
[32] NEVILLE G,MARTYN F,KILBANE M,et al.Vitamin D status and fertility outcomes during winter among couples undergoing in vitro fertilization/intracytoplasmic sperm injection[J].Int J Gynaecol Obstet,2016,135(2):172-176.
[33] WOLSK H M,HARSHFIELD B J,LARANJO N,et al.Vitamin D supplementation in pregnancy,prenatal 25(OH)D levels,race,and subsequent asthma or recurrent wheeze in offspring:Secondary analyses from the Vitamin D Antenatal Asthma Reduction Trial[J].J Allergy Clin Immunol,2017,140(5):1423-1429.
[34] EGGEMOEN Å R,JENUM A K,MDALA I,et al.Vitamin D levels during pregnancy and associations with birth weight and body composition of the newborn:a longitudinal multiethnic population-based study[J].Br J Nutr,2017,117(7):985-993.
[35] OZKAN S,JINDAL S,GREENSEID K,et al.Replete vitamin D stores predict reproductive success following in vitro fertilization[J].Fertil Steril,2010,94(4):1314-1319.
[36] RUDICK B J,INGLES S A,CHUNG K,et al.Influence of vitamin D levels on in vitro fertilization outcomes in donor-recipient cycles[J].Fertil Steril,2014,101(2):447-452.
[37] PAFFONI A,FERRARI S,VIGANP,et al.Vitamin D deficiency and infertility:insights from in vitro fertilization cycles[J].J Clin Endocrinol Metab,2014,99(11):2372-2376.
[38] FARZADI L,KHAYATZADEH B H,GHOJAZADEH M,et al.Correlation between follicular fluid 25-OH vitamin D and assisted reproductive outcomes[J].Iran J Reprod Med,2015,13(6):361-366.
[39] LV S S,WANG J Y,WANG X Q,et al.Serum vitamin D status and in vitro fertilization outcomes:a systematic review and meta-analysis[J].Arch Gynecol Obstet,2016,293(6):1339-1345.
[40] 文娅,王华伟,速存梅,等.抗苗勒管激素在生殖内分泌诊断中的临床价值及应用前景[J].现代妇产科进展,2016,25(11):874-876.
[41] POTASHNIK G,LUNENFELD E,LEVITAS E,et al.The relationship between endogenous oestradiol and vitamin D3metabolites in serum and follicular fluid during ovarian stimulation for in-vitro fertilization and embryo transfer[J].Hum Reprod,1992,7(10):1357-1360.
[42] MERHI Z,DOSWELL A,KREBS K,et al.Vitamin D alters genes involved in follicular development and steroidogenesis in human cumulus granulosa cells[J].J Clin Endocrinol Metab,2014,99(6):1137-1145.
[43] 朱建林.维生素D3的雌性性腺毒性及其机制的研究[D].福州:福建医科大学,2009.
[44] THANGAMANI S,KIM M,SON Y,et al.Cutting edge:progesterone directly upregulates vitamin d receptor gene expression for efficient regulation of T cells by calcitriol[J].Journal of Immunology,2015,194(3):883-886.
[45] KIM C H.A functional relay from progesterone to vitamin D in the immune system[J].DNA Cell Biol,2015,34(6):379-382.
[46] HONG S H,LEE J E,KIM H S,et al.Effect of vitamin D3on production of progesterone in porcine granulosa cells by regulation of steroidogenic enzymes[J].J Biomed Res,2016,30(3):203-208.
[47] XU J,HENNEBOLD J D,SEIFER D B.Direct vitamin D3actions on rhesus macaque follicles in three-dimensional culture:assessment of follicle survival,growth,steroid,and antimüllerian hormone production[J].Fertil Steril,2016,106(7):1815-1820.
[48] DENNIS N A,HOUGHTON L A,JONES G T,et al.The level of serum anti-Müllerian hormone correlates with vitamin D status in men and women but not in boys[J].J Clin Endocrinol Metab,2012,97(7):2450-2455.
[49] CHANG E M,KIM Y S,WON H J,et al.Association between sex steroids,ovarian reserve,and vitamin D levels in healthy nonobese women[J].J Clin Endocrinol Metab,2014,99(7):2526-2532.

