低分子量胶原蛋白肽交叉苦瓜素辅助降低糖尿病小鼠血糖作用特性
欧爱宁,段 东,王 婷,张静怡,郭锐华,吴文惠,2,包 斌,*
(1.上海海洋大学食品学院,上海 201306; 2.上海水产品加工及贮藏工程技术研究中心,上海 201306)
糖尿病(Diabetes Mellitus,DM)是继心脑血管疾病和癌症之后危害人类健康的第三大疾病,被世界卫生组织称之为“21 世纪的灾难”。我国已有近5亿人口患有前驱糖尿病[1],其中Ⅱ型糖尿病占临床病例的90%以上。胰岛B细胞缺陷导致胰岛素分泌不足引起高血糖是形成糖尿病的原因之一[2]。目前,用于糖尿病临床治疗的降血糖化学药物主要有二甲双胍JP2、格列本脲、瑞格列奈、阿卡波糖、罗格列酮等,长期服用,会导致患者身体产生耐药性,甚至引起低血糖等多种毒副作用[3-4]。因此,开发新型、高效低毒促进胰岛素分泌的药物成为生物医药领域关注的热点。
研究发现,胶原蛋白Ⅰ型和Ⅲ型在中期和晚期糖尿病大鼠的大血管中显著增加,中药组方加味桃核承气汤被证实能有效降低致纤维化因子胶原蛋白在糖尿病大鼠大血管病变中的表达,从而起到改善糖尿病大血管弹性的作用,这表明糖尿病大血管病变可能与胶原蛋白有关[5]。胶原蛋白多肽-铬(Ⅲ)螯合物经口投与小鼠,其IgG抗体增加、细胞因子IL-2和TNF-α分泌增强、IL-6的分泌降低,胶原蛋白多肽-铬(Ⅲ)螯合物被证明具有活化免疫细胞、恢复和改善小鼠机体的免疫功能的作用,促进肝糖原的合成和糖尿病小鼠体内的葡萄糖磷酸化[6-7]。胶原蛋白多肽-铬(Ⅲ)螯合物可降低糖尿病小鼠血糖,目前国内外关于胶原蛋白肽与糖尿病降血糖关系的研究只局限于全分子量的胶原蛋白肽,而对于低分量的胶原蛋白肽交叉苦瓜素辅助降血糖方面的研究还是一片空白。
本研究首次采用海洋生物低分子量胶原蛋白肽交叉植物提取物苦瓜素灌胃糖尿病小鼠,通过形态学观察以及对血糖、脏器指数、葡萄糖耐受量和肝脏组织抗氧化能力的测定,研究低分子量胶原蛋白肽交叉苦瓜素对四氧嘧啶诱导的实验性糖尿病小鼠的降血糖作用,并探讨其可能的降血糖途径。
1 材料与方法
1.1 材料与仪器
石斑鱼骨胶原蛋白肽(Collagenpeptide of Epinephelussp,GBB-10SP)(相对分子质量为800~1000 Da占90%以上)、罗非鱼皮胶原蛋白肽(Collagenpeptide of Oreochromis mossambicus,TYPE-S)(相对分子质量为800~1000 Da占90%) 实验室自制;苦瓜素(Momordicacharantiaextracts,MCE) 含量10%,西安天宝生物科技有限公司;四氧嘧啶 东京化成工业株式会社;丙二醛试剂盒、超氧化物歧化酶试剂盒 南京建成生物工程研究所;ICR雌性小鼠 72只,清洁级,四周龄,许可证号SCXK(沪)2013~0006,14~16 g,自然昼夜,自由进水,分笼饲养,上海杰思捷实验动物有限公司。
-80 ℃超低温冷冻冰箱 海尔股份有限公司;Mcroplate Reader SH-1000酶标仪 Corona Electric Co.,Ltd;三诺血糖试纸 三诺生物传感器股份有限公司。
1.2 实验方法
1.2.1 GBB-10SP及TYPE-S的制备 参照文献[8-9]的方法进行制备。原料用磷酸氢二钠(10 mmol/L pH7.4~7.6)缓冲液浸泡冲洗,切成小块,再用水冲洗。清洗干净的原料进行组织溶胀和脱脂,用0.1 mol/L NaOH在室温下浸泡3 d,用水充分清洗碱处理后的原料,至pH6.5~7.5。用胃蛋白酶醋酸缓冲液在4 ℃进行限制性酶解24 h,3000 r/min 离心收集上清,沉淀在上述的条件再次酶解。合并两次酶解液,10000 r/min离心30 min,取上清,于去离子水中透析,3 h更换一次透析水,直至透析水pH为中性。经透析的胶原蛋白液减压浓缩之后,得到胶原蛋白浓缩液。再通过胰蛋白酶酶解,pH维持在8左右,水解温度为47 ℃,酶解60 min,分离纯化后,得到相对分子量800~1000 Da的胶原蛋白肽。
1.2.2 小鼠糖尿病模型的建立 健康雌性ICR小鼠72只,适应性喂养1周,随机取8只作空白对照组,其余64只腹腔注射四氧嘧啶180 mg/(kg·bw)(四氧嘧啶临用前用生理盐水配制),空白对照组小鼠注射等量的生理盐水,3 d后断尾取血,血糖仪测定空腹血糖,血糖≥11.1 mmol/L[10-11]的动物用于实验。
1.2.3 小鼠的降血糖实验 依据体重与血糖均衡原则随机分为8组,每组8只,分为模型组(0.86%生理盐水)、阳性对照组(二甲双胍,1 mg/kg·bw/d)、低剂量GBB-10SP交叉苦瓜素处理组(LGinterMCE,3.6 g/kg·bw/d)、中剂量GBB-10SP交叉苦瓜素处理组(MGinterMCE,10.8 g/kg·bw·d)、高剂量GBB-10SP交叉苦瓜素处理组(HGinterMCE,18 g/kg·bw/d)、低剂量TYE-S交叉苦瓜素处理组(LTinterMCE,3.6 g/kg·bw/d)、中剂量TYPE-S 交叉苦瓜素处理组(MTinterMCE,10.8 g/kg·bw·d)、高剂量TYPE-S 交叉苦瓜素处理组(HTinterMCE,18 g/kg·bw/d)。
对DM小鼠前15 d分别灌胃GBB-10SP和TYPE-S,第16 d开始灌胃苦瓜素,其中模型组B及对照组A给予等体积的生理盐水灌胃,各组连续给药28 d。
1.2.4 形态学观察指标 实验期间每天观察记录小鼠的进食状况、皮毛、精神状况、排尿量及其体重变化。
1.2.5 血糖检测方法 各组小鼠连续喂养28 d,将9组小鼠只禁食不禁水过夜,于次日早上8:00 尾静脉取血用快速血糖仪测定小鼠空腹血糖值,每隔4 d检测一次,计算血糖下降百分率。
血糖下降百分率(%)=(实验前血糖值-实验后血糖值)/实验前血糖值×100
1.2.6 脏器指数检测方法 实验第28 d,麻醉处死小鼠,解剖,取小鼠脾脏、肝脏、肾脏称湿重,其肝脏、肾脏和脾脏,肉眼观察有无病变,用冷生理盐水冲洗,滤纸吸干残留水分,称重,计算肝脏指数、肾脏指数、脾脏指数。计算公式为:

1.2.7 葡萄糖耐量检测方法 DM小鼠给药21 d 后,禁食过夜,于次日早上8:00给药,60 min后再灌胃给予50 mmol/kg 葡萄糖,用快速血糖测定仪测定小鼠灌胃前(0 min)、灌胃后30、120 min的血糖值,并计算葡萄糖耐量曲线下面积(Area Under Curve,AUC)。
AUC=(X0+4×X30+3×X120)/4
注:X0表示灌胃前(0 min)血糖值;X30表示灌胃后30 min血糖值;X120表示灌胃后120 min血糖值。
1.2.8 肝组织抗氧能力检测方法 实验第28 d,麻醉处死小鼠,解剖取小鼠肝脏,用10%的生理盐水清洗去血渍和剪除其他结缔组织,称重,剪碎加入9倍体积0.86%生理盐水,匀浆,离心(2500 r/min,10 min)后取上清液,用丙二醛试剂盒和超氧化物歧化酶试剂盒测定MDA含量(nmol/mg prot)和SOD活力(U/mg prot)。
1.3 数据处理
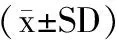
2 结果与分析
2.1 胶原蛋白肽交叉苦瓜素处理对DM小鼠生活状态的影响
观察DM小鼠每天的生活状态(表1)。空白对照组小鼠毛色光亮,活动频繁,模型组小鼠毛发枯黄,光泽度下降,精神萎靡,多尿;给予胶原蛋白肽交叉苦瓜素DM小鼠处理比阳性对照组小鼠毛色光泽度高,小鼠活动更为频繁,垫料相对更为干燥。
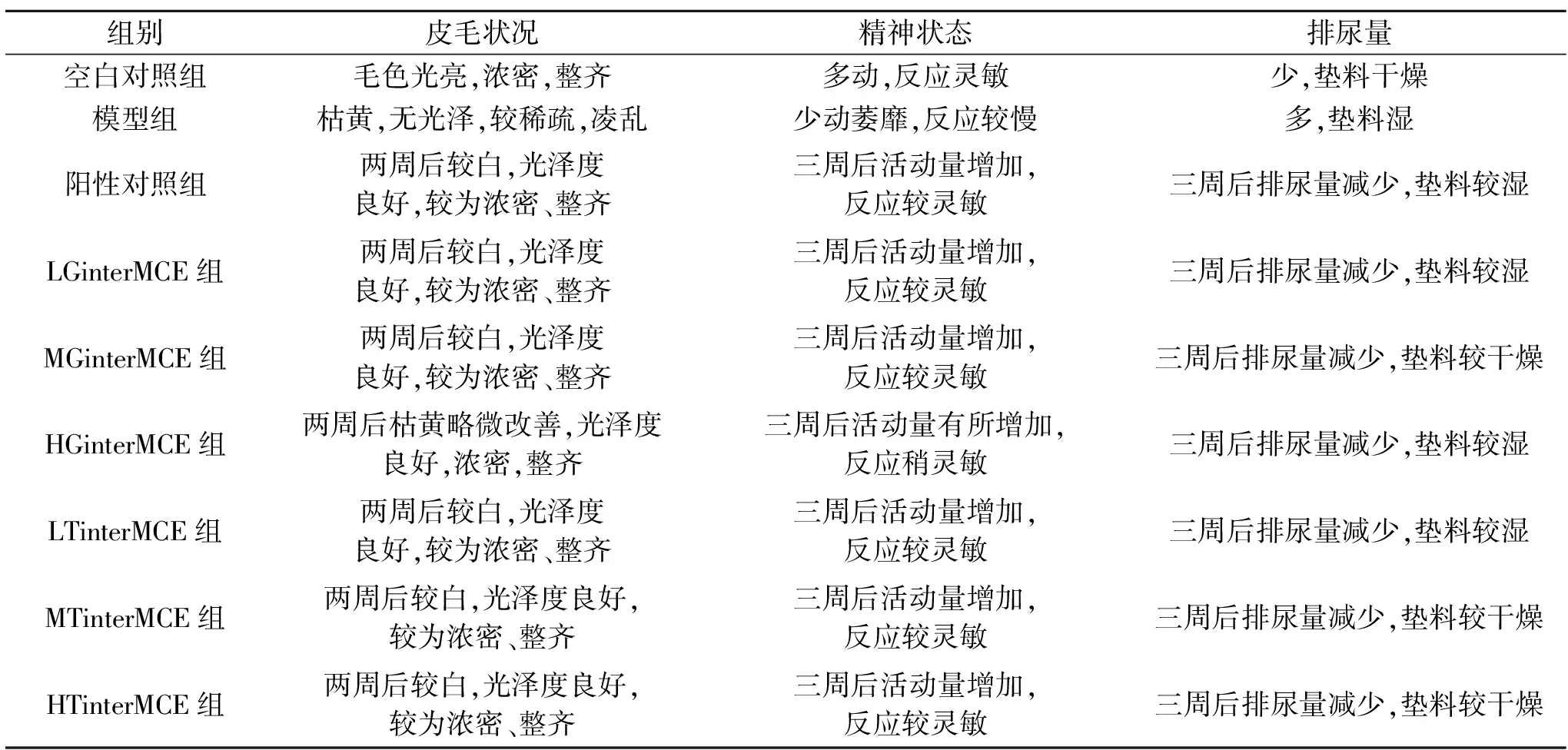
表1 胶原蛋白肽交叉苦瓜素处理对DM小鼠生活状态的影响Table 1 Effect of collagen peptide intersecting Momordica charantia extracts treatment on life status of DM mice
2.2 胶原蛋白肽交叉苦瓜素对DM小鼠生长的影响
糖尿病小鼠模型建立成功后,给予胶原蛋白肽处理DM小鼠16 d(图1),对照组小鼠体重随时间呈现缓慢增加趋势;模型组 DM 小鼠在前4 d体质量整体下降,由最初的24.87 g下降至23.97 g,无显著性差异,随后体重增加;阳性对照组小鼠体重增加,LGinterMCE组小鼠前4 d体重下降,随后上升呈显著性差异(p<0.05),其他组体重均上升。第16 d时TYPE-S处理组小鼠体重比阳性对照组略高0.5~2.4 g,比模型组低0.6~2.5 g。GBB-10SP处理组小鼠体重比阳性对照组略低。第16 d后给予苦瓜素处理,24 d后糖尿病小鼠体重变化不明显,经过胶原蛋白肽交叉苦瓜素治疗后糖尿病小鼠的体重趋向稳定,表明给药处理后糖尿病损伤机体逐渐修复。
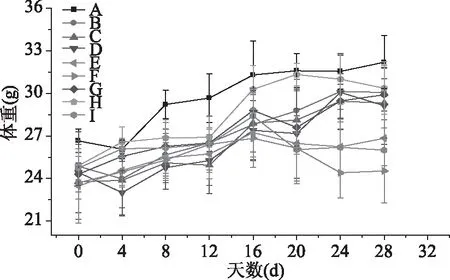
图1 胶原蛋白肽和苦瓜素对DM小鼠体重的影响Fig.1 Effect of collagen peptide and Momordica charantia extracts on body weight of DM mice注:A:空白对照组;B:模型组;C:阳性对照组; D:LGinterMCE组;E:MGinterMCE组;F:HGinterMCE组; G:LTinterMCE组;H:MTinterMCE组; I:HTinterMCE组;图2~图3同。
经测定小鼠每天平均进食量如图2所示,在灌胃胶原蛋白肽时期,空白组和DM小鼠在0~4 d进食量均下降,原因可能为血糖较高影响糖尿病小鼠进食。4~8 d后小鼠进食量平缓增加,12~16 d小鼠进食量剧增(除F组外)。在第16 d 时,LGinterMCE组、HGinterMCE组和MTinterMCE组小鼠进食量分别高于阳性对照组:2.5、4.83和1.8 g,且高于模型组,表明胶原蛋白处理组可调节糖尿病的进食,促进机体机能的修复,且效果由于阳性对照组。给予苦瓜素阶段,DM小鼠进食量波浪型,与苦瓜素性味苦寒影响小鼠食欲有关。
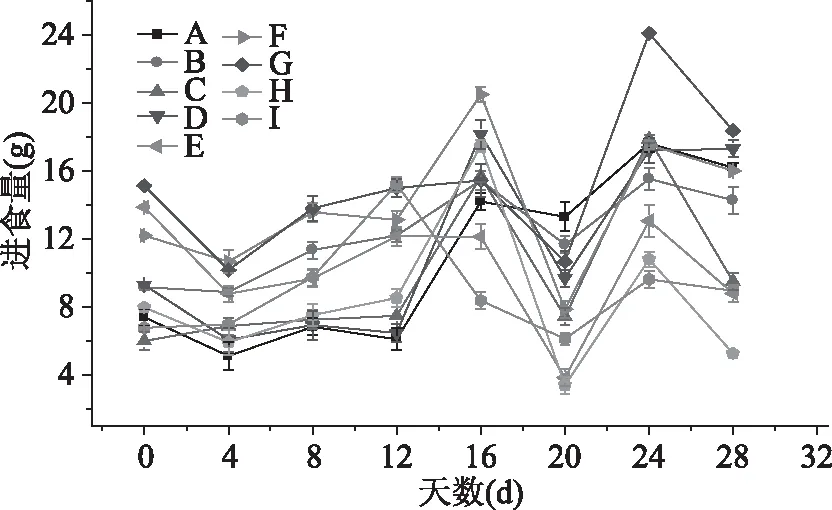
图2 胶原蛋白肽和苦瓜素对DM小鼠进食量的影响Fig.2 Effect of collagen peptide and Momordica charantia extracts on diet of DM mice
2.3 胶原蛋白肽交叉苦瓜素处理对DM小鼠血糖的影响
检测胶原蛋白肽处理阶段和苦瓜素处理阶段不同处理组的小鼠血糖值,结果见表2。
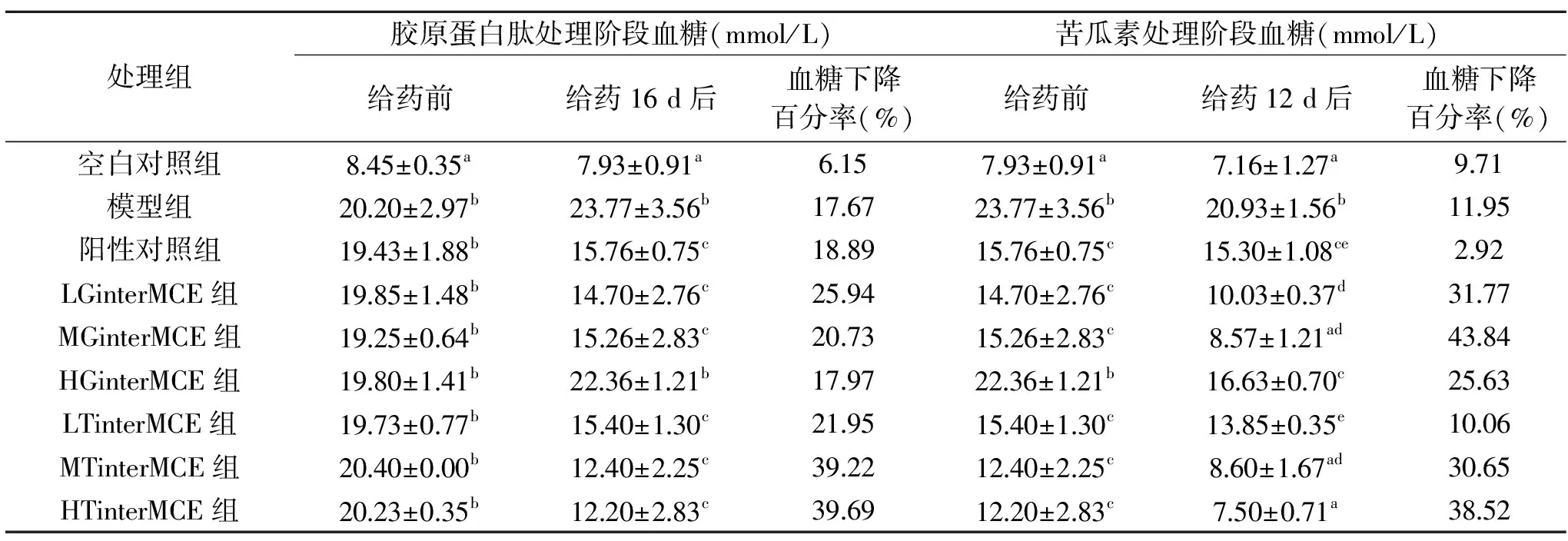
表2 胶原蛋白肽交叉苦瓜素对DM小鼠空腹血糖的影响(n=8)Table 2 Effect of collagen peptide intersecting Momordica charantia extracts on fasting blood glucose in diabetic mice(n=8)
与空白对照组相比,糖尿病小鼠血糖值显著升高,且均高于11.1 mmol/L,但组间无明显差异(p>0.05),表明造模成功。在胶原蛋白肽处理阶段,LTinterMCE组、MTinterMCE组、HTinterMCE组血糖下降百分率为:21.95%、39.22%、39.69%,高于阳性对照组和GBB-10SP处理组。表明TYPE-S胶原蛋白肽降血糖效果优于GBB-10SP;在苦瓜素处理阶段,LGinterMCE组、MGinterMCE组、HGinterMCE组苦瓜素处理血糖下降百分率31.77%、43.84%、25.63%优于GBB-10SP处理25.94%、20.73%、17.97%,表明对MGinterMCE、HTinterMCE组苦瓜素处理降血糖效果优于GBB-10SP与TYPE-S胶原蛋白肽。MGinterMCE组在苦瓜素处理阶段降血糖显著高于HTinterMCE组,可能是由胶原蛋白肽处理阶段,过高剂量的胶原蛋白处理扰乱小鼠机体代谢水平,糖尿病机体损伤加重,后期用苦瓜素治疗时,机体修复缓慢,作用效果弱于MGinterMCE组,而TYPE-S交叉苦瓜素组降血糖效果呈剂量关系,表明不同来源胶原蛋白肽降血糖作用具有差异性。
2.4 胶原蛋白肽交叉苦瓜素处理对DM小鼠葡萄糖耐量的影响
检测胶原蛋白肽交叉苦瓜素处理21 d,对DM小鼠口服葡萄糖耐量结果见表3。

表3 胶原蛋白肽交叉苦瓜素处理对DM小鼠糖耐量的影响(n=8)Table 3 Effects of collagen peptide intersecting Momordica charantia extracts treatment on glucose tolerance of DM mice(n=8)
在各组小鼠灌胃给予葡萄糖后,30 min血糖值相对于0 min血糖值急剧升高,经过120 min后血糖值有所降低。同正常组相比,模型组与给药组的葡萄糖耐量下降趋势平缓。在0、30、120 min时各给药组小鼠血糖值均低于模型组小鼠,给药组与模型组具有差异显著性(p<0.05)。给药组血糖值120 min后均恢复至灌胃前血糖值以下。MGinterMCE组、MTinterMCE组、HTinterMCE组、阳性组与模型组AUC分别为:32.03、32.45、32.87、36.28和61.78 mmol/(min·L),前四组和模型组相比具有显著性差异(p<0.05),MGinterMCE组、MTinterMCE、HTinterMCE组与阳性组和模型组对比糖耐量曲线下面积减小。表明胶原蛋白肽交叉苦瓜素处理能抑制糖尿病小鼠餐后血糖升高,并显著增强糖尿病小鼠葡萄糖负荷糖耐量,推测出胶原蛋白肽交叉苦瓜素处理可以修复糖尿病小鼠胰岛β细胞损伤。
2.5 胶原蛋白肽交叉苦瓜素处理对DM小鼠肝组织抗氧化能力的影响
胶原蛋白肽交叉苦瓜素处理对DM小鼠肝组织的SOD活性及MDA含量检测结果见表4。

表4 胶原蛋白肽交叉苦瓜素对DM小鼠肝组织抗氧化能力的影响(n=8)Table 4 Effect of collagen peptide intersecting Momordica charantia xtracts on antioxidant capacity of liver tissue of DM mice(n=8)
SOD酶能把过氧化物催化生成过氧化氢和氧气,从而消除机体内的超氧阴离子。因超氧化物歧化酶是生物体内唯一能催化超氧化物歧化的生物酶,所以SOD酶活性已经作为评价药物抗氧化能力的重要指标[12-13]。丙二醛的含量的多少直接反映了机体氧化损伤的程度[14-15]。
从表4中可以看出,模型组体内SOD活性57.63 U/mg prot低于对照组101.48 U/mg prot呈显著性差异(p<0.05),而MDA7.39 nmol/mg prot高于对照组3.67 nmol/mg prot呈显著性差异(p<0.05)。经胶原蛋白肽交叉苦瓜素处理后,SOD活性均提高,MDA含量显著降低,LGinterMCE组、MGinterMCE组、HGinterMCE组与阳性对照组SOD活性呈显著性差异(p<0.05),MGinterMCE组SOD活性较高为154.72U/mg prot,MDA含量较低为1.66 nmol/mg prot,LGinterMCE组SOD活性显著高于正常组,MDA 含量低于正常组,表明经LGinterMCE组处理后促进鼠机内肝组织修复和提高抗氧化作用显著,HGinterMCE组SOD活性较低与前面过高剂量的胶原蛋白肽无降血糖作用一致,可能是过高剂量使机体代谢失衡,肝组织损伤导致。LTinterMCE组、MTinterMCE组、HTinterMCE组SOD活性高于阳性组呈显著性,MDA含量均低于阳性组呈显著性差异(p<0.05)。表明胶原蛋白肽交叉苦瓜素处理可提高糖尿病小鼠肝组织的抗氧化能力,推测出胶原蛋白肽交叉苦瓜素处理对糖尿病小鼠肝脏损伤具有能力。
2.6 胶原蛋白肽交叉苦瓜素处理对DM小鼠脏器指数的影响
胶原蛋白肽交叉苦瓜素处理对DM小鼠肝脏、肾脏、脾脏指数测定结果见表5。
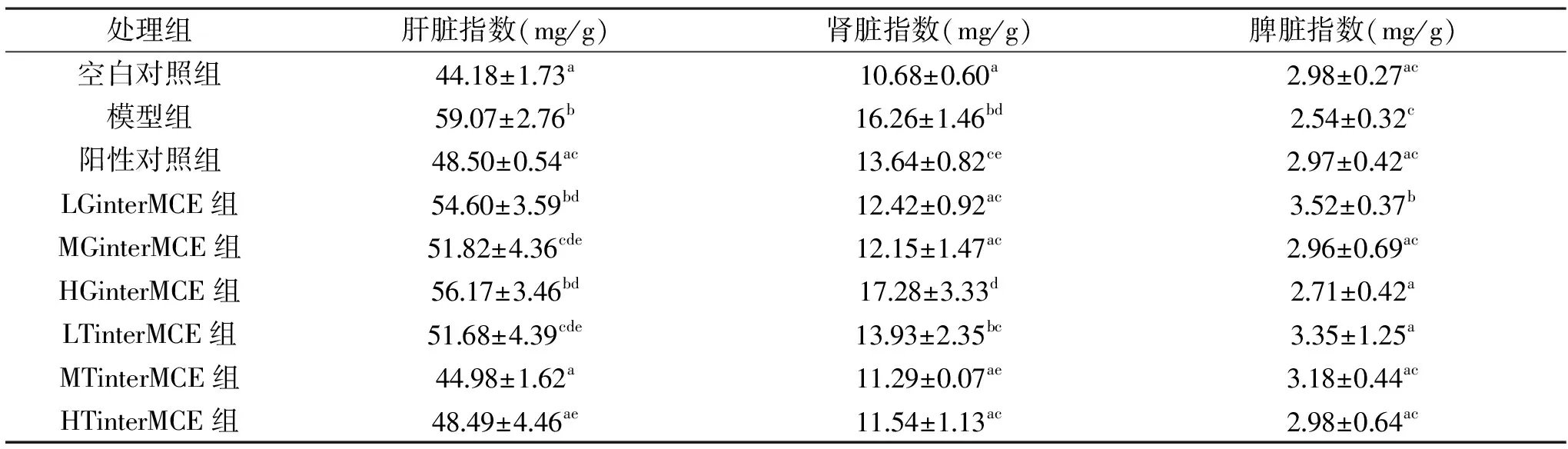
表5 胶原蛋白肽交叉苦瓜素处理对DM小鼠脏器指数的影响(n=8)Table 5 Effect of collagen peptide intersecting Momordica charantia extracts treatment on organ index of DM mice(n=8)
经解剖观察,模型组小鼠的肝脏和肾脏器官明显肿胀,脾脏器官萎缩,测定肝脏指数、肾脏指数高于对照组呈显著差异(p<0.05),脾脏指数低于对照组,表明DM小鼠的脏器功能显著下降。胶原蛋白肽交叉苦瓜素处理后,DM小鼠肝脏指数、肾脏指数降低,脾脏指数升高具有统计学意义。MGinterMCE组、MTinterMCE组、HTinterMCE组的肝脏指数为51.82、44.98、48.49 mg/g,肾脏指数为:12.15、11.29、11.54 mg/g,低于阳性组,脾脏指数为2.96、3.18、2.98 mg/g与阳性组相当。表明MGinterMCE组、MTinterMCE组、HTinterMCE组对DM小鼠肝脏和肾脏器官具有修复和保护作用,对脾脏具有促进生长作用,且效果显著。
3 结论与讨论
胶原蛋白肽易被肠道直接吸收,能提供机体需要的营养物质,还具有避免机体损伤造成的蛋白分解、糖、脂代谢紊乱,体重急剧下降等症状[16]。富含胶原蛋白肽的营养制剂可防治营养缺乏,增强应答功能,维持正常、适度的免疫反应,减轻有害的或过度的炎症反应,即胶原蛋白肽密切关联着免疫营养[17]。苦瓜提取物使Ⅱ型糖尿病受损的胰岛素β细胞恢复正常的分泌功能,增强胰岛素抵抗降低大鼠的空腹血糖,且血糖正常后保持稳定持久[18-20],因此本实验采用胶原蛋白肽改善机体免疫和营养代谢特性后,交叉苦瓜素辅助降低小鼠血糖下降,实现营养代谢改善后调节血糖的目标。
胶原蛋白肽交叉苦瓜素处理DM 4周后能明显降低血糖水平,空腹血糖降到7.5~16.63 mmol/L,其中MGinterMCE组、MTinterMCE组、HTinterMCE组血糖恢复到8.6 mmol/L以下,降血糖效果显著(p<0.05),且糖尿病小鼠血糖曲线下面积明显减少,改善糖尿病小鼠糖耐量异常。但HGinterMCE组血糖值在灌胃胶原蛋白肽处理时,血糖值上升,而灌胃苦瓜素处理后略有下降。推测胶原蛋白肽灌胃量过高造成调节失衡而无降血糖作用,并且不同胶原蛋白肽的功效存在差异。这需要后续实验继续研究。
四氧嘧啶通过破坏胰岛β细胞,引起血糖升高,造成实验性糖尿病[21-22]。四氧嘧啶破坏β细胞产生氧自由基,使SOD活力降低等,引起糖尿病人和糖尿病动物模型的抗氧化能力均下降[23]。胶原蛋白肽交叉苦瓜素处理DM 4周后,血糖含量降低的同时肝组织抗氧化能力提高,MGinterMCE组、MTinterMCE组、HTinterMCE组显著提高肝SOD活力,降低肝MDA含量。
MGinterMCE组、MTinterMCE组、HTinterMCE组处理组与模型组相比较,肝脏和肾脏的指数降低,脾脏指数显著提高。胶原蛋白肽交叉苦瓜素降低血糖和提高DM小鼠肝组织抗氧化能力的同时,改善肝脏和肾脏的损伤和促进修复。基于研究结论认为,胶原蛋白肽交叉苦瓜素处理,能增强自身免疫,恢复胰岛β细胞功能,促进胰岛素分泌,调节血糖趋于正常水平,减轻机体糖尿病症状。
[1]Xu Y,Wang L,He J,et al. Prevalence and control of diabetes in Chinese adults[J]. Jama,2013,310(9):948.
[2]李俊艳. 胶原蛋白多肽—铬螯合物降血糖、抗热应激保健功效的研究[D]. 保定:河北农业大学,2004.
[3]杨志寨. 糖尿病治疗现状[J]. 中外医疗,2011,30(27):
183-184.
[4]邹宇晓,廖森泰,刘学铭,等. 桑树资源治疗糖尿病研究[J]. 天然产物研究与开发,2004,16(3):265-268.
[5]丁志明,武海阔,王军. 胶原蛋白Ⅰ、胶原蛋白Ⅲ在糖尿病大鼠血管病变中的表达及中药的干预[J]. 天津中医药,2012,29(6):573-575.
[6]张国蓉,张旭,张程,等. 胶原蛋白多肽-铬(Ⅲ)螯合物提高糖尿病小鼠免疫功能的研究[J]. 现代食品科技,2009,25(4):358-361.
[7]王秀丽,刘安军,李琨,等. 胶原蛋白多肽-铬(Ⅲ)螯合物的降血糖机理探讨[J]. 食品研究与开发,2006,27(5):125-126.
[8]吴文惠,张艳,包斌,等. 不同鲨鱼皮胶原蛋白的分离及其特性研究[J]. 中国海洋药物,2008,27(2):22-28.
[9]陈美娟. 大马哈鱼皮胶原蛋白制备和表征[J]. 药物生物技术,2006,13(4):290-292.
[10]苗明三. 实验动物和动物实验技术[M]. 北京:中国中医药出版社,1997:240-241.
[11]中华人民共和国卫生部药政管理局. 中药新药研究指南(药学,药理学,毒理学)[M]. 1994:84-85
[12]田野. 运动生理学高级教程[M]. 北京:高等教育出版社,2003.
[13]方允中. 自由基生物学的理论与应用[M]. 北京:科学出版社,2002.
[14]李爱春. 富氢水对骨骼肌运动性氧化应激损伤与选择性抗氧化作用机制研究[D]. 苏州:苏州大学,2012.
[15]赵彩红. 小鼠自然衰老模型的血脂水平及抗氧化能力的评价[J]. 医学理论与实践,2007,20(7):745-746.
[16陈胜军,曾名勇,董士远. 水产胶原蛋白及其活性肽的研究进展[J]. 水产科学,2004,23(6):44-46.
[17]徐彬,韩晓丽. 富含胶原蛋白肽的肠内营养对重型颅脑损伤术后病人临床应用的效果观察[J]. 新疆医学,2009,39(1):7-9.
[18]严哲琳,刘铜华. 苦瓜提取物对Ⅱ型糖尿病胰岛素抵抗大鼠糖脂代谢的影响[J]. 吉林中医药,2011,31(8):809-811.
[19]于滨,马晓燕,李丹丹,等. 苦瓜降血糖成分及机制研究进展[J]. 中国果菜,2013(3):47-52.
[20]Ali L,Khan A K,Mamun M I,et al. Studies on hypoglycemic effects of fruit pulp,seed,and whole plant of Momordica charantia on normal and diabetic model rats[J]. Planta Medica,1993,59(5):408-12.
[21]邹瑶,齐桂年. 茉莉花渣多糖降血糖、改善糖尿病症状作用的研究[J]. 食品科技,2011(2):157-160.
[22]苟兴能,张克英,勾宗蓉,等. 川麦冬多糖对四氧嘧啶糖尿病小鼠的降血糖作用的实验研究[J]. 食品工业科技,2012,33(13):359-360.
[23]陈建国,江月仙,来伟旗,等. 茶多糖对四氧嘧啶糖尿病小鼠调节血糖及其抗氧化作用的探讨[J]. 毒理学杂志,2009(4):299-301.

