QuEChERS结合GCMS法快速检测酿酒玉米中14种邻苯二甲酸酯类塑化剂
孙啸涛,刘 淼,曾凤鸣,敖 灵,孙宝国,孙金沅,郑福平,黄明泉,李贺贺
(1.天津科技大学食品工程与生物技术学院,天津 300457; 2.北京工商大学,食品质量与安全北京实验室,北京 100048; 3.泸州老窖股份有限公司,四川泸州 646000)
自“2012年酒鬼酒塑化剂风波”后,加强对白酒中邻苯二甲酸酯类塑化剂(PAEs)的监测与控制成为焦点。PAEs作为塑料加工的重要辅助剂,目前普遍应用在包装材料、幼儿玩具、生活用品等塑料制品中[1-2],其是一种具有类似雌激素作用的环境激素,长期接触后,可干扰人体激素的分泌,具有生殖毒性[3]。目前在环境、食品和人体代谢物中均有检出[4-6]。由于白酒属于烈性酒,其原酒乙醇含量高达70%,商品酒亦普遍高于40%,因此较容易造成PAEs类物质的迁移、溶入,进而危害人体健康[7-8]。为严格控制白酒塑化剂的迁移途径,目前国内研究重点主要集中于酿酒过程中造成PAEs污染的分析与检测,而对酿酒原料污染的研究尚未深入。2015年,马荣山等[9]以正己烷作为萃取溶剂结合GC-MS对白酒酿造的主要原料、酒糟等各个阶段产物的16种PAEs塑化剂进行测定。在3个批次的样品中均检测到DMP、DEP、DIBP等5种PAEs。尽管含量未超过限量标准,但研究表明在不接触塑料制品的前提下,酿酒原料可能是白酒塑化剂污染的主要来源。董蔚等[10-11]通过建立QuEChERS-GC/MS法,先后实现对不同地区的小麦、大麦样品中14种PAEs类塑化剂的快速检测,同时采用基质匹配法绘制标准曲线、不确定度的评价方法,有效降低基质效应的影响,保证了定量结果的准确性。玉米作为浓香型白酒重要的原料之一,在白酒的风格形成和呈香呈味上起着非常关键的作用[12]。但近年来,为提高玉米产量及其品质,减少营养物质损失,塑料地膜被广泛应用于玉米种植,因此系统建立玉米中PAEs的检测方法,力求从源头解析其污染来源尤为重要。
由于玉米自身复杂基质干扰严重,如糖、脂肪酸、色素等,采用传统的PAEs前处理方法,如液液萃取、固相萃取和固相微萃取等往往达不到良好的萃取效果。QuEChERS方法是一种简单、快速的样品前处理技术。该方法能显著消除样品基质中与待测物存在竞争性的大分子质量的有机酸等成分,从而改善仪器检测背景和改善峰形,减少基质效应(ME)影响。自2003年Anastassiades和Lehotay[13]首次报道将其用在对蔬菜和水果中农残的预处理,目前此方法普遍应用于蔬菜水果、粮谷、动物组织以及土壤等农、兽药残留的检测。李丽娟等[14]应用QuEChERS-GC-MS方法同时测定果蔬、粮谷中6种除草剂。该方法简单、高效、环保,仅在18 min内可完成除草剂的同时测定,其加标回收率在84.05%~104.85%间;夏红等[15]采用酸化乙腈超声提取,QuEChERS法净化结合UPLC-MS-MS分析实现对稻谷中氯磺隆、甲磺隆、苄嘧磺隆、醚磺隆等4 种磺酰脲类除草剂的快速检测。彭俏容等[16]将QuEChERS与HPLC技术相结合建立了白酒中13 种PAEs的测定方法。此法显著消除样品基质的干扰,避免浓缩过程待测物损失。2012年,Ferreira等[17]采用优化的QuEChERS-GC/MS法,成功分析出爆米花爆制前后5种多霉菌毒素的含量差异。但目前利用QuEChERS结合GC-MS检测玉米中PAEs的方法未见文献报道。
本研究将QuEChERS方法与GC-MS技术结合,建立了玉米中14 种PAEs的检测方法。该方法高效、简便,适用于玉米原料中PAEs的快速检测和日常筛查。
1 材料与方法
1.1 材料与仪器
玉米样品 编号为Co-1、Co-2、Co-3、Co-4、Co-5和Co-6,分别购置于北京、安徽亳州、山东淄博、山东枣庄、东北辽宁和东北吉林的当地超市,所有玉米样品经WK-600A高速中药万能粉碎机粉碎后、过10目筛,避光储存于玻璃容器中备用。
邻苯二甲酸二甲酯(DMP,纯度≥99.9%)、邻苯二甲酸二乙酯(DEP,纯度≥99.9%)、邻苯二甲酸二丙酯(DPrP,纯度≥99.7%)、邻苯二甲酸二异丁酯(DIBP,纯度≥99.7%)、邻苯二甲酸二丁酯(DBP,纯度≥99.8%)、邻苯二甲酸二(2-甲氧基)乙酯(DMEP,纯度≥98.2%)、邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP,纯度≥99.0%)、邻苯二甲酸二(2-乙氧基)乙酯(DEEP,纯度≥97.5%)、邻苯二甲酸二戊酯(DPP,纯度≥99.0%)、邻苯二甲酸二己酯(DHP,纯度≥98.9%)邻苯二甲酸丁基苄基酯(BBP,纯度≥98.0%)、邻苯二甲酸二环己酯(DCHP,纯度≥99.9%)、邻苯二甲酸二(2-乙基)己酯(DEHP,纯度≥99.5%)、邻苯二甲酸二正辛酯(DNOP,纯度≥99.0%) 均为标品,阿拉丁试剂公司;乙腈、乙醇 均为色谱纯,Fisher实验器材(上海)有限公司;盐酸、氯化钠、无水硫酸镁 均为分析纯,国药集团化学试剂有限公司;N-丙基乙二胺(PSA,40~63 μm)、反相C18固相萃取填料(C18,40~63 μm)、石墨化碳(GCB,120~400 μm) 月旭科技(上海)股份有限公司。
Trace 1300-ISQ GC-MS联用仪 配有电子轰击(EI)离子源及Xcalibur数据处理系统,美国赛默飞世尔科技公司;VORTEX2涡旋混合器 艾卡(广州)仪器设备有限公司;TGL-16 gR高速台式冷冻离心机 上海安亭科学仪器厂;WK-600A高速中药万能粉碎机 北京天林恒泰科技有限公司。
1.2 实验方法
1.2.1 样品前处理
1.2.1.1 空白玉米样品的制备 取50 g未添加PAEs标品的空白玉米样品于WK-600A高速中药万能粉碎机中,经粉碎、过10目筛,制成待测样品,充分混匀后放入玻璃容器中备用。
1.2.1.2 QuEChERS前处理 提取:参考文献[10]并进行相应改进,取1.2.1.1节制备的玉米空白样品0.50 g,于10 mL离心管中,加入2 mL超纯水,用1 mol/L盐酸溶液(99∶1,V/V)调节至pH2.0,充分涡旋混匀后,准确添加50 μL混合标准溶液,涡旋混匀浸提15 min。加入乙腈2 mL,2800 r/min涡旋振荡2 min,随后加入0.7 g无水硫酸镁和0.32 g氯化钠(饱和),2800 r/min涡旋振荡45 s后,8000 r/min离心3 min。
净化:取上述上清液1 mL于2 mL PTFE离心管中,依次加入150 mg无水硫酸镁、50 mg PSA、15 mg C18和10 mg GCB,2800 r/min涡旋振荡1 min后,8000 r/min离心3 min。取0.5 mL上清样液于1 mL进样瓶中,待GC-MS分析。
为了避免PAEs的污染,参照Dong等[11]净化方法,去除实验中使用的所有玻璃仪器及试剂中PAEs残留,待用。
1.2.1.3 标准溶液的制备 准确称取上述14种PAEs类塑化剂标品各5 mg,置于50 mL容量瓶中,用乙醇溶液(体积分数为60%)定容,配成100 mg/L的标准溶液,贮藏于-4 ℃的低温冷冻冰箱中备用。
混合标准溶液的制备:取上述标准溶液1 mL于10 mL容量瓶中,乙腈溶液定容,配成10 mg/L的混合标准溶液,贮藏在-4 ℃冰箱中备用。
基质混合标准溶液配制:取上述混合标准溶液50 μL,加入至950 μL 按照1.2.1.1方法制备的空白样品提取液中,涡旋混匀,配制成500 μg/L的基质标准溶液。基质混合标准溶液需现用现配。
1.2.2 样品前处理的优化
1.2.2.1 萃取溶剂的选择 将上述配制的空白玉米样品进行QuEChERS前处理,在玉米塑化剂萃取过程中,分别考察乙腈、乙酸乙酯、正己烷3 种萃取溶剂对PAEs类塑化剂萃取率的影响。
1.2.2.2 净化剂的选择 将上述制备的空白玉米样品进行QuEChERS前处理,在萃取液净化过程中,分别考察添加10~40 mg GCB,0~200 mg PSA及15~100 mg C18对PAEs类塑化剂萃取率的影响。
1.2.3 气相色谱质谱条件 色谱条件:色谱柱:HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:初温60 ℃,保持1 min,以20 ℃/min升至220 ℃,保持5 min;以5 ℃/min升至280 ℃,再以10 ℃/min升至320 ℃,保持2 min;进样口温度:250 ℃;载气:He(99.999%);恒流:柱流速1.0 mL/min;分流比:20∶1;进样量:1.0 μL。
质谱条件:电离方式采用电子轰击电离(EI);电子能量70 eV;离子源300 ℃;四极杆温度150 ℃;传输管线温度300 ℃;定性采用全扫描模式(Full Scan);质量扫描范围m/z 50~500,驻留时间0.2 s;溶剂延迟7.6 min。定量采用选择离子扫描模式(SIM)。
1.2.4 标准曲线绘制及回收率测定 由于玉米原料复杂基质的影响,采用基质匹配法绘制标准曲线能较好地消除ME对定量的影响。称取1.2.1.1制备的空白玉米样品,依照1.2.1.2 的前处理方法,制备成母液。在上述制备母液中添加混合标准溶液,形成1.0、5.0、25.0、50.0、100.0、150.0、250.0、500.0 μg/L的基质标准液,经GC-MS分析后,以各PAEs化合物的标准溶液浓度x(μg/kg)为横坐标,各自定量离子的峰面积y为纵坐标,绘制校正曲线。按照1.2.1.3的前处理方法,测定在15、150和500 μg/L此3个加标水平下的回收率。
1.2.5 基质效应(ME)评价 基质效应是由于在萃取过程中,样品中的其他成分干扰待分析物在仪器中的响应信号,造成其检出限、定量限、精密度和准确度的不准确。通常采用提取后添加法进行评价,其计算公式如下:
ME(%)=[(Ks - Kp)/Ks]×100
式中:Ks为玉米空白基质匹配法绘制的标准曲线斜率;Kp为纯乙腈溶液配制的标准曲线斜率。
1.2.6 萃取率的计算 本研究采取回收率(ER)评价萃取率,具体方法同文献[11]所述。
ER(%)=[(Cs - Cp)/Ca]×100
式中:Cs为各PAEs添加到样品中所测得的含量(μg/kg);Cp为样品本身含有的潜在PAEs含量(μg/kg);Ca为添加到样品中的PAEs的标准添加量(μg/kg)。
1.3 数据处理
文中实验数据用SPSS 19.0进行处理,用Origin Pro 9.2作图。
2 结果与分析
2.1 样品前处理条件的优化
2.1.1 萃取溶剂的选择 玉米等酿酒原料中因含有淀粉、蛋白质、脂肪酸、色素等复杂基质,通常会显著影响目标PAEs的有效提取。因此,为了减少基质效应的干扰,合理选择萃取溶剂对提高实验的萃取效率至关重要。由于PAEs类塑化剂在乙腈、乙酸乙酯和正己烷中溶解性较高,同时这3 种溶剂均易与水相分离,因此常被用作萃取溶剂参与到QuEChERS前处理中[18]。本研究考察了上述3种溶剂对玉米样品中PAEs类塑化剂萃取效能的影响,结果如图1所示。结果表明,乙腈溶液能较好沉淀蛋白质、降低脂溶性,回收率达到94.2%~120.1%,因此选择乙腈溶液作为最优萃取溶剂。
2.1.2 净化剂的选择 尽管酿酒原料中大多数的蛋白质基质可通过乙腈溶液除去,但其余成分特别是脂肪酸仍能作为共提物被萃取出,进而对目标PAEs的电离及测定产生干扰。通过对玉米样品的TIC图进行分析,共提物的出峰时间为11.0~15.0 min,主要包括棕榈酸(11.3 min)、亚油酸(13.5 min)及油酸(13.6 min),如图2所示。因此选择不同类型的净化剂会影响最终的萃取效果。
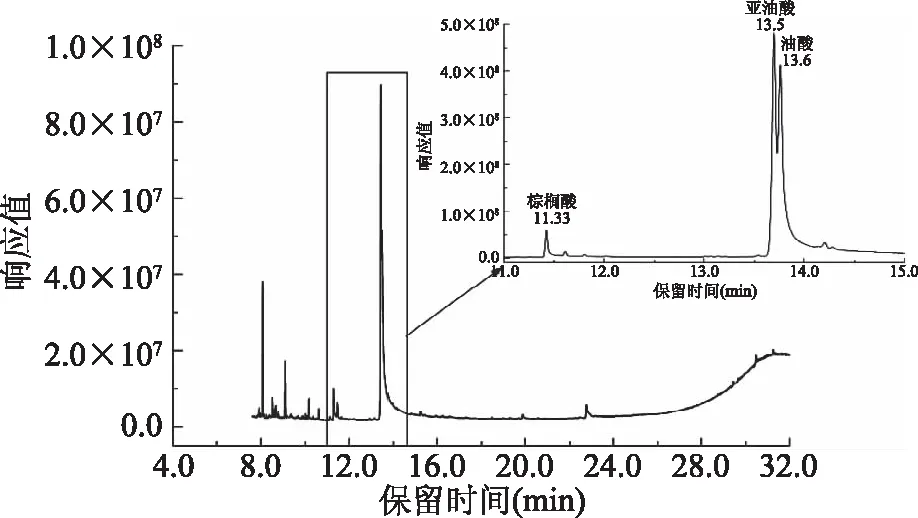
图2 空白酿酒原料的总离子流图(TIC图)Fig.2 Chromatograms in full scan mode of a real corn sample by dSPE clean-up absent
C18、PSA和GCB是QuEChERS方法中最常用的三种净化吸附剂。PSA对有机酸、色素、糖和脂肪酸等干扰物质具有较强的吸附能力。在本研究中,依次考察添加10~40 mg GCB,0~200 mg PSA以及15~100 mg C18对PAEs塑化剂回收率的影响。首先在对GCB的添加量进行优化时,分别选择添加10、15、25、40 mg。由图3可知,14种PAEs的回收率随GCB添加量的增加而降低,特别对DNOP,GCB的吸附作用明显,当其添加量从10增至40 mg时,DNOP的回收率从77.6%降低至22.0%。因此仅当GCB的用量为10 mg时,各PAEs塑化剂的回收率才基本符合检测要求。

图3 GCB用量对回收率的影响Fig.3 Selection of the amount of GCB on the recoveries of PAEs
固定添加10 mg GCB后,为了进一步去除基质效应对PAEs的干扰,本研究依次考察配合添加PSA 0~200 mg与15~100 mg C18,2种净化剂对PAEs回收率的影响。结果表明,随着PSA的增加可有效消除基质中棕榈酸、亚油酸及油酸等3种共提物的干扰,当加入50 mg PSA时,效果最明显,如图4(a)所示;最后固定添加添加10 mg GCB、50 mg PSA,在提取液中分别添加15~100 mg C18,结果如图4(b)所示,随着C18用量增加,各PAEs的回收率明显降低。特别对于DEHP和DNOP两种PAEs类塑化剂,当C18的用量为100 mg时,其回收率仅为32.6%和50.6%。因此最终选择添加50 mg PSA、15 mg C18和10 mg GCB为最优用量,其回收率为83.5%~112.7%。

图4 净化剂的选择对回收率的影响Fig.4 Effect of the adsorbents used for crude extracts purification注:(a)PSA用量的优化;(b)C18用量的优化。
2.2 14种PAEs类塑化剂SIM参数的确定
将质量浓度为0.5 mg/L的14种PAEs的基质混合标准溶液按照1.2.3的方法进行全扫描分析,得到总离子流色谱图(TIC图),参照其结果并借鉴GB/T 21928-2008《食品塑料包装材料中邻苯二甲酸酯的测定》[19]的质谱方法,即在每种PAEs类塑化剂的质谱图中选择丰度最高的离子作为定量离子,2~3种特征离子作为定性离子,最终确定14种PAEs塑化剂在色谱中的保留时间、定性定量离子选择如表1所示。14种PAEs塑化剂均可达到基线分离,分离效果良好,见图5(典型SIM图,玉米空白基质匹配)。
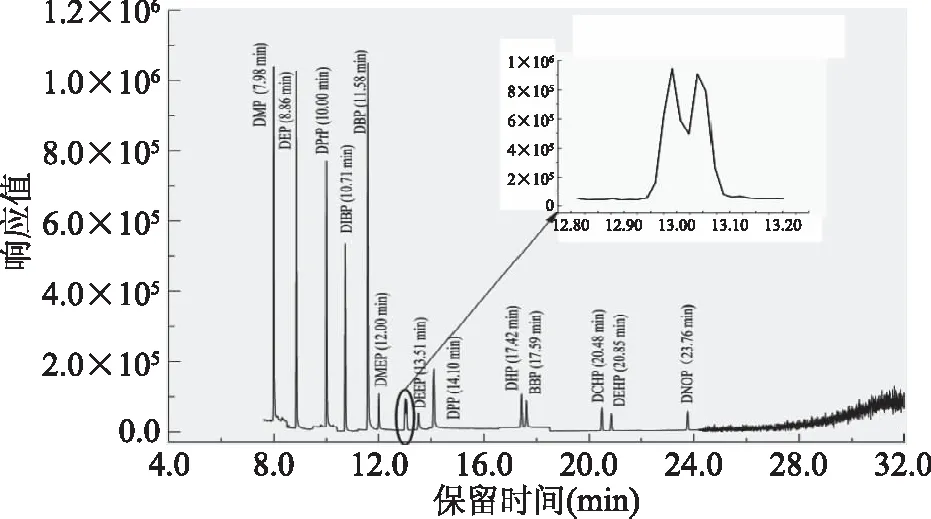
图5 14种PAEs塑化剂的典型SIM图(玉米基质匹配)Fig.5 Typical SIM chromatogram of 14 types of PAEs in a matrix matched standard

表1 14种PAEs类塑化剂的保留时间和SIM参数Table 1 Values of retention time and SIM parameters for 14 PAEs
2.3 方法评价
2.3.1 基质效应(ME) 在GC分析时,样品中的干扰物通常会与待测化合物争夺进样口或色谱柱顶端的金属离子、硅烷基以及不挥发性物质等形成的活性位点,因此普遍会发生离子增强或抑制的基质效应,进而严重影响定量结果的准确性。早在上世纪90年代,Gillespie等[20]发现在定量油脂为代表样品中的有机磷农药时,采用样品基质校准标准溶液可有效解决绝大多数含P=O基团的农药回收率超出正常范围(130%)的问题;近年来,国内外已有大量文献普遍考察了农药残留在蜂蜜、咖啡豆、果蔬等基质中的基质效应[21]。
在前期实验中已报道大麦基质对PAEs均存在显著的基质增强效应,增强比为41.0%~78.1%。因此本研究采用参考文献[10]的评价方法,对14 种PAEs类塑化剂在玉米基质中5 个浓度的基质效应考察,结果如表2所示,采用QuEChERS结合GC-MS法测定玉米PAEs的过程中,基质效应明显存在,且均表现为基质增强效应,其增强比值为34.5%~49.9%。

表2 14种PAEs的线性方程、线性范围、相关系数、平均回收率、精密度、检出限、定量限及基质效应(n=3)Table 2 Parameters of matrix-matched calibration curves,linearity,average recoveries, RSD,LOD and LOQ,and MEs in 14 types of PAEs of corn(n=3)
为减弱基质效应影响,采用基质匹配法绘制标准曲线能较好地消除基质效应对定量的影响,当PAEs加标浓度为500 μg/kg,使用空白玉米基质匹配绘制标准曲线校正后,14 种PAEs类塑化剂的回收率可达到80.0%~109.8%,满足分析要求。
2.3.2 线性关系、检出限和定量限 如表2所示,14 种PAEs在相应的线性范围内均有良好的线性关系,线性相关系数为0.9945~0.9995。14 种PAEs在玉米原料中的LOD(检出限)和LOQ(定量限)分别在0.10~2.50与0.13~5.00 μg/kg之间。
2.3.3 回收率及精密度 14种PAEs在玉米样品基质中的平均回收率如表2所示,在80.0%~109.8%之间,日内精密度与日间精密度的相对标准偏差(RSD)分别在0.4%~8.9%和0.3%~8.3%的范围内。
2.4 实际玉米样品的测定
按照1.2.1.2所述的最优前处理的方法对6份市售玉米样品中14种PAEs类塑化剂的含量进行检测,结果如表3所示。

表3 实际玉米样品的检测结果(m±SD μg/kg,n=5)Table 3 Application to genuine corn samples
其中5种PAEs类塑化剂在不同产地的玉米样品中100%检出,其含量范围分别为DMP(11.8±0.58)~(25.1±0.43) μg/kg、DEP(9.9±0.15)~(16.6±0.37) μg/kg、DIBP(35.5±1.46)~(433.9±4.77) μg/kg、DBP(28.1±0.53)~(274.2±13.98) μg/kg、DEHP(32.1±1.48)~(61.7±2.04) μg/kg。参照GB 9685-2008《食品容器、包装材料用添加剂使用卫生标准》[22]规定,当不得接触油脂类食品和婴幼儿食品,食品、食品添加剂中的DEHP和DBP最大残留量分别为1.5和0.3 mg/kg时,对消费者的健康风险处于可接受水平。本次检测中Co-1和Co-3这2个样品中的DBP含量均已接近0.3 mg/kg的限量要求,需重点关注。但由于上述并不是对酿酒原料中PAEs塑化剂限量的国家标准,相关标准尚未出台,因此尽快制定白酒中潜在化学污染物的各项限量标准,完善白酒的检测及监管制度迫在眉睫。
3 结论
本研究建立了QuEChERS结合GC-MS法快速检测玉米原料中14 种PAEs类塑化剂含量的方法。通过对提取(萃取溶剂)及净化过程(净化剂种类、用量)中各影响因素的优化,最终确定了以乙腈作为萃取溶剂,配合添加PSA 50 mg,C1815 mg,及GCB 10 mg,有效解决玉米样品中有机酸、色素等基质的干扰。为了进一步消除玉米样品基质增强效应(34.5%~49.9%)的影响,本研究采用基质匹配法绘制标准曲线,有效降低玉米基质效应的影响,保证了定量结果的准确性。
对6个不同产地生产的6种玉米样品中14种PAEs类塑化剂进行检测,检测结果显示:均检测到DMP、DEP、DIBP、DBP和DEHP这5种PAEs类塑化剂,其含量分别为DMP(11.8±0.58)~(25.1±0.43) μg/kg、DEP(9.9±0.15)~(16.6±0.37) μg/kg、DIBP(35.5±1.46)~(433.9±4.77) μg/kg、DBP(28.1±0.53)~(274.2±13.98) μg/kg、DEHP(32.1±1.48)~(61.7±2.04) μg/kg。本次检测中Co-1和Co-3这2个样品中的DBP含量均已接近0.3 mg/kg的限量要求,需重点关注。
与传统方法相比,该方法有效缩短了样品前处理时间,操作简单,单一样品的分析时间可控在于32 min内;其LOD(S/N>3)与LOQ(S/N>10)分别在0.10~2.5 μg/kg与0.13~5.0 μg/kg之间;平均回收率为80.0%~109.8%,日内与日间精密度均小于9.0%。该方法具有准确、高效、灵敏度高的优点,适用于玉米原料中PAEs的快速检测和日常筛查。
[1]郝倩,苏荣欣,齐崴,等. 食品包装材料中有害物质迁移行为的研究进展[J]. 食品科学,2014,35(21):279-286.
[2]蔡云梅,吕选. 儿童玩具中邻苯二甲酸酯的测定[J]. 广东化工,2014,41(18):171-172.
[3]Guo B Y,Wen B,Shan X Q,et al.Separation and determination of phthalates by micellar electrokinetic chromatography[J].Journal of Chromatography A,2005,1095(1-2):189-192.
[4]Ma T T,Wu L H,Chen L,et al. Phthalate esters contamination in soils and vegetables of plastic film greenhouses of suburb Nanjing,China and the potential human health risk[J]. Environmental Science and Pollution Research International,2015,22(16):12018-28.
[5]Xu D M,Deng X J,Fang E H,et al.Determination of 23 phthalic acid esters in food by liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A,2014,1324(1):49-56.
[6]Liou S H,Yang G C,Wang C L,et al. Monitoring of PAEMs and beta-agonists in urine for a small group of experimental subjects and PAEs and beta-agonists in drinking water consumed by the same subjects[J]. Journal of Hazardous Materials,2014,277(4):169-179.
[7]董蔚,赵东瑞,孙啸涛,等.非离子型表面活性剂/涡旋-液液微萃取结合气相色谱/质谱联用法检测白酒中邻苯二甲酸酯类塑化剂[J]. 食品安全质量检测学报,2015,6(7):2639-2650.
[8]李春丽,朱学良. 三重四极杆气质联用法测定白酒中的16种邻苯二甲酸酯类增塑剂[J]. 食品工业科技,2013,34(21):310-312.
[9]马荣山,韩营,王凤兰,等.白酒酿造过程中塑化剂来源分析[J]. 食品科学,2015,36(20):242-246.
[10]董蔚,郭凯,李贺贺,等.QuEChERS-GC-MS联用法检测大麦中14种邻苯二甲酸酯类塑化剂及基质效应的影响[J]. 食品科学,2016(24):156-163.
[11]Dong W,Sun B G,Sun J Y,et al. Matrix Effects in Detection of Phthalate Esters from Wheat by a Modified QuEChERS Method with GC/MS[J]. Food Analytical Methods,2017,10(9):1-15.
[12]信春晖,许玲,于盼盼,等. 浅述粮谷原料在白酒酿造中的作用[J].酿酒,2016,43(5):44-48.
[13]Anastassiades M,Lehotay S J,Stajnbaher D,et al. Fast and easy multi-residue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of
AOAC International,2003,86(2),412-431.
[14]李丽娟,吴青,翁柔丹,等. 气相色谱方法同时测定果蔬及粮谷中6种除草剂残留[J]. 食品工业科技,2014,35(18):84-88.
[15]夏虹,彭茂民,王小飞,等. QuEChERS法和UPLC-MS-MS法快速测定稻谷中4种磺酰脲类除草剂的残留量[J]. 食品科技,2015(8):325-328.
[16]彭俏容,于淑新,赵连海,等. QuEChERS-HPLC快速测定白酒中13种邻苯二甲酸酯[J]. 酿酒科技,2014(1):89-92.
[17]Ferreira I,Fernandes J O,Cunha S C. Optimization and validation of a method based in a QuEChERS procedure and gas chromatography-mass spectrometry for the determination of multi-mycotoxins in popcorn[J]. Food Control,2012,27(1):188-193.
[18]Gonzálezcurbelo M á,Hernándezborges J,Borgesmiquel T M,et al. Determination of pesticides and their metabolites in processed cereal samples[J]. Food Additives & Contaminants Part A,2012,29(1):104-16.
[19]GB/T 21928-2008. 食品塑料包装材料中邻苯二甲酸酯的测定[S].
[20]Gillespie M.,Walters S. Rapid Clean-Up of Fat Extracts for Organophosphorus Pesticide Residue Determination Using C18 Solid-Phase Extraction Cartridges[J]. Analytica Chimica Acta,1991,245(Supplement C):259-265.
[21]李淑娟,于杰,高玉生,等. HPLC-MSMS测定果蔬中有机磷类农药的基质效应[J]. 食品工业科技,2017,38(6):49-53.
[22]GB 9685-2008. 食品容器、包装材料用添加剂使用卫生标准[S].

