萱藻中褐藻多糖硫酸酯的纯化及其组分分析
周晓,宋悦凡,何云海,汪秋宽,刘舒
(大连海洋大学食品科学与工程学院,国家海藻加工技术研发分中心,辽宁水产品加工及综合利用重点实验室,辽宁大连116023)
萱藻Scytosiphon lomentaria为一年生广温性褐藻[1-3]。藻体为黄褐色至深褐色,管状,膜质,丛生,单条[4],每条长度为15~70 cm[5],在中国的沿海地区均有分布,其中广东省海陵岛到辽东半岛间分布较广泛,属温带性海藻[6],萱藻中富含褐藻胶和褐藻糖胶,其中褐藻胶为16.30%,褐藻糖胶为4%[7]。褐藻糖胶又名褐藻多糖硫酸酯 (Fucoidan),是一种水溶性杂多糖,L-岩藻糖和硫酸根是其主要组成成分[8-9],另外,还含有甘露糖、半乳糖、蛋白质、木糖、糖醛酸等单糖组成成分,以及钾、钠、钙等金属离子[10-11]。近年来,因褐藻多糖硫酸酯具有多种生物活性,包括抗肿瘤、抗凝血、抗病毒、抗炎、降血糖、降血脂、免疫调节等[12-16],对其研究引起了许多科学研究者的关注。
本研究中,以从新鲜萱藻中提取的粗褐藻多糖硫酸酯为原料,分离纯化褐藻多糖硫酸酯,分析各组分含量组成及其结构,旨在为萱藻的高效综合利用奠定基础。
1 材料与方法
1.1 材料
褐藻多糖硫酸酯从新鲜萱藻中提取,由大连海洋大学国家海藻加工技术研发分中心提供。
1.2 方法
1.2.1 褐藻多糖成分含量的测定
(1)总糖含量。采用苯酚硫酸法,以L-岩藻糖、D半乳糖 (质量比为3∶1)为标准糖,制作标准曲线。
(2)硫酸根含量。采用明胶-BaCl2法,具体测定方法参照文献[17]。
1.2.2 DEAE-Sepharose Fast Flow弱阴离子交换色谱分离纯化 称取0.4 g褐藻多糖硫酸酯粗品,溶于20 mL 0.02 mol/L磷酸盐缓冲液 (pH 7.4)中,将溶液通过DEAE-Sepharose Fast Flow弱阴离子交换柱 (1.6 cm×30 cm),经磷酸盐缓冲液,0~2.5 mol/L的NaCl溶液以0.75 mL/min的流速梯度洗脱,用自动部分收集器收集。经测定总糖后收集相应洗脱峰,透析,最后冷冻干燥,得到成品。
1.2.3 萱藻褐藻多糖硫酸酯的结构分析
(1)萱藻褐藻多糖硫酸酯的红外光谱分析。将干燥的样品2 mg与KBr 98 mg均匀混合,压制成片,使用Nieolet-Nexus 470傅立叶变换红外光谱仪,扫描其在4000~400 cm-1波长范围的光谱吸收值。
(2)萱藻褐藻多糖硫酸酯的核磁共振分析。核磁共振试验使用Bruker AVANCE III 600 MHz核磁共振仪,在25℃、100.6 MHz条件下进行。
1.2.4 萱藻褐藻多糖硫酸酯的单糖组成分析[18]
使用装有Agela·Venusil XBP-C18(2)色谱柱和紫外检测器 (DAD)的Agilent 1260高效液相色谱仪,采用PMP柱前衍生高效液相分析方法。流动相A为15%乙腈+50 mmol/L磷酸盐缓冲液 (pH 6.0),流动相B为40%乙腈+50 mmol/L磷酸盐缓冲溶液(pH 6.0),梯度0 min 100%A→50 min 50%A。进样体积为20 μL,流速为1.0 mL/min,柱温为30℃[18]。单糖标准品取浓度分别为1.0 mmol/L的甘露糖 (Man)、鼠李糖 (Rha)、半乳糖 (Gal)、半乳糖醛酸 (Gal-UA)、葡萄糖醛酸 (Glu-UA)、葡萄糖 (Glu)、木糖 (Xyl)和岩藻糖 (Fuc)的混合单糖。
2 结果与分析
2.1 DEAE-Sepharose Fast Flow弱阴离子交换色谱分离纯化
萱藻褐藻多糖硫酸酯经DEAE-Sepharose Fast Flow弱阴离子交换柱层析和NaCl溶液洗脱共得到4个组成成分 (图1),即1个流出峰,3个洗脱峰,分别命名为F-0、 F-1、 F-2和F-3, 分别收集各组分,透析、冷冻干燥待用。

图1 岩藻聚糖硫酸酯梯度洗脱曲线Fig.1 Gradient elution curve of the fucoidan
2.2 萱藻岩藻多糖硫酸酯的单糖组成
各组分组成分析结果如表1所示。其中,F-3的硫酸根和总糖含量最高,分别为21.13%和73.65%,纯度为94.78%。
F-0、 F-1、 F-2、 F-3 组分的岩藻糖含量分别为28.13%、1.33%、10.50%、26.12%,各组分的单糖组成含量以岩藻糖含量为单位1进行计算,制得表1。从图2和表1分析可知,各组分均含有岩藻糖、甘露糖、鼠李糖、葡萄糖醛酸、半乳糖、木糖,但组成比例有所不同。分析发现:F-0和F-3组分中岩藻糖含量较高;F-1组分中甘露糖含量最高,岩藻糖含量较低;F-2组分中鼠李糖含量最高;F-3组分中除岩藻糖含量较高外,半乳糖含量最高;F-0、F-1组分中还含有葡萄糖,但F-2、F-3组分中不含葡萄糖。
2.3 萱藻褐藻多糖硫酸酯的结构分析
2.3.1 红外光谱分析 从图3可见,3427~3404 cm-1附近为-OH 伸缩振动, 2943~2931 cm-1附近为糖类CH2伸缩振动, 1039~1037 cm-1附近为 C-O-C/C-OH, 这些是糖类共有的, 858~824 cm-1附近为C-O-S特征吸收峰,表明含有硫酸基,这与明胶-BaC12法测得的结果相符。 分析得知:F-0、F-1、F-2、 F-3组分在850 cm-1附近均有吸收峰, 为C-4的轴向键,硫酸根取代的是岩藻糖的C-4位;F-1组分在820 cm-1处有赤道配位的C-O-S伸缩振动吸收峰, 为C-2、 C-3的赤道键; F-0在1614.79 cm-1处有羧基的C=O伸缩振动。
2.3.2 核磁共振分析 从图4碳谱谱图可见:在F-0组分中, 推测(100~110)×10-6是 C1的位移,(67~83)× 10-6是 C2 到 C5 的位移, 23× 10-6附近的信号峰为乙酰基, (17~19)×10-6对应岩藻糖C6的位移,且含量较高;在F-1组分中,推测(177~179)×10-6出现 C=O信号峰,为糖醛酸的羧基,(140~150)×10-6出现信号峰, 应为C=C, 但仍需进一步考察,(17~19)×10-6附近出现 C6的位移, 推测为鼠李糖C6的特征信号峰;在F-2组分中,(73~83)×10-6是硫酸基或糖基化的位移,因结合红外光谱,分析S=O伸缩振动峰是显示硫酸基的存在,故可以确定(73~83)×10-6为硫酸基位移, 而(17~19)×10-6附近出现信号峰,推测为鼠李糖的特征信号峰;在F-3组分中,根据单糖组成,可推测出在18×10-6处出现岩藻糖的C6特征信号峰。

表1 各组分总糖、硫酸根含量及单糖组成Tab.1 Total polysaccharide and sulfate contents and monosaccharide composition of all fractions

图2 单糖组成的液相色谱图Fig.2 Monosaccharide composition profile of all fractions by liquid chromatography
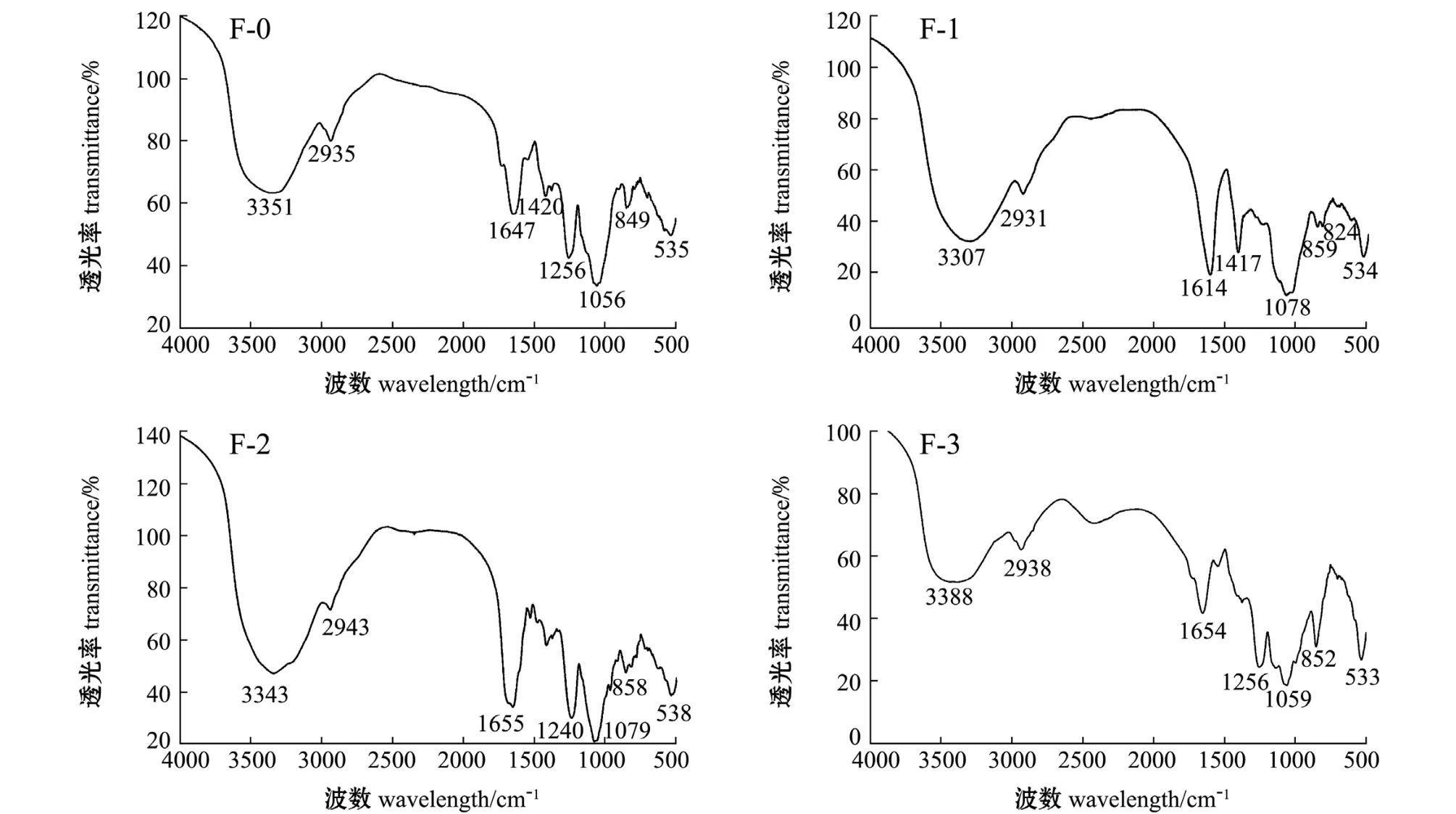
图 3 F-0、 F-1、 F-2、 F-3红外光谱图Fig.3 Infrared spectra of F-0, F-1, F-2 and F-3
3 讨论

图4 F-0、 F-1、 F-2、 F-3的13C 核磁共振谱图Fig.4 The13C NMR spectra of F-0, F-1, F-2 and F-3
褐藻的产地、品种、提取工艺不同,其褐藻多糖硫酸酯的单糖组成、含量会有明显差异。张海霞等[18]研究表明,马尾藻Sargassum褐藻多糖硫酸酯中主要含有甘露糖、半乳糖、岩藻糖。张文静[19]研究发现,笼目海带Kjellmaniella crassifolia和鼠尾藻Sargassum thunbergii褐藻多糖硫酸酯均以岩藻糖为主,还有适量的甘露糖、半乳糖和葡萄糖醛酸等杂多糖。马伟伟[20]研究证实,海黍子Sargassum miyabei褐藻多糖硫酸酯中岩藻糖是主要成分,也含有甘露糖、半乳糖,以及少量阿拉伯糖和木糖。姜龙等[21]纯化树皮藻Ecklonia maxima岩藻聚糖硫酸酯得到的4个组分中,主要由岩藻糖和半乳糖组成。贾之慎等[22]证明,羊栖菜Sargassum fusiforme粗多糖经层析得到的F-1、F-2组分均是以岩藻糖为主的多糖硫酸酯。
关于萱藻褐藻多糖硫酸酯的结构组成分析研究较少,本试验中采用酶解法得到萱藻岩藻聚糖硫酸酯产品,用DEAE-Sepharose Fast Flow弱碱性阴离子交换凝胶对萱藻褐藻多糖硫酸酯进行分离纯化,得到4个组分, 分别为F-0、 F-1、 F-2和F-3, 其硫酸根含量分别为 10.64%、10.47%、11.93%、21.13%,表明其属于硫酸多糖,与刘舒[23]分析的结果一致。 本研究中, F-0、 F-1、 F-2、 F-3各组分均含有甘露糖和岩藻糖,其中F-1组分的甘露糖含量远大于岩藻糖,且鼠李糖、半乳糖的含量也大于岩藻糖,其硫酸根含量相对也较低。
王景峰[24]采用冷水、热水浸提的方法得到萱藻两种岩藻聚糖硫酸酯粗品,并在Q-Sepharose FF上用NaCl进行洗脱。发现冷水浸提及其纯化后所得组分的总糖含量和硫酸根含量均高于热水浸提及其纯化后所得组分的含量。分析得知,热水浸提会使杂质溶解在热水中,高温使部分硫酸根脱掉,导致热水浸提所得的总糖和硫酸根含量较低,糖醛酸和蛋白质含量偏高。
本研究中结合酶解破壁提取,粗体物质经洗脱后得到的组分中,经红外光谱分析,均含有1254 cm-1处S=O 伸缩振动峰、 830 cm-1处 C-O-S 伸缩振动峰,显示硫酸基的存在;经核磁共振分析,F-0、F-3组分中出现岩藻糖C6信号峰,F-1、F-2组分中出现鼠李糖C6信号峰。
参考文献:
[1] 纪明侯,徐祖洪,郭玉彩.海带褐藻糖胶的研究[J].水产学报,1980,4(1):9-18.
[2] 马莉莎,张明.褐藻多糖硫酸酯的研究进展[J].山东医药,2009,49(11):115-116.
[3] 王庆钧,谷越,杨颖,等.萱藻中岩藻聚糖硫酸脂的提取工艺优化及其保肝护肝作用[J].大连海洋大学学报,2015,30(4):417-421.
[4] 罗荣珺,李伟.褐藻多糖硫酸酯的研究进展[J].科技资讯,2011(35):10.
[5] Eluvakkal T,Sivakumar S R,Arunkumar K.Fucoidan in some Indian brown seaweeds found along the coast gulf of Mannar[J].International Journal of Botany,2010,6(2):176-181.
[6] 张宇,付晓婷,林洪,等.萱藻营养品质的分析和评价[J].营养学报,2011,33(6):619-620,623.
[7] 杨会琴,李敬,戴翠萍.海带中岩藻多糖提取工艺的研究[J].河北师范大学学报:自然科学版,2005,29(4):409-411.
[8] 张连飞,宋淑亮,吉爱国.过硫酸化岩藻多糖硫酸酯[J].生命的化学,2011,31(2):258-261.
[9] Zvyagintseva T N,Shevchenko N M,Popivnich I B,et al.A new procedure for the separation of water-soluble polysaccharides from brown seaweeds[J].Carbohydrate Research,1999,322(1-2):32-39.
[10] 郭辽朴,李洪军.褐藻胶生物活性及在食品中应用的研究进展[J].四川食品与发酵,2007,43(6):9-12.
[11] 邱贺媛.九种河北产海藻的营养成分[J].唐山师专学报,1998,20(5):46.
[12] Nishino T,Nagumo T,Kiyohara H,et al.Structural characterization of a new anticoagulant fucan sulfate from the brown seaweed Ecklonia kurome[J].Carbohydrate Research,1991,211(1):77-90.
[13] Springer G F,Wurzel H A,McNeal Jr G M,et al.Isolation of anticoagulant fractions from crude fucoidin[J].Proceedings of the Society for Experimental Biology and Medicine,1957,94(2):404-409.
[14] 薛长湖,陈磊,李兆杰,等.岩藻聚糖硫酸酯体外抗氧化特性的研究[J].青岛海洋大学学报,2000,30(4):583-588.
[15] 李兆杰,薛长湖,陈磊,等.低分子量海带岩藻聚糖硫酸酯的清除活性氧自由基和体内抗氧化作用[J].水产学报,2001,25(1):64-68.
[16] 邢永泽.萱藻产业化研究获重大进展[N].中国海洋报,2010-05-07.
[17] 张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987.
[18] 张海霞,汪秋宽,何云海,等.马尾藻褐藻多糖硫酸酯的分离纯化及结构研究[J].大连海洋大学学报,2016,31(5):559-562.
[19] 张文静.两种褐藻中褐藻多糖硫酸酯的结构解析与活性研究[D].青岛:中国科学院研究生院(海洋研究所),2016.
[20] 马伟伟.海黍子褐藻多糖硫酸酯的分离纯化及生物功能研究[D].烟台:烟台大学,2013.
[21] 姜龙,宋悦凡,罗宣,等.树皮藻岩藻聚糖硫酸酯的纯化及其化学结构研究[J].大连海洋大学学报,2017,32(1):73-78.
[22] 贾之慎,邬建敏,郑海龙,等.洋栖菜中褐藻多糖硫酸酯的分离和组分分析[J].浙江农业大学学报,1998,24(6):670-673.
[23] 刘舒.三种褐藻中岩藻聚糖硫酸酯的纯化及结构分析[D].大连:大连海洋大学,2013.
[24] 王景峰.萱藻岩藻聚糖硫酸酯的制备及其抗血栓活性的研究[D].青岛:中国海洋大学,2013.

