菲律宾蛤仔捕后干露处置对其复水湿藏稳定性的影响
刘慧慧,周晏琳,张晴,李亚烜,刘俊荣,田元勇,魏巍
(1.大连海洋大学食品科学与工程学院,辽宁大连116023;2.东港出入境检验检疫局,辽宁丹东118300)
菲律宾蛤仔Ruditapes philippinarum是中国产量最大的养殖贝类,2015年产量为400万t,占中国海水养殖总产量的21%,占贝类养殖总产量的29%[1]。菲律宾蛤仔是一种典型的滩涂贝类,在潮汐循环中经历干露与复水的转换,受到缺水、缺氧、温度和饥饿的胁迫[2-4],对温度、盐度的变化及干露具有较强耐受性。Carregosa等[5]通过对3种蛤仔在0~42 g/L不同盐度条件下生理和生化反应的对比发现,菲律宾蛤仔在14~42 g/L的盐度条件下均具有100%的存活率。Munari等[6]研究发现,将菲律宾蛤仔在不同温度 (5、15、30℃)和盐度 (18、28、38)下保藏7 d,盐度18和温度15℃条件下可增强其对干露的耐受性。也有研究指出,湿度对延长菲律宾蛤仔存活期具有重要作用,在相对较高的湿度(91%~95%)和低温 (15℃)下干露,菲律宾蛤仔耐受性更强[7]。此外,在干露时,菲律宾蛤仔等滩涂贝类可通过闭壳进行无氧呼吸[8-10]和间歇性有氧呼吸[2,11]来适应环境的变化。众多研究者均是从菲律宾蛤仔增养殖或生命科学的角度对其进行研究。从食品科学的角度,已有关于菲律宾蛤仔闭壳肌组织学及蛋白质特性的研究[12],但缺乏对菲律宾蛤仔在流通过程中生理反应变化的系统研究,已有的报道也仅围绕半干运输(4、22℃)条件下微生物变化和生理反应展开[13-14]。
本研究团队对菲律宾蛤仔的流通现状进行调查发现,大规模采捕采用气泵搅动砂浆,然后用网进行捕捞,该过程导致菲律宾蛤仔体内混入大量泥沙。对外出口部分,采捕后经工厂规模化的净化→包装→热水烫漂→冷冻贮藏,可最大程度地保留其鲜美风味;而内销部分,采捕后直接流入市场,净化主要在零售端分散进行,活品流通过程品质控制缺乏科学指导。本研究中结合实地调研,模拟菲律宾蛤仔加工厂的商业净化条件,监测复水湿藏期间(50 h)菲律宾蛤仔pH值、水溶性蛋白质、糖原、ATP及其关联物的变化,探究捕后干露处置对其复水湿藏稳定性的影响,旨在为进一步探讨菲律宾蛤仔捕后食品品质变化及干露处置对后续贮藏过程中品质影响提供依据。
1 材料与方法
1.1 材料
菲律宾蛤仔 (以下简称蛤仔)于2016年12月采捕自丹东东港养殖场,体质量为 (12.0±1.6)g,壳长为 (3.0±0.35)cm,壳宽为 (2.0±0.2)cm,壳厚为 (1.2±0.14)cm。取40 kg蛤仔置于泡沫箱 (68 cm×24 cm×37 cm)中干露密封,经5 h运至大连海洋大学实验室用于试验研究。
试验用主要仪器:Agilent 1260高效液相色谱仪 (美国Agilent公司);高速冷冻离心机 (德国HERMLE Labortechnik GmbH公司);PB-10 pH计(德国Sartorius公司);Synergy H1酶标仪 (美国柏腾公司)。
试验用主要试剂:ATP、ADP、AMP、IMP、HxR、Hx、AdR、Ad标准品均购自美国Sigma公司;色谱级甲醇、乙腈购自美国Sigma公司;碘乙酸钠购自上海阿拉丁生化科技有限公司;分析纯高氯酸、氢氧化钾、氯化钾、无水乙醇、磷酸、磷酸二氢钾、磷酸氢二钾、浓硫酸、蒽酮、考马斯亮蓝G-250、三乙胺均购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 原料预处理 参考实地调研工厂的净化条件,将剔除死贝后的蛤仔分至9个网筐中,每筐4.5 kg,每3筐为一组,共分为3个处理组,依次为对照组,干露-4℃组 (记为D-4℃组),干露-室温组 (记为D-室温组)。
将D-4℃组每层蛤仔覆盖湿布于冷柜中4℃贮藏24 h,将D-室温组每层蛤仔覆盖湿布于泡沫箱中在室温贮藏24 h。
将对照组分组后立即置于充氧海水中复水湿藏;2个干露组在不同温度下经过24 h放置后,再置于充氧海水中。3组蛤仔的湿藏密度均为0.09 kg/L。蛤仔湿藏20.5 h后,离水干露2 h使蛤仔短暂休息,随后继续海水充氧湿藏27.5 h(参考工厂实际处理设定短时间干露处理)。样品处理的详细信息见表1。
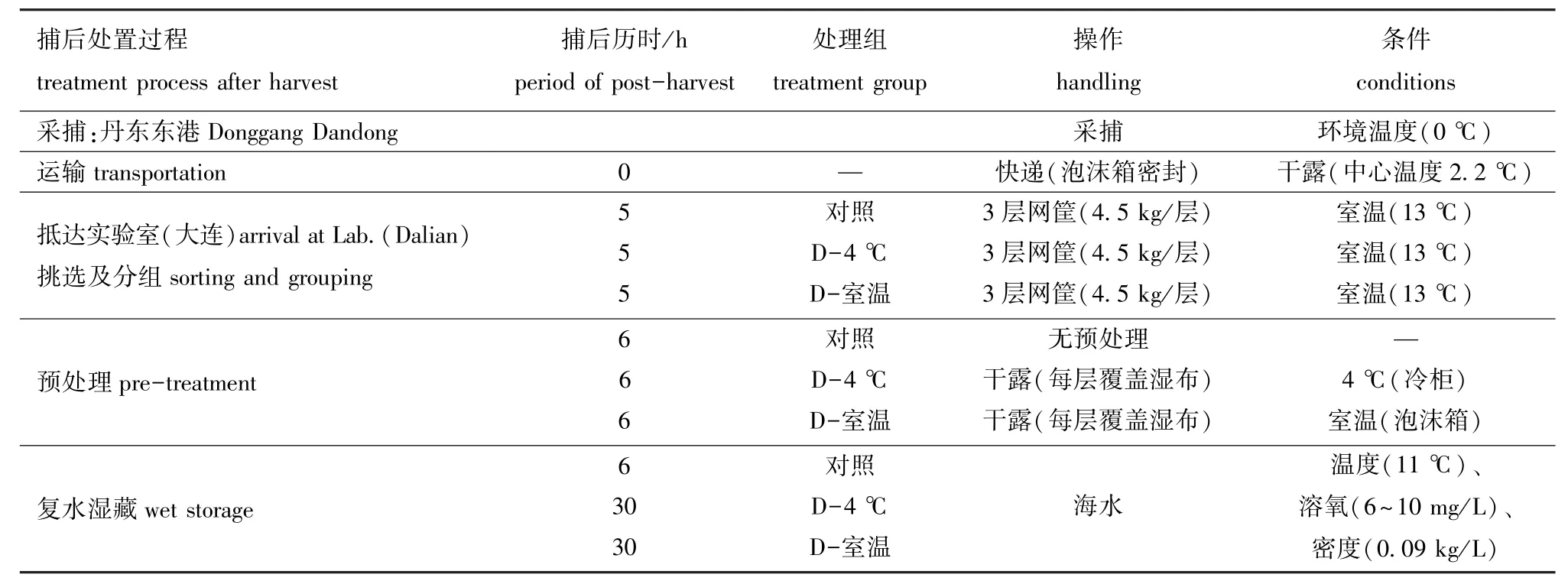
表1 菲律宾蛤仔样品处理信息Tab.1 Treatments of Manila clam Ruditapes philippinarum samples in the experiment
1.2.2 样品采集及处理 各试验组分别在复水湿藏 的 第 0、 0.5、 1.5、 2.5、 6.0、 15.5、 18.0、20.5、 22.5、 23.5、 28.5、 43.0、 50.0 h后随机取出1.0 kg蛤仔,控水后置于覆盖纱布的烧杯上方快速去壳,将软体部分和体腔液分离,体腔液沥干时间设定为5 min。随后将软体部位按照肌肉和内脏进行分离,取10 g肌肉用于水溶性蛋白质分析,其余肌肉用干冰速冻后置于冰箱 (-40℃)中保存,用于ATP及其关联物、pH、糖原的分析。
1.2.3 分析测试 质量百分比的测定:准确称取蛤仔1.0 kg(约100枚),分别去壳后,收集沥出体腔液,分离肌肉与内脏。再分别称量外壳、肌肉、内脏、体腔液4个部分的总质量,计算各部分质量占1.0 kg的百分比。
体腔液pH的测定:收集1.0 kg蛤仔沥出的体腔液后,立刻用pH计测定体腔液pH,本试验中通过加大样本消除了误差,未做平行。
肌肉pH的测定:取2.0 g肉糜加入10 mL 20 mmol/L碘乙酸钠,用玻璃棒充分搅拌,静置25 min,测定pH。每个样品设3个平行。
水溶性蛋白质的测定:取2.5 g肌肉加入25 mL 0.1 mol/L KCl Tris-HCl缓冲液 (pH 7.5), 以8000 r/min均质3次,每次30 s。以10 000 g离心10 min,所得上清液即为水溶性蛋白质。用考马斯亮蓝法测定蛋白浓度。每个样品设3个平行。
糖原的提取:取2.0 g肉糜加入4 mL 30%KOH溶液,沸水浴消化20 min。冷却后加入20 mL无水乙醇,以3000 g离心15 min。取沉淀作为粗糖原,采用蒽酮比色法测定其含量。每个样品设3个平行。
ATP及其核苷酸关联物的提取:参考 Hu等[15]的方法,秤取1.0 g肉糜置于10 mL 5%高氯酸溶液中,加入2 mol/L KOH调节pH为2.0~3.5,定容至20 mL,以3000 g离心5 min,取上清液经0.45 μm滤膜过滤,取4 mL滤液加入1 mL 0.1 mol/L磷酸缓冲液 (pH 7.5),贮藏于-40℃下,待分析。每个样品设5个平行。
色谱分析:采用高效液相色谱法进行分析。色谱柱为 Shim-pack CLC-ODS(6.0 mm×150 mm, 5 μm);检测器为二极管阵列检测器 (DAD),检测波长为254 nm,温度为35℃;流动相流速为1.5 mL/min,进样量为20 μL。流动相为三乙胺溶液:乙腈溶液 (4.2∶9),用磷酸调整混合液pH为5.5。K值和核苷酸能荷 (AEC值)计算公式为

其中:ATP为三磷酸腺苷含量;ADP为二磷酸腺苷含量;AMP为磷酸腺苷含量;IMP为肌苷酸含量;HxR为肌苷含量;Hx为次黄嘌呤含量。
1.3 数据处理
采用Excel 2010和Unscrambler 10.5(CAMO)软件对试验数据进行处理和分析。
2 结果与分析
2.1 干露处置对蛤仔活品各部位质量百分比的影响
从图1可见:蛤仔中壳所占质量比例最大,约占55%;其次为体腔液,约占总质量20%;肌肉质量略低于体腔液,约占18%;内脏团质量所占比例最小,约占5%;在贮藏的0~50 h中,外壳和肌肉质量几乎未见明显变化,而体腔液质量在干露过程(20.5 h~22.5 h)会略有降低,分析是干露胁迫导致了体腔液流失;贮藏过程中内脏团质量总体呈逐渐下降趋势,可能是净化过程中蛤仔体内泥沙不断被排出导致的;贮藏过程中各部位质量在3个试验组之间均未观察到明显差异。此外,试验过程中通过增大样本量尽量消除了操作损失的影响。
2.2 干露处置对蛤仔活品肌肉及体腔液pH的影响
从图2可见:3个试验组蛤仔体腔液的pH明显高于肌肉,体腔液pH更接近海水pH(7.8±0.1);在贮藏期间,3个试验组体腔液pH为7.8~7.2,而肌肉pH为7.0~6.7;贮藏过程中3个试验组体腔液和肌肉的pH均呈下降趋势,尤其在0~16 h内pH下降更明显,3个试验组体腔液pH从7.8下降到7.3左右,肌肉pH从7.0显著下降到6.7左右 (P<0.05);在20~22 h时,经干露处置后,3个试验组体腔液和肌肉pH均略有升高;在24~50 h时,3个试验组体腔液和肌肉的pH变化均不明显,且此时段体腔液pH下降幅度远低于0~16 h时,可能是由于从丹东运到实验室过程中,干露胁迫导致代谢物积累造成了0 h相对较高的pH值,在复水后积累的代谢物逐渐被排出,pH逐渐降低至平稳;3个试验组体腔液pH在0~16 h时变化略有差异,对照组pH下降更快,其次是D-4℃组,D-室温组pH下降最慢。分析可能是胁迫强度加大,恢复需要的时间更长。
2.3 干露处置对蛤仔活品肌肉中水溶性蛋白质含量的影响
从图3可见,在0~50 h内,3个试验组蛤仔肌肉中水溶性蛋白质含量维持在17~24 mg/g,且同一时间不同处理组间和同一组不同时间点间水溶性蛋白含量均无明显差异,即本试验条件下50 h的处置,不会导致蛋白质含量水平的改变。
2.4 干露处置对蛤仔活品糖原代谢的影响
从图4可见:在3个试验组中,肌肉糖原含量在0~50 h内均维持在30~47 mg/g;D-4℃组和D-室温组比对照组虽然多经历了24 h干藏处理,但3个组在复水0 h时的糖原含量并无差异,均维持在36 mg/g左右;复水后在0~22 h,3个试验组的糖原含量也几乎没有差异,但在24~50 h内,对照组的糖原含量相对于D-4℃组和D-室温组下降更明显,由43.6 mg/g显著下降至25.6 mg/g(P<0.05)。可能是在干藏过程中代谢缓慢,而对照组蛤仔能维持正常代谢,所以从蛤仔长远来看,当储备能源物质不能及时补充时,对照组蛤仔肌肉中糖原含量会降低。

图1 捕后干露处置对菲律宾蛤仔复水湿藏期间各部位质量百分比的影响Fig.1 Effect of postharvest air exposure on percentage of mass of Manila clam Ruditapes philippinarum during live wet storage

注:标有不同小写字母者表示同一处理组不同处理时间点有显著性差异 (P<0.05),下同Note:The means with different letters are significant differences in various treatment periods in the same treatment pattern at the 0.05 probability level,et sequentia

图3 捕后干露处置对菲律宾蛤仔复水湿藏期间肌肉中水溶性蛋白质含量的影响Fig.3 Effect of postharvest air exposure on water-soluble protein content in muscle of Manila clam Ruditapes philippinarum during live wet storage
2.5 干露处置对蛤仔活品ATP关联物含量的影响

图4 捕后干露处置对菲律宾蛤仔复水湿藏期间糖原含量的影响
从图5可见:3个试验组中,蛤仔均处于比较好的状态,肌肉中均含有较高的 ATP,其次为ADP、IMP、AMP、Hx、HxR等低级代谢产物含量;比较3个试验组0 h的ATP含量,对照组为1.41 μmol/g, D-4 ℃组下降为 1.26 μmol/g, D-室温组下降更明显,为1.16 μmol/g;在0~18 h,3个试验组的ATP含量均呈现回复趋势;在第20.5 h,短时间干露会导致ATP含量迅速下降,但是复水后 (22.5~50.0 h)又呈现回复趋势;ADP的含量趋势和ATP基本一致,其他代谢产物由于含量较低,各组间未见明显差异。

图5 捕后干露处置对菲律宾蛤仔复水湿藏期间ATP及其关联物含量的影响Fig.5 Effect of postharvest air exposure on contents of ATP and its related compounds in muscle of Manila clam Ruditapes philippinarum during live wet storage
从图6可见,3个试验组蛤仔在0~50 h内K值均小于10%,说明K值可能不适用于反映活品的品质变化。在0 h时,对照组AEC值为71%,D-4℃组为68%,D-室温组为67%,可能是因为干藏处置组多了24 h干露处置,导致肌肉中ATP消耗更多,这可能是由于代谢受阻,ATP不能得到补充,故肌肉中ATP含量更低;在复水后,3个试验组AEC值均呈上升趋势,逐渐恢复到76%左右,并在1.5~50 h内AEC值均能维持在76%左右。

图6 捕后干露处置对菲律宾蛤仔复水湿藏期间K值和AEC值的影响Fig.6 Effect of postharvest air exposure on K value and AEC value in muscle of Manila clam Ruditapes philippinarum during live wet storage
2.6 不同处置下蛤仔代谢指标的主成分分析
从图7可见:主成分PC1和PC2的贡献率分别为96%和3%,二者累计贡献率99%,能完整反映捕后蛤仔复水湿藏的稳定性;除D-4℃组在复水0.5 h和对照组在0 h的样品与整体有所偏离外,其他各组蛤仔不同贮藏时间下的生化代谢情况未见明显差异。通过相关载荷量可以看出,ATP及其关联物与pH彼此接近,具有高度正相关性。
3 讨论
3.1 捕后干露对贝类质量百分比及蛋白质的影响
本试验中,菲律宾蛤仔的可食部位仅占全贝质量的23%,其中肌肉占约18%,内脏团占约5%。在0~50 h的贮藏过程中,由于泥沙排除,内脏团质量呈下降趋势,肌肉部分质量变化不大。干露组前期的24 h干露处置也未对菲律宾蛤仔的肌肉质量造成明显影响。此外,体腔液质量约占整贝的20%左右,体腔液pH和海水pH(7.8)接近,高于肌肉pH(7.0),这与杨婷婷[16]对虾夷扇贝闭壳肌和体腔液pH的分析结论一致。本试验中,在0~50 h时肌肉和体腔液pH均呈现降低趋势,可能是生成了章鱼碱或乳酸积累引起的[17],而3个试验组间肌肉和体腔液的pH均未见明显差异。同时,体腔液pH在0~16 h变化幅度较肌肉pH更大,推测体腔液可能更能反映菲律宾蛤仔的生命状态,前期试验验证了体腔液中不含ATP,但体腔液中其他成分,如糖类、非蛋白氮等的变化有待深入研究。
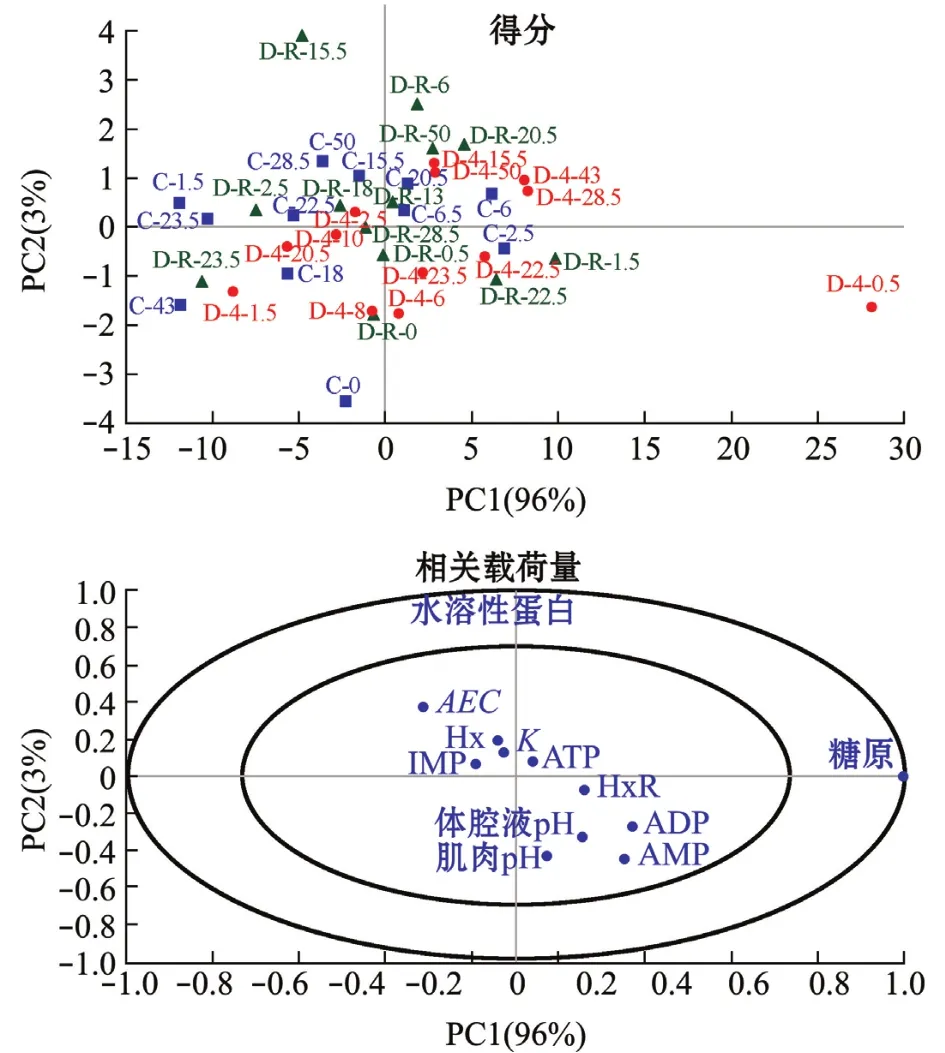
图7 捕后菲律宾蛤仔复水湿藏期间主成分分析双标图Fig.7 Bi-plot of principal component analysis of Manila clam Ruditapes philippinarum during live wet storage
进一步对贝类肌肉进行了分析,3组间水溶性蛋白质含量未见明显差别。水溶性蛋白质主要包括肌浆蛋白、白蛋白、色素蛋白,以及与代谢有关的酶类 (如乳酸脱氢酶、磷酸果糖激酶、醛缩酶等)[18]。蛋白质水平不能反映干露处置的影响,但对酶的种类、活性变化方面还有待深入研究。
3.2 捕后干露对贝类能量代谢物质及途径的影响
糖原作为贝类的主要能源贮藏形式,当机体无法从外界摄食的时候,机体就会动用自身的糖原供能[19]。本试验中,对照组糖原含量在24~50 h时下降更明显,分析可能是对照组菲律宾蛤仔一直贮藏在海水中,代谢较干露组更活跃,糖原消耗相对较多引起的,但不同温度的干露组菲律宾蛤仔糖原含量无明显差异。刘金洋等[20]研究中也发现,虾夷扇贝在干藏条件下较湿藏具有更高的糖原含量。
ATP是为代谢提供能量的重要物质。本研究中,0 h时对照组ATP含量为1.41 μmol/g,经过24 h的干露处置,肌肉中ATP含量下降明显,且干露温度越高,ATP含量下降越明显,干露-4℃组下降为1.26 μmol/g,干露-室温组下降为1.16 μmol/g。复水后,ATP含量出现缓慢回升趋势。但是干露时间延长,不利于ATP的恢复。在复水湿藏中的短时间干露处置 (20.5~22.5 h),ATP含量出现快速降低,复水后又出现了回升,但是不能恢复到前期的水平。干露-4℃组比干露-室温组恢复得更明显。因此,菲律宾蛤仔捕后应尽量减少干露-复水-干露这样激烈的生存环境波动。
关于贝类的代谢途径目前也存在争论,在鱼类中,通常ATP的降解途径为ATP→ADP→AMP→IMP→HxR→Hx[21]。普遍认为,贝类不产生IMP,而是直接生成AdR,这是因为AMP脱氨酶很低或几乎不存在[21]。但本研究中检测到了IMP、HxR和Hx,而HxR的含量极少,并未检测到AdR。说明菲律宾蛤仔的代谢途径也为AMP→IMP→HxR→Hx[22]。有报道发现,贮藏阶段的巨扇贝Placopecten magellanicus、太平洋牡蛎Crassostrea giga、文蛤Meretrix lusoria和短颈蛤 Tapes japonica中存在IMP[16]。有研究表明,马氏珍珠贝Pinctada martensi、长牡蛎Ostrea gigas、栉孔扇贝Chlamys farreri、中国蛤蜊Mactra chinensis和文蛤Meretrix meretrix中均存在IMP[22-23]。早年发现,菲律宾蛤仔中存在IMP[24],本研究结果与其一致。IMP是鲜味的主要成分,也是贝类的主要呈味物质[25],本研究中菲律宾蛤仔在0~50 h贮藏过程中,IMP含量仅次于ATP和ADP,与其具有鲜美味道相关。干露处置24 h后,ATP及其关联物含量与对照组相比未见明显差异,说明干露处置并未对菲律宾蛤仔复水湿藏期间 (0~50 h)的生理状态产生影响,这也表明菲律宾蛤仔有较好的贮藏特性。
3.3 捕后干露对贝类生理状态的影响
AEC值常用于评价贝类的生理状态,当0.75<AEC<0.90时,水产品处于最优生长、繁殖条件;当0.50<AEC<0.75时,水产品缓慢生长,不能繁殖,此状态可以恢复;当 AEC<0.5时,水产品不能生长繁殖,已经死亡[26]。本研究中,3个试验组菲律宾蛤仔0 h的AEC值在70%左右,复水1.5 h后恢复至76%左右,这表明捕后的菲律宾蛤仔处于胁迫状态,但尚未达到致死条件。K值是反应水产品鲜度的常用指标,在本研究中K值<10%,说明K值对评价活品的意义不大。
通过主成分分析将3个处理组的各个指标结合起来分析,提取2个主成分表示,结果显示,3个处理组之间无明显差别,即干露处置未对菲律宾蛤仔复水湿藏稳定性造成影响。
综上所述,短时间 (24 h)的干露放置,不会对菲律宾蛤仔复水湿藏稳定性产生影响。在4~13℃内干露处置也几乎无差别。在实际生产中,当菲律宾蛤仔不能立即投入净化时,在低于13℃的条件下,24 h内的干露放置仍可维持其正常的代谢水平。未来可结合感官分析深入探讨复水湿藏期间菲律宾蛤仔的品质变化。同时菲律宾蛤仔体腔液中各成分在贮藏过程中的变化也值得进一步研究。
参考文献:
[1] 农业部渔业渔政管理局.2016中国渔业统计年鉴[M].北京:中国农业出版社,2016.
[2] Mcmahon R F.Respiratory response to periodic emergence in intertidal molluscs[J].Integrative and Comparative Biology,1988,28(1):97-114.
[3] Hiong K C,Peh W Y X,Loong A M,et al.Exposure to air,but not seawater,increases the glutamine content and the glutamine synthetase activity in the marsh clam Polymesoda expansa[J].Journal of Experimental Biology,2004,207(26):4605-4614.
[4] Byrne R A,Gnaiger E,Mcmahon R F,et al.Behavioral and metabolic responses to emersion and subsequent reimmersion in the freshwater bivalve,Corbicula fluminea[J].The Biological Bulletin,1990,178(3):251-259.
[5] Carregosa V,Velez C,Soares A M V M,et al.Physiological and biochemical responses of three Veneridae clams exposed to salinity changes[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2014,177-178:1-9.
[6] Munari M,Matozzo V,Marin M G.Combined effects of temperature and salinity on functional responses of haemocytes and survival in air of the clam Ruditapes philippinarum[J].Fish&Shellfish Immunology,2011,30(4-5):1024-1030.
[7] Ali F,Nakamura K.Effect of temperature and relative humidity on the tolerance of the Japanese clam,Ruditapes philippinarum(Adams& Reeve),to air exposure[J].Aquaculture Research,1999,30(9):629-636.
[8] Lesser M P.Oxidative stress in marine environments:biochemistry and physiological ecology[J].Annual Review of Physiology,2006,68:253-278.
[9] Ali F,Nakamura K.Metabolic characteristics of the Japanese clam Ruditapes philippinarum(Adams&Reeve)during aerial exposure[J].Aquaculture Research,2000,31(2):157-165.
[10] Grieshaber M K,Hardewig I,Kreutzer U,et al.Physiological and metabolic responses to hypoxia in invertebrates[J].Reviews of Physiology,Biochemistry and Pharmacology,1994,125:143-147.
[11] Nicastro K R,Zardi G I,McQuaid C D,et al.The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels[J].BMC Ecology,2010,10:17.
[12] 张龙,刘俊荣,田元勇,等.菲律宾蛤仔闭壳肌组织学及其蛋白特性[J].大连海洋大学学报,2017,32(3):356-362.
[13] Anacleto P,Maulvault A L,Chaguri M,et al.Microbiological responses to depuration and transport of native and exotic clams at optimal and stressful temperatures[J].Food Microbiology,2013,36(2):365-373.
[14] Anacleto P,Maulvault A L,Barrento S,et al.Physiological responses to depuration and transport of native and exotic clams at different temperatures[J].Aquaculture,2013,408-409:136-146.
[15] Hu Yaqin,Zhang Jia,Ebitani K,et al.Development of simplified method for extracting ATP-related compounds from fish meat[J].Nippon Suisan Gakkaishi,2013,79(2):219-225.
[16] 杨婷婷.采捕后活品虾夷扇贝(Patinopecten yessoensis)的风味变化[D].大连:大连海洋大学,2014.
[17] Hiltz D F,Dyer W J.Octopine in postmortem adductor muscle of the sea scallop(Placopecten magellanicus)[J].Journal of the Fisheries Research Board of Canada,1971,28(6):869-874.
[18] Zheng Huina,Zhang Chaohui,Qin Xiaoming,et al.Study on the protein fractions extracted from the muscle tissue of Pinctada martensii and their hydrolysis by pancreatin[J].International Journal of Food Science & Technology,2012,47(10):2228-2234.
[19] Artigaud S,Lacroix C,Richard J,et al.Proteomic responses to hypoxia at different temperatures in the great scallop(Pecten maximus)[J].Peer J,2015,3:e871.
[20] 刘金洋,刘俊荣,田元勇,等.捕后处置对活品底播虾夷扇贝生化代谢的影响[J].水产学报,2017,41(1):81-87.
[21] Konosu S.The taste of fish and shellfish[M]//ACS Symposium Series.Washington,DC:American Chemical Society,2009:185-203.
[22] 刘云,宫向红,徐英江,等.烟台近海3种贝类中呈味核苷酸和氨基酸的测定及比较分析[J].中国水产科学,2014,21(2):351-360.
[23] 王丹妮,邱伟强,陈舜胜,等.冷藏条件下缢蛏、文蛤ATP关联产物的变化及降解途径的探究[J].食品与发酵工业,2016,42(9):228-233.
[24] Konosu S,Fujimoto K,Takashima Y,et al.Constituents of the extracts and amino acid composition of the protein of short-neckedclam[J].Bulletin of the Japanese Society of Scientific Fisheries,1965,31(9):680-686.
[25] Chiou T K,Lin J F,Shiau C Y.Changes in extractive components and glycogen in the edible meat of hard clam Meretrix lusoria during storage at different temperatures[J].Fisheries Science,1998,64(1):115-120.
[26] Picado A,Le Gal Y.Adenylate energy charges as a tool for evaluating sub-lethal toxicity[J].Qatar University Science Journal,1999, 19:36-45.

