硬脊膜动静脉瘘:1例报告及专家解读
洪荣华 ,林 岩 ,陈 刚 ,陆钦池 ,陈增爱 ,管阳太
1.上海交通大学医学院附属仁济医院神经内科,上海 200127
2.上海交通大学医学院附属仁济医院影像科,上海 200127
1 病例报告
1.1 主诉
患者,男性,63岁,因“进行性右下肢麻木、行走不稳8个月,腰部疼痛3个月”于2016年9月就诊于上海交通大学医学院附属仁济医院神经内科。患者自诉右下肢麻木、行走不稳症状进行性加重,麻木自右足小趾沿右腿外侧向上扩展至肛周,并伴有腰部疼痛、二便障碍。
1.2 既往史
既往体健,发病前4周内无发热,无呼吸和消化系统感染病史。
1.3 神经系统查体
右侧腓肠肌及股四头肌萎缩,右下肢近端肌力为Ⅴ-级,右下肢远端肌力为Ⅲ-级,右侧第11胸椎平面以下针刺觉减退,肛周针刺觉减退,其余神经系统查体未发现明显异常。
1.4 实验室检查
尿白细胞计数为309.8个/高倍镜视野(正常值:0~2/高倍镜视野)。血常规、粪常规、肝肾功能、血脂、血糖、糖化血红蛋白、电解质、心肌酶谱、出凝血系列指标、甲状腺功能及抗体、风湿免疫指标、肿瘤标志物、叶酸、维生素B12、人类免疫缺陷病毒(human immunodeficiency virus,HIV)抗体、梅毒抗体、乙肝表面抗原和丙肝抗体等均无异常。
脑脊液检查:蛋白含量为632 mg/L(150~450 mg/L),红细胞计数为0×106/L(0×106/L),白细胞计数为3×106/L [(0~8)×106/L];未见免疫球蛋白G (immunoglobulin G,IgG)寡克隆区带(oligoclonal band,OCB)。
血清及脑脊液中水通道蛋白4(aquaprorin 4,AQP4)抗体、髓鞘少突胶质细胞糖蛋白(myelinoligodendrocyte glycoprotein,MOG) 抗体和髓鞘碱性蛋白(myelin basic protein,MBP)抗体均为阴性。
1.5 影像学检查
1.5.1 颈椎磁共振成像(magnetic resonance imaging,MRI)平扫+增强扫描
表现为颈椎退行性改变;第3/4、4/5和5/6颈椎的椎间盘稍突出,颈椎间盘变性。
1.5.2 胸椎MRI平扫+增强扫描
T2加权成像显示第9胸椎水平以下呈中心分布的脊髓条片状高信号影(图1A、D);增强后脊髓强化不明显,周围可见强化迂曲的小血管影(图 1B、C、E)。
1.5.3 腰椎MRI平扫+增强扫描
T2加权成像显示脊髓圆锥信号增高(图2A),增强可见轻度强化(图2B);第4/5腰椎的椎间盘突出,腰椎间盘变性。
1.5.4 泌尿系统超声检查
前列腺增大伴钙化,双侧肾脏、双侧输尿管未见明显异常,膀胱充盈差,膀胱内壁显示不清。
1.6 肌电图检查
双侧第5腰椎/第1~3骶椎活动性根性或前角损害,以右侧为甚。
1.7 诊断和治疗
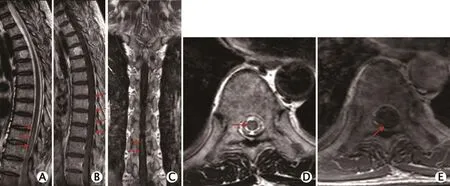
图1 1例63岁硬脊膜动静脉瘘男性患者的胸椎磁共振成像平扫+增强扫描图像(2016年9月)。T2加权成像显示第9胸椎水平以下呈中心分布的脊髓条片状高信号影(A、D);增强后脊髓强化不明显,周围可见强化迂曲的小血管影(B、C、E)
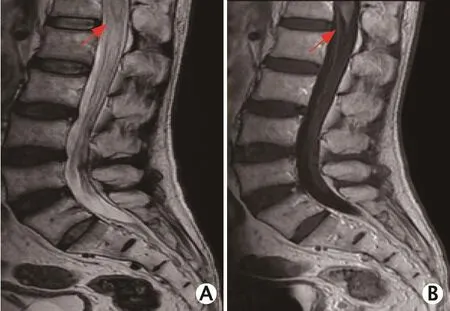
图2 1例63岁硬脊膜动静脉瘘男性患者的腰椎磁共振成像平扫+增强扫描图像(2016年9月):T2加权成像显示脊髓圆锥信号增高(A),增强可见轻度强化(B)
本病例主要表现为慢性、进行性加重的右下肢运动及感觉障碍,伴有自主神经功能障碍,入院诊断为“脊髓病变(炎性可能)”。入院后给予地塞米松磷酸钠静脉滴注(10 mg/d,14 d)、前列地尔静脉滴注(20 μg/d,14 d)、盐酸左氧氟沙星片口服(500 mg/d,10 d)、呋塞米片口服(40 mg/d,14 d)等治疗,但疗效不明显。因胸椎MRI增强扫描提示血管性病变不能除外,遂于2016年10月11日转至神经外科行脊髓数字减影血管造影(digital substraction angiography,DSA),术中发现患者第12胸椎左侧肋间动脉供应硬脊膜动静脉瘘(spinal dural arterio-venous fistula,SDAVF),脊髓血管怒张,未见明显静脉引流。于2016年10月21日在全身麻醉下行SDAVF切除术,术中探查可见脊髓背侧迂曲静脉,瘘口位于第12胸椎节段左侧,可见动脉化引流静脉伴随神经根走行,紧贴瘘口电凝引流静脉近端并切断,吲哚菁绿造影未见脊髓表面迂曲静脉显影,术程顺利,术后继续辅以对症支持治疗1周。患者最终诊断为第12胸椎节段SDAVF。
1.8 随访
2018年2月,电话随访患者。患者自觉右下肢麻木、行走不稳均已明显好转,仅遗留右侧脚背麻木,无腰部疼痛,二便已恢复正常。
2 专家解读
2.1 临床讨论(上海交通大学医学院附属仁济医院神经内科,管阳太 教授)
SDAVF是一种罕见的获得性的硬脊膜根动脉与硬脊膜内根静脉的异常连接[1],是供应脊膜或神经根的小动脉,在椎间孔处穿过硬脊膜时与脊髓引流静脉形成交通性瘘口,导致脊髓静脉高压、回流受阻,脊髓发生水肿、缺血甚至坏死,其病因及发病机制尚不明确,可能与形成血栓的根静脉重新开通有关[2]。SDAVF占所有脊髓血管畸形的60%~80%[1]。1926年首次报道了SDAVF的结构及临床特征;然而,直至1974年才提出本病的关键治疗。SDAVF年发病率估计为(5~10)/1 000 000,主要影响中老年人,平均年龄为54~63岁,男女比例为6∶1,从出现症状到确诊的间隔时间为数日至数年不等,取决于症状的缓急[2],大多在1~2年确诊。
SDAVF的临床表现多为非特异性,起始症状与任何脊髓受压迫的最初表现相似,最常见为圆锥综合征,其次为马尾神经症状,再次为痉挛性截瘫,如出现从足部起始的下肢上行性运动和(或)感觉障碍,起始症状可轻微,包括步态困难、对称或非对称性感觉障碍、弥漫或片状感觉缺失及神经根痛等[3]。肢体无力可以为单侧或双侧性,感觉障碍大多为双侧且不对称,感觉异常无明确的平面,伴或不伴有腰背痛[4]。在部分患者中,感觉症状是首发或主要症状,50%~60%的患者有疼痛症状,但疼痛很少是唯一的表现[5]。在少数情况下,当水肿累及颈髓时,可有上肢受累表现。二便失禁及性功能障碍大多出现于疾病晚期,是脊髓严重受损的表现。不同患者的神经功能损害进展速度亦不同,可逐渐起病,也可突然加重至偏瘫和二便失禁,上述症状也可在体力活动、长时间站立、运动和姿势改变后出现。在某些情况下,可以急性起病,随后缓慢进展或趋于稳定[5-6]。
SDAVF的临床表现混杂,不具有特异性,且病程多变,因此常常导致诊断延迟或诊断错误;尤其是在合并椎间盘变性、前列腺疾病、血管功能不全等情况时,诊断更为棘手。事实上,许多患者在明确诊断之前已接受了不必要的有创性干预或错误治疗,如前列腺手术或活检、椎管狭窄手术治疗和横贯性脊髓炎免疫调节治疗等[5,7]。因此,临床医师对SDAVF与多发性神经病、前列腺疾病以及椎间盘变性导致脊髓或神经根受压等进行鉴别,至关重要。例如,多发性神经病有上肢累及,而SDAVF罕有上肢累及;SDAVF有骶部感觉受累和上运动神经元症状,而多发性神经病极少有此症状;此外,SDAVF所致的任何腿部运动或感觉障碍常为非对称性,而多发性神经病则常常是对称性的。SDAVF和前列腺增生均可导致尿失禁和排尿困难,但前列生增生无运动和感觉障碍症状。椎间盘变性导致脊髓或神经根受压与SDAVF在临床表现上较难区分,需要依靠影像学检查作进一步鉴别。详细的神经系统检查对SDAVF诊断和鉴别诊断均十分重要。
本病例主要表现为慢性起病、进行性加重的右下肢运动及感觉障碍,伴自主神经功能障碍。神经系统查体提示右下肢的下运动神经元病变伴感觉传导束受损,故初步定位在低位胸髓以下,病变可能累及脊髓圆锥和(或)马尾,这与之后的胸腰椎MRI和肌电图检查结果相吻合。根据慢性、进行性加重的病程,以及脑脊液中蛋白含量增加,但未发现有肿瘤、感染、代谢、风湿免疫等方面的异常,遂定性为炎性、退行性变或血管性病变。治疗上暂予地塞米松抗炎和呋塞米减轻脊髓水肿等,但患者症状并无改善。再次结合影像学检查结果,提示血管病变可能;于是对该患者进一步完善脊髓DSA,最终明确诊断为SDAVF。
因易于延误诊断,许多患者在明确诊断时已存在严重的运动功能、感觉功能、性功能以及括约肌功能障碍。在一项大型的关于SDAVF的研究中,下肢无力是最常见的首发症状(71.8%),其次为感觉障碍(70.2%)以及括约肌功能障碍(26.7%);由于疾病进展,明确诊断时上述症状的发生率分别高达80.8%、85.6%和52.5%;首次误诊率高达81%,错误治疗率达62%,主要的错误诊断包括脊髓退行性变(50%)、脊髓炎(22%)、前列腺疾病(5%)以及髓内肿瘤(4.5%)等[8]。不幸的是,一些潜在可治的功能缺损,由于治疗不及时,而在疾病确诊时已难以逆转[4,9-10]。与以往大多数首次被误诊的SDAVF患者一样,本患者亦被首次误诊为“脊髓病变(炎性可能)”,并接受了相应的错误治疗,反映了本病在首次就诊时可获得正确诊断的困难性。
SDAVF极少发生自行闭合,其治疗旨在阻止疾病进展甚至逆转疾病进程。目前,SDAVF的主要治疗手段包括血管内治疗和开放手术治疗,可单独或联合使用。这2种治疗手段的目的均是在瘘管与硬膜连接处中断引流的根静脉,从而去除导致硬膜内静脉系统阻塞的源头,减轻脊髓水肿。在完全闭合瘘口后,水肿和血管扩张会随之消退,但术后恢复情况取决于治疗期间的临床和影像学特征反映出来的疾病严重程度。早期治疗能够改善预后,阻止症状恶化至不可逆转的程度[11-12]。本病例从发病至接受手术治疗的时间间隔为10个月,有较明显的下肢运动、感觉障碍及自主神经功能障碍,但与大多数患者相比,治疗已相对及时,术后亦达到了较为理想的治疗效果。
2.2 影像学讨论(上海交通大学医学院附属仁济医院影像科,陈增爱 教授)
SDAVF的确诊有赖于脊髓DSA,而脊髓MRI对于本病的诊断极为重要。SDAVF在常规MRI图像上的典型表现为三联征。(1)T2加权成像脊髓矢状位主要显示为中心分布的高信号,提示脊髓水肿,可见于90%的患者,可以是局灶性或包括多个连续的节段;在极少数情况下,可见全脊髓水肿[1-3]。(2)T2加权成像显示环绕脊髓的软脊膜血流流空影,尤以脊髓背侧为甚,反映的是充血的静脉,可见于80%~95%的患者[1-2];扩张的静脉能够通过重T2加权成像序列,如相长相干稳态序列或稳态采集快速成像序列,得到更好的显现[7,13],表现为螺旋形流空信号;由于瘘管内血流缓慢,有时候血管影仅在T1加权成像对比增强序列上可见[2-3]。(3)T1加权成像对比增强序列可见脊髓强化,可能与静脉充血及血脑屏障破坏有关,常出现于疾病晚期,提示疾病进展及脊髓损害,晚期可有脊髓萎缩[2]。有研究指出,SDAVF存在脊髓周围边缘细小的T2加权成像低信号,可能与扩张的脊髓毛细血管和静脉系统内血流速度缓慢、含有去氧血红蛋白有关,也可能仅仅是一个视觉假象,是脊髓周围带在高信号的脑脊液和异常脊髓中央带之间凸显出来的轮廓而已[14]。SDAVF经治疗后,T2加权成像的高信号、显著的流空影以及增强表现将随时间缓慢消失,但可能持续数年。常规MRI发现脊髓肿胀合并异常鞘内血管是SDAVF的特异征象,敏感度达97%;然而,10%的患者未见脊髓水肿,20%的患者未见血管扩张。此外,在疾病早期血脑屏障未受到破坏之前,脊髓常无强化[7]。
本病例脊髓MRI增强扫描结果显示第9胸椎至马尾髓内T2加权成像高信号影,无明显强化,病灶为长节段性,呈中心分布,无增粗,无占位效应,伴轻度萎缩,故考虑非肿瘤性病变。T1加权成像对比增强序列可见脊髓背侧串珠状强化的血管影,首先考虑血管畸形。椎管内血管畸形可分为3种:髓外硬脊膜动静脉瘘(最常见)、髓外硬膜下动静脉瘘、髓内动静脉畸形(少见)。结合本病例的临床表现,首先考虑SDAVF。
根据脊髓DSA结果[2,15],近80%的SDAVF病灶位于第6胸椎和第2腰椎之间,只有4%位于骶髓,2%靠近枕骨大孔的高位颈髓,而位于低位颈髓者极为罕见。DSA能够明确瘘口位置。在极少数情况下,0.5%~4.0%的患者有1个以上瘘口。MRI很少能够明确瘘口部位,因瘘口水平与T2加权成像矢状位改变及髓周血管扩张无相关性,但粗大的引流静脉相对集中的节段常常提示该部位为瘘口所在节段。首过对比增强磁共振血管成像(first-pass contrast-enhanced magnetic resonance angiography)能够显示早期根静脉的充盈,因此能够明确病灶的水平,在脊髓血管造影时具有指导意义,能够减少需要筛选的层面,从而缩短操作时间,减少造影剂的剂量[12]。一旦MRI特征提示SDAVF诊断,应进一步行脊髓MRA予以证实,有助于明确瘘口的平面,以缩小脊髓DSA检查范围。
3 小 结
SDAVF是一种罕见的、获得性的硬脊膜根动脉与硬脊膜内根静脉的异常连接,在所有脊髓血管畸形中又最常见。SDAVF临床表现混杂,多不具有特异性,老年人以慢性进行性脊髓病变症状为表现时,均应考虑本病可能。脊髓MRI对提示SDAVF诊断具有重要作用。临床医师和影像科医师均应掌握SDAVF的经典MRI特征,尽早做出正确诊断。早期治疗能够改善SDAVF患者的预后,避免症状恶化至不可逆转的程度。
[1]LEE J,LlM YM,SUH DC,et al.Clinical presentation,imaging findings,and prognosis of spinal dural arteriovenous fistula[J].J Clin Neurosci,2016,26:105-109.
[2]MAlMON S,LUCKMAN Y,STRAUSS l.Spinal dural arteriovenous fistula: a review[J].Adv Tech Stand Neurosurg,2016,43:111-137.
[3]JENG Y,CHEN DY,HSU HL,et al.Spinal dural arteriovenous fistula: imaging features and its mimics[J].Korean J Radiol,2015,16(5):1119-1131.
[4]JELLEMA K,CANTA LR,TlJSSEN CC,et al.Spinal dural arteriovenous fistulas: clinical features in 80 patients[J].J Neurol Neurosurg Psychiatry,2003,74(10):1438-1440.
[5]JELLEMA K,TlJSSEN CC,VAN GlJN J.Spinal dural arteriovenous fistulas: a congestive myelopathy that initially mimics a peripheral nerve disorder[J].Brain,2006,129(Pt 12):3150-3164.
[6]MATSUMOTO H,MlNAMl H,YAMAURA l,et al.Newly detected cervical spinal dural arteriovenous fistula on magnetic resonance angiography causing intracranial subarachnoid hemorrhage[J/OL].World Neurosurg,2017,105:1038.e1-1038.e9(2017-06-20)[2018-03-10].DOl:10.1016/j.wneu.2017.06.079.
[7]Morris JM.lmaging of dural arteriovenous fistula[J].Radiol Clin North Am,2012,50(4):823-839.
[8]DONGHAl W,NlNG Y,PENG Z,et al.The diagnosis of spinal dural arteriovenous fistulas[J/OL].Spine(Phila Pa1976),2013,38(9):E546-553(2013-04-20)[2018-03-10].DOl:10.1097/BRS.0b013e31828a38c4.
[9]LEV N,MAlMON S,RAPPAPORT ZH,et al.Spinal dural arteriovenous fistulae-a diagnostic challenge[J].lsr Med Assoc J,2001,3(7):492-496.
[10]WOJClECHOWSKl J,KUNERT P,NOWAK A,et al.Surgical treatment for spinal dural arteriovenous fistulas: Outcome,complications and prognostic factors[J].Neurol Neurochir Pol,2017,51(6):446-453.
[11]SASAMORl T,HlDA K,YANO S,et al.Long-term outcomes after surgical and endovascular treatment of spinal dural arteriovenous fistulae[J].Eur Spine J,2016,25(3):748-754.
[12]DURNFORD AJ,HEMPENSTALL J,SADEK AR,et al.Degree and duration of functional improvement on long-term follow-up of spinal dural arteriovenous fistulae occluded by endovascular and surgical treatment[J].World Neurosurg,2017,107:488-494.
[13]KRALlK SF,MURPH D,MEHTA P,et al.Diagnosis of spinal dural arteriovenous fistula using 3D T2-weighted imaging[J].Neuroradiology,2017,59(10):997-1002.
[14]QUENCER RM.ls peripheral spinal cord hypointensity a sign of venous hypertensive myelopathy?[J].AJNR Am J Neuroradiol,2000,21(4):617.
[15]SARAF-LAVl E,BOWEN BC,QUENCER RM,et al.Detection of spinal dural arteriovenous fistulae with MR imaging and contrastenhanced MR angiography: sensitivity,specificity,and prediction of vertebral level[J].AJNR Am J Neuroradiol,2002,23(5):858-867.

