多发性多形性成胶质细胞瘤的鉴别诊断:1例报告及专家解读
吴宜凡 ,吴恒趋 ,李建萍 ,陈增爱 ,管阳太
1.上海交通大学医学院附属仁济医院神经内科,上海 200127
2.上海交通大学医学院附属仁济医院影像科,上海 200127
1 病例报告
1.1 主诉
患者,男性,59岁。因“发作性口角向左侧歪斜伴抽动2 d”入院。患者入院前2 d无明显诱因下出现头部及口角向左侧歪斜数次,伴双眼向左凝视、言语含糊。2016年4月10日至上海交通大学医学院附属仁济医院神经内科就诊。
1.2 既往史
家属代诉,患者于本次发病1个月前出现1次短暂性记忆力模糊,表现为记不清自己是谁。
1.3 神经系统查体
左眼下视受限。其余神经系统体格检查未见明显异常。
1.4 腰椎穿刺脑脊液检查
白细胞计数为0×106/L,蛋白质含量为282.0 mg/L,免疫球蛋白正常。脑脊液涂片见个别淋巴细胞,未见恶性证据。肿瘤免疫标志物未见阳性表达。
1.5 影像学检查
入院时(2016年4月10日),头颅计算机断层成像(computed tomography,CT)平扫显示右侧额叶及左侧顶枕叶稍高密度灶(图1);头颅磁共振成像(magnetic resonance imaging,MRI)显示右侧额叶及左侧顶枕叶近皮层T1加权成像低信号影,T2加权成像及液体衰减反转 恢 复(fluid attenuated inversion recovery,FLAIR)序列为高信号影;磁共振弥散加权成像diffusion weighted imaging,DWI)序列呈高信号影,病灶周围水肿不明显,病灶呈斑片状强化,提示血管性病变可能(图2)。对左顶枕叶病灶进行磁共振波谱分析(magnetic resonance spectroscopy,MRS),结果提示肿瘤性病变可能(图3)。
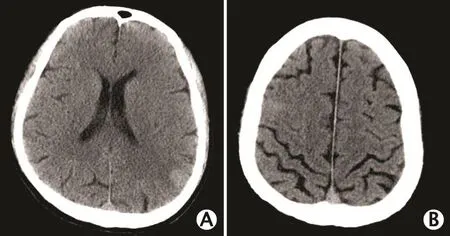
图1 1例59岁多发性多形性成胶质细胞瘤男性患者的头颅计算机断层成像(computed tomography,CT)平扫图像(2016年4月10日):左侧顶枕叶结节状稍高密度影(A),右侧额叶斑片状稍高密度影,边界欠清(B)
约3个月后(2016年7月7日)复查MRI,发现右额叶及左顶枕叶病灶较前(图2)明显增大且强化明显,左侧顶枕叶病灶伴局部坏死及出血,周围轻度水肿改变,诊断倾向于肿瘤性病变(图4)。
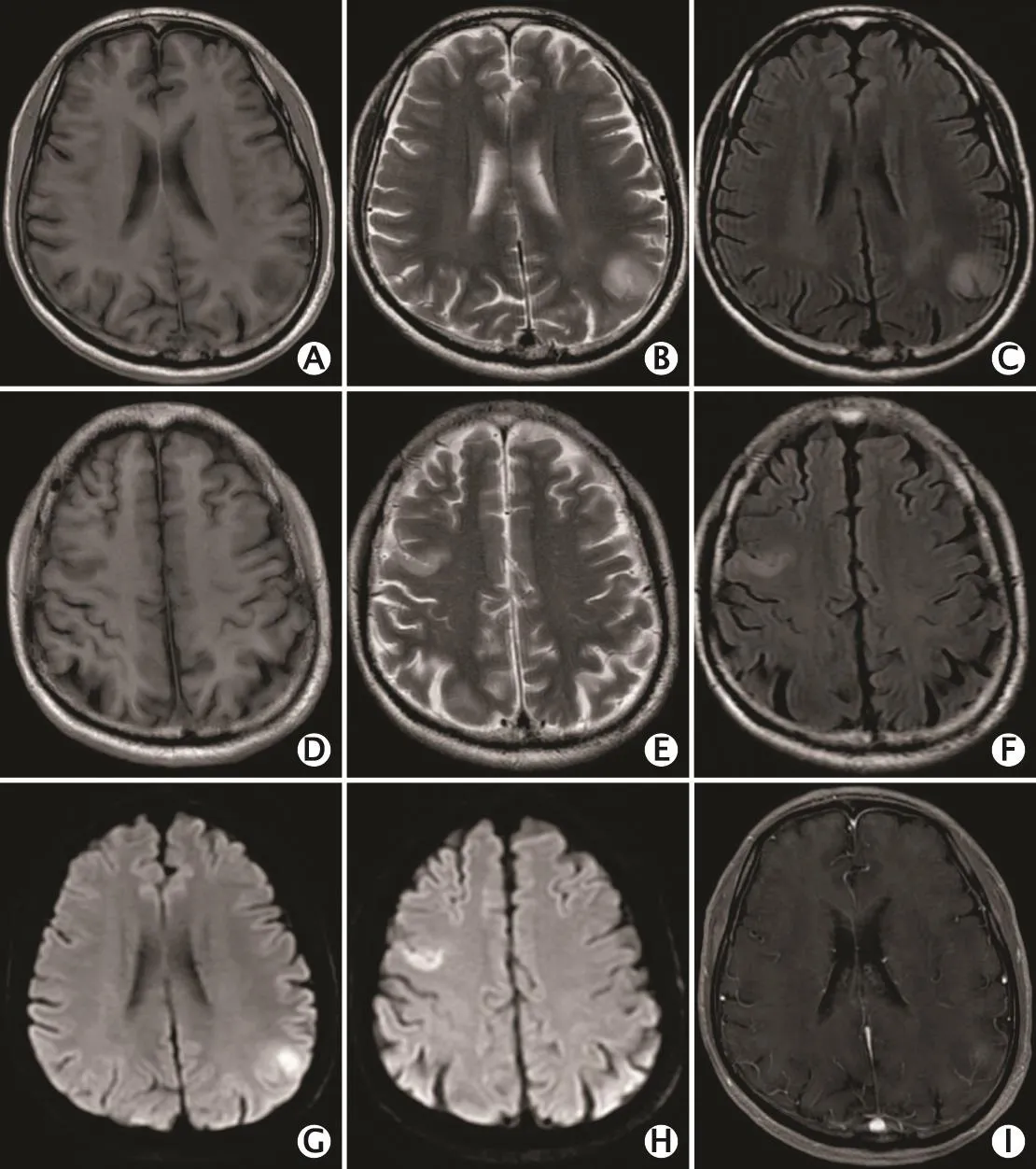
图2 1例59岁多发性多形性成胶质细胞瘤男性患者的头颅磁共振成像(magnetic resonance imaging,MRl)平扫图像(2016年4月10日):右额叶及左枕叶斑片状异常信号影,T1加权成像呈低信号影(A、D),T2加权成像呈高信号影(B、E),液体衰减反转恢复(fluid attenuated inversion recovery,FLAlR)序列呈高信号影(C、F),磁共振弥散加权成像(diffusion weighted imaging,DWl)序列弥散受限(G、H),注入造影剂后病灶中央呈斑片状强化,其中右额叶病灶在动脉期强化明显(l)
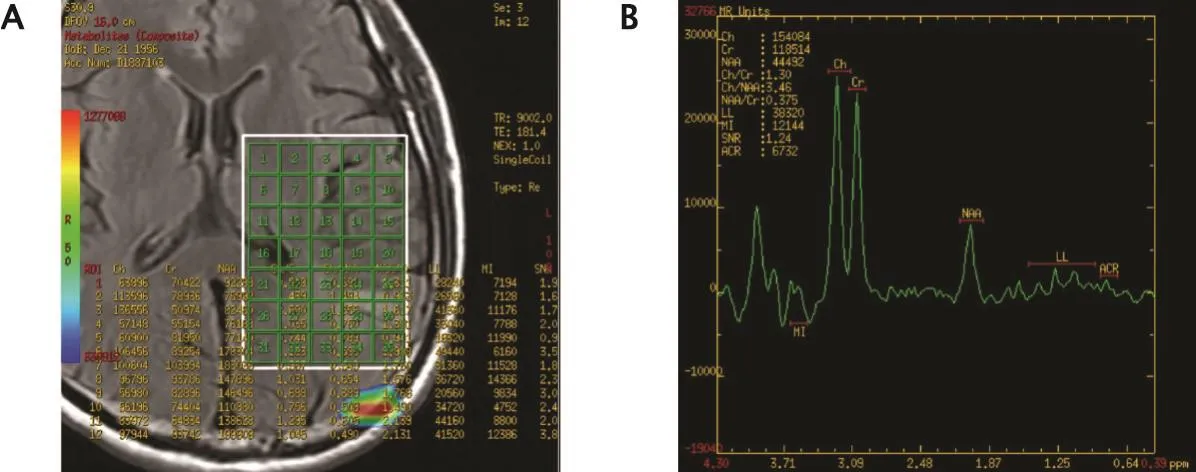
图3 1例59岁多发性多形性成胶质细胞瘤男性患者的头颅磁共振波谱分析(magnetic resonance spectroscopy,MRS)(2016年4月10日)结果:左枕叶病灶ROl30 MRS可见N-乙酰天门冬氨酸、肌酸、胆碱峰,N-乙酰天门冬氨酸峰下降,胆碱峰升高。胆碱/肌酸比值为1.3,胆碱/N-乙酰天门冬氨酸比值为3.46,可见乳酸峰(B)
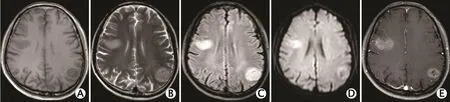
图4 1例59岁多发性多形性成胶质细胞瘤男性患者的头颅磁共振成像(magnetic resonance imaging,MRl)平扫及增强扫描图像(2016年7月7日):右额叶及左顶枕叶灰白质交界处斑片状异常信号影,T1加权成像呈低信号影,局部可见斑片状高或低信号影(A),T2加权成像呈稍高信号影,局部可见斑片状更高信号影(B),液体衰减反转恢复(fluid attenuated inversion recovery,FLAlR)序列呈高信号影,周围轻度水肿(C),磁共振弥散加权成像(diffusion weighted imaging,DWl)序列弥散受限(D),注入造影剂后病灶呈不均匀显著强化(E)
1.6 诊断和治疗
本病例以癫痫样发作起病,神经系统体格检查提示左眼下视受限,结合患者曾有记忆模糊病史,病灶定位为高级皮层。根据CT及MRI检查结果,病灶位于双侧大脑半球,且伴有强化,MRS提示病灶内异常代谢,脑脊液检查提示恶性肿瘤诊断依据不足,因此首先考虑血管性病变,但肿瘤不能排除。给予丙戊酸钠控制癫痫发作,辅以改善循环等治疗,并建议患者进一步接受脑部病灶活检以明确诊断。患者于3个月后在外院接受手术切除治疗,术后病理为多发性多形性成胶质细胞瘤(glioblastoma multiforme,GBM)[世界卫生组织(World Health Organization,WHO)分级为Ⅳ级];术后接受放疗和化疗。手术、放疗和化疗的具体信息不详。
2 专家解读
2.1 临床讨论(上海交通大学医学院附属仁济医院神经内科,管阳太 教授)
GBM是最常见,同时也是恶性程度最高的中枢神经系统肿瘤之一。根据美国脑肿瘤注册中心(Central Brain Tumor Registry of the United States,CBTRUS)统计,GBM占原发脑肿瘤的14.9%及原发性恶性脑肿瘤的47.1%,发病率为3.19/10万。同时,GBM发病率随年龄增长而升高,75~84岁为其最高发年龄段,且男性较女性多发[1]。
GBM起病隐匿,临床表现不典型,常见表现有头痛(57.3%)、记忆力减退(39.2%)、认知功能障碍(38.8%)、运动障碍(33.0%)、语言障碍(32.4%)、癫痫(31.9%)、人格改变(23.1%)、视力障碍(21.6%)、感觉障碍(12.6%)等[2],其他较少见的症状包括晕厥发作、眩晕、周围神经病变等[3]。这些非特异性临床表现为GBM的诊断带来很大的挑战。因此,影像学检查是胶质瘤诊断及术后评估的重要手段。GBM在CT图像上多表现为颅内密度不均的占位性病灶,且边界不清,多见强化。同时,病灶中心常见坏死,以及强化外可见脑水肿,亦是恶性胶质瘤的常见影像学表现[4],通过头颅CT可初步发现可疑患者。
GBM预后极差,其中位生存期为4~10个月,且多发性GBM的预后较单发性GBM差[5],因此在临床上应尽早诊断、尽早治疗。GBM诊断的金标准仍为病理学检查。通常根据临床表现,结合影像学典型特征,可做出初步诊断,也可通过脑脊液脱落细胞检查以进一步诊断。然而,在中枢神经系统肿瘤中,脑脊液脱落细胞阳性率仅为10%[6]。因此,脑脊液检查对脑肿瘤的诊断敏感度不高。近年来,在脑脊液中寻找其他生物学标志物已成为研究热点。目前已有研究表明,脑脊液微小RNA在非肿瘤性疾病、良性肿瘤和恶性肿瘤中的差异表达,可能有助于临床诊断[7]。
本病例以癫痫样发作起病,MRI提示颅内多发异常信号影,且伴有斑片状强化,性质难定。此后,复查MRI发现病灶扩大,强化明显,倾向于肿瘤性病变。外院术后病理诊断为成胶质细胞瘤[未分型(not otherwise specified,NOS)]。
从内科治疗角度分析,癫痫是脑胶质瘤患者较为常见的临床表现,30%~60%的胶质瘤患者在病程中出现癫痫发作。目前仍然认为,应对这些患者进行积极的抗癫痫治疗。SIZOO等[8]发现35%的患者在停用抗癫痫药物后出现癫痫再次发作。有研究发现,相较于卡马西平和苯妥英钠,胶质瘤患者对左乙拉西坦的耐受性较好;丙戊酸钠不仅对控制癫痫症状有效,同时能起到抗肿瘤的作用[9-10]。
2.2 影像学讨论(上海交通大学医学院附属仁济医院影像科,陈增爱 教授)
10%~20%的GBM在影像学上表现为多灶性占位。GBM多见于大脑白质,伴周围皮质浸润,CT表现为低密度或等密度病灶,多数可见强化。头颅MRI的T1加权成像多呈等信号或低信号影,T2加权成像多呈等信号或高信号影,多数可见强化,若肿瘤中心出现坏死,则可表现为环状强化。由于细胞密度增加,病灶在DWI序列图像上可表现为弥散受限[4,11-12]。
本病例的影像学特点为病灶多发且不对称,分布于2个大脑半球。第1次CT检查发现高密度灶,可能与细胞密集以及肿瘤尚未发生坏死有关。3个月后MRI检查发现病灶明显增大,表明病变生长迅速、进展较快,符合GBM的特点;并且,左侧枕顶叶病灶出现出血坏死,发生异质性改变,反映了病灶进展程度、分化程度的不同。DWI呈高信号影,在一定程度上反映了病灶的恶性程度,与肿瘤细胞增殖旺盛及细胞密集有关。本病例最终的病理诊断为GBM,证实了之前的推测。多发性GBM可分为多中心性(multicentric)和多灶性(multifocal)2种。多中心性GBM是脑内多个中心发生的肿瘤,可发生于双侧半球或不同的脑叶,肉眼或显微镜下可见各肿瘤病灶之间互不相连;多灶性GBM的肿瘤起源于一处,之后弥散或转移至颅内其他部位[13]。从MRI影像学特征来看,此病例为多中心性GBM。
颅内脑实质的多发性病灶应与血管性疾病、转移瘤、淋巴瘤等进行鉴别。值得注意的是,一些脑血管疾病,如颅内深静脉窦血栓、动脉炎或急性期脑梗死,在MRI图像上亦可表现为T2加权成像、FLAIR及DWI序列高信号,亚急性期梗死也可出现病灶强化[11],血管炎时可见信号不均而提示中心出血,这些表现均与肿瘤类似。本病例于2016年4月接受MRI检查发现病灶的T1加权成像呈低信号影,T2加权成像和FLAIR序列呈高信号影,DWI序列呈弥散受限改变,因此需要与血管性病变进行鉴别。头颅MRS有助于对此进行鉴别。颅内肿瘤的MRS表现大多为N-乙酰天门冬氨酸(N-acetyl-aspartate,NAA)峰降低、胆碱(choline,Cho)峰升高,可见乳酸(lactic acid,Lac)峰及脂质(lipid)峰[14]。此外,脑梗死急性期也可有NAA峰降低,Lac峰出现[15],但Cho峰通常不升高;炎性病变时,也可见Cho峰升高,有些类型的血管炎亦可表现为Cho/NAA比值升高,同时NAA峰也可升高[16-17]。HORSKÁ等[14]研究发现,当病变部位Cho/非病变部位Cho比值>1.3且Cho/NAA比值>1时,可考虑病灶为肿瘤可能。一项研究对84例颅内实性病灶进行分析,结果显示Cho/NAA比值>1.9时提示肿瘤可能性较大[18]。本病例MRS结果显示Cho/NAA比值为3.46,提示肿瘤可能性。此外,血管性病变的诊断还可借助于磁共振血管成像(magnetic resonance angiography,MRA)、磁共振静脉造影(magnetic resonance venography,MRV)和数字减影血管造影(digital substraction angiography,DSA)等影像学检查手段。
转移瘤是颅内多发病灶的常见原因之一。转移瘤的MRI表现为T2加权成像为高信号影,DWI序列显示弥散受限;MRS可见Cho峰升高、NAA峰降低,也可见Lac峰和脂质峰[11,14],这些表现均与GBM类似。转移瘤多见于大脑皮质或白质与灰质交界处,也可见于幕下,病灶边界多清晰,周围水肿明显;而GBM多见于幕上,多累及皮质,边界不清,周围水肿不明显[19]。LAW等[20]的研究表明,GBM病灶的Cho/肌酸(creatine,Cr)比值较转移瘤升高(3.92±3.31vs1.84±1.22,P<0.05),病灶周围处Cho/Cr比值亦明显升高(2.28±1.24vs0.76±0.23,P< 0.001), 而NAA/Cho比值的差异无统计学意义。因此,病灶周围组织的代谢分析结果可以作为鉴别诊断的要点。本病例的病灶位于双侧大脑半球,边界不清,周围水肿不明显,且既往无肿瘤病史,因此转移瘤可能性较小。此外,正电子发射计算机断层成像(positron emission tomography,PET)也有助于鉴别肿瘤与非肿瘤性病灶,以及寻找其他部位的原发肿瘤。
近年来,原发性中枢神经系统淋巴瘤的发病率呈增加趋势。20%~40%的原发性中枢神经系统淋巴瘤为多发性。本病例的头颅CT显示病灶呈高密度影,DWI序列表现为弥散受限,因此需与淋巴瘤进行鉴别。淋巴瘤的好发部位为脑室周围白质、胼胝体、皮质和基底节,较少累及皮髓质交界区和小脑,且有明显的向脑室周围扩展的倾向,且各病灶的增强程度大多一致[21],可资鉴别。
此外,MRS还可用于区分胶质瘤类型。目前认为,病灶中2-羟戊二酸水平升高与异环氧合酶脱氢酶(isoepoxydon dehydrogenase,IDH)基因突变相关,因此MRS显示2-羟戊二酸代谢增加可提示肿瘤为IDH突变型胶质瘤。MRI图像上非强化区域的比例、较大的病灶范围以及囊样病灶或卫星灶均可提示IDH突变型肿瘤的可能[22]。IDH突变型胶质瘤大多为低级别胶质瘤,在低级别胶质瘤中的发生率大多>50%,而在高级别胶质瘤中发生率为5%~10%。即使是在高级别胶质瘤中,IDH突变型胶质瘤患者的预后也远好于IDH野生型胶质瘤患者[23-24]。一项对326例GBM患者进行的回顾性研究结果显示,在生存期>36个月的患者中,IDH突变检出率为34%,而生存期不足36个月的患者的IDH突变检出率仅为4%[25]。
3 要点小结
GBM是一种发病率较低的中枢神经系统肿瘤,恶性程度高、预后差,因此应及早诊断、及早治疗。然而,GBM的临床表现多样且不典型,疾病早期的CT及增强MRI表现亦不典型。对病灶进行代谢分析(如MRS等)有助于进一步鉴别肿瘤与非肿瘤性病灶,并可明确肿瘤的性质。此外,临床工作者也应在现有诊断手段的基础上,积极寻找新的诊断方法,借助多种方法辅助临床诊断。
[1]OSTROM QT,GlTTLEMAN H,LlAO P,et al.CBTRUS Statistical Report: Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014[J].Neuro Oncol,2017,19(Suppl_5):v1-v88.
[2]CHANG SM,PARNEY lF,HUANG W,et al.Patterns of care for adults with newly diagnosed malignant glioma[J].JAMA,2005,293(5):557-564.
[3]SANLl AM,TURKOGLU E,DOLGUN H,et al.Unusual manifestations of primary glioblastoma multiforme: A report of three cases[J/OL].Surg Neurol lnt,2010,1:87(2010-12-22)[2018-03-04].DOl:10.410 3/2152-7806.74146.
[4]WELLER M,VAN DEN BENT M,HOPKlNS K,et al.EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma[J/OL].Lancet Oncol,2014,15(9):e395-e403[2018-03-04].DOl:10.1016/S1470-2045(14)70011-7.
[5]PATlL CG,Yl A,ELRAMSlSY A,et al.Prognosis of patients with multifocal glioblastoma: a case-control study[J].J Neurosurg,2012,117(4):705-711.
[6]CHHlENG DC,ELGERT P,COHEN JM,et al.Cytology of primary central nervous system neoplasms in cerebrospinal fluid specimens[J].Diagn Cytopathol,2002,26(4):209-212.
[7]DRUSCO A,BOTTONl A,LAGANÀ A,et al.A differentially expressed set of microRNAs in cerebro-spinal fluid (CSF) can diagnose CNS malignancies[J].Oncotarget,2015,6(25):20829-20839.
[8]SlZOO EM,KOEKKOEK JA,POSTMA TJ,et al.Seizures in patients with high-grade glioma: a serious challenge in the end-of-life phase[J].BMJ Support Palliat Care,2014,4(1):77-80.
[9]KERKHOF M,VECHT CJ.Seizure characteristics and prognostic factors of gliomas[J].Epilepsia,2013,54(Suppl 9):12-17.
[10]lUCHl T,HASEGAWA Y,KAWASAKl K,et al.Epilepsy in patients with gliomas: incidence and control of seizures[J].J Clin Neurosci,2015,22(1):87-91.
[11]FAEHNDRlCH J,WElDAUER S,PlLATUS U,et al.Neuroradiological viewpoint on the diagnostics of space-occupying brain lesions[J].Clin Neuroradiol,2011,21(3):123-139.
[12]LAFlTTE F,MOREL-PRECETTl S,MARTlNDUVERNEUlL N,et al.Multiple glioblastomas:CT and MR features[J].Eur Radiol,2001,11(1):131-136.
[13]LlU Q,LlU Y,Ll W,et al.Genetic,epigenetic,and molecular landscapes of multifocal and multicentric glioblastoma[J].Acta Neuropathol,2015,130(4):587-597.
[14]HORSKÁ A,BARKER PB.lmaging of brain tumors: MR spectroscopy and metabolic imaging[J].Neuroimaging Clin N Am,2010,20(3):293-310.
[15]DANl KA,WARACH S.Metabolic imaging of ischemic stroke: the present and future[J].AJNR Am J Neuroradiol,2014,35(6 Suppl):S37-S43.
[16]LEE Y,KlM JH,KlM E,et al.Tumor-mimicking primary angiitis of the central nervous system: initial and follow-up MR features[J].Neuroradiology,2009,51(10):651-659.
[17]PANCHAL NJ,NlKU S,lMBESl SG.Lymphocytic vasculitis mimicking aggressive multifocal cerebral neoplasm: mr imaging and MR spectroscopic appearance[J].AJNR Am J Neuroradiol,2005,26(3):642-645.
[18]MAJÓS C,AGUlLERA C,ALONSO J,et al.Proton MR spectroscopy improves discrimination between tumor and pseudotumoral lesion in solid brain masses[J].AJNR Am J Neuroradiol,2009,30(3):544-551.
[19]GlANNOPOULOS S,KYRlTSlS AP.Diagnosis and management of multifocal gliomas[J].Oncology,2010,79(3-4):306-312.
[20]LAW M,CHA S,KNOPP EA,et al.Highgrade gliomas and solitary metastases:differentiation by using perfusion and proton spectroscopic MR imaging[J].Radiology,2002,222(3):715-721.
[21]NABAVlZADEH SA,VOSSOUGH A,HAJMOMENlAN M,et al.Neuroimaging in central nervous system lymphoma[J].Hematol Oncol Clin North Am,2016,30(4):799-821.
[22]CARRlLLO JA,LAl A,NGHlEMPHU PL,et al.Relationship between tumor enhancement,edema,lDH1 mutational status,MGMTpromoter methylation,and survival in glioblastoma[J].AJNR Am J Neuroradiol,2012,33(7):1349-1355.
[23]NAGASHlMA H,TANAKA K,SASAYAMA T,et al.Diagnostic value of glutamate with 2-hydroxyglutarate in magnetic resonance spectroscopy forlDH1 mutant glioma[J].Neuro Oncol,2016,18(11):1559-1568.
[24]YAN H,PARSONS DW,JlN G,et al.lDH1 andlDH2 mutations in gliomas[J].N Engl J Med,2009,360(8):765-773.
[25]HARTMANN C,HENTSCHEL B,SlMON M,et al.Long-term survival in primary glioblastoma with versus without isocitrate dehydrogenase mutations[J].Clin Cancer Res,2013,19(18):5146-5157.

