口腔颌面部细菌感染体外模型的建立
史庆怡,孔晨飞,王晓峰*, 张天夫*
(吉林大学中日联谊医院 1.口腔科;2.科学研究中心,吉林 长春130033)
口腔颌面部感染在早期没有得到有效的治疗,会引发颌面部感染,可并发颌面蜂窝织炎、下颌骨骨髓炎等,甚至导致全身性的感染,严重者会威胁生命[1]。急性炎症涉及多个环节诱导产生的免疫介质网络,其中以促炎症因子TNF-α、IL-1 以及IL-6 等前炎症细胞因子最为重要[2,3]。TNF-α、IL-1 和IL-6被早期应答触发,通过上调黏附分子和趋化因子的表达而吸引炎症细胞循环,在宿主防御微生物感染中起重要作用[4]。本次实验中,我们利用细菌脂多糖(LPS)刺激小鼠结缔组织成纤维细胞L929初步模拟了体外口腔颌面部感染模型[5],应用CCK-8、PCR和ELISA等方法检测了不同时间点细胞培养基上清中炎症因子及趋化因子等相关基因的表达变化。并检测了LPS刺激后小鼠巨噬细胞RAW264.7对感染的应答情况,探讨炎症刺激对于机体及免疫细胞的影响,为口腔颌面部感染后的早期诊断和治疗提供了实验依据。
1 材料与方法
1.1 材料
小鼠结缔组织成纤维细胞L929、小鼠巨噬细胞RAW264.7(吉林大学中日联谊医院科学研究中心)。RPMI-1640、IMDM培养液、胎牛血清、0.25%含EDTA胰酶(美国Gibco 公司);RNA 提取试剂Trizol (美国Invitrogen公司);premix Taq(Roche公司);M-MLV 逆转录酶、LPS(Sigma公司);IL-6 ELISA检测试剂盒(美国R&D公司);引物由上海生工生物工程有限公司合成。
1.2 细胞培养与处理
L929、RAW264.7细胞分别培养于含10 %胎牛血清的IMEM、1640培养液中(含10% 青霉素和链霉素),37 ℃ 5% CO2。2-3天传代1次。细胞铺于的6孔板中,待细胞扩增至70 %-80 %时,用PBS 冲洗3 次,加入含有LPS(50 μg/ml)的IMDM(不含胎牛血清和双抗)的培养液培养,分别培养6、12、24小时。PBS作为对照组。
1.3 CCK-8实验
细胞以2×103细胞/孔密度接种于96孔板中,复种2孔,37℃ 5% CO2过夜。分别加入20、30、40、50、60 μg/ml LPS,培养6、12、24 h后,加入CCK-8检测450 nm处OD值。取3孔平均值,进行统计分析。
1.4 定量实时聚合酶链反应(RT-PCR)
采用Trizol试剂提取总RNA,以200-500 ng RNA为cDNA合成标准。反应条件为:95℃ 10 min,95℃ 5 s,60℃ 30 s,72℃ 20 s。而后进行QPCR定量检测。利用基因特异引物PCR检测不同循环RNA研究的描述的表达水平。用2(-DDCT)法计算相关基因的表达。相关引物如下:
GAPDH,上游引物序列:5’-GTCGTACCACACGGCATTGTATGG-3’,下游引物序列:5’-GCAATGCCTGGGTACATGGTGG-3’,
TNF,上游引物序列:5’-GCGACGTGGAACTGGCAGAAG-3’,下游引物序列:5’-GAATGAGAAGAGGCTGAGACATAGGC-3’,
IL-1,上游引物序列5’-ACGAAGACTACAGTTCTGCCATTGAC -3’,下游引物序列:5’-AGCCTCATCGTCTCATTGCTTGTC -3’,
IL-6,上游引物序列:5’-AGACTTCCATCCAGTTGCCTTCTTG -3’,下游引物序列:5’-CATGTGTAATTAAGCCTCCGACTTGTG -3’,
IL-8,上游引物序列:5’-GCTGCTCAAGGCTGGTCCATG-3’,下游引物序列:5’-TGTTCCTGAATACACAGACATCGTAGC-3’,
IL-10,上游引物序列:5’-CTATGCTGCCTGCTCTTACTGACTG-3’,下游引物序列:5’-GAGTCGGTTAGCAGTATGTTGTCCAG-3’,
IL-23,上游引物序列:5’-GCACCTGCTTGACTCTGACATCTTC-3’,下游引物序列:5’-TGGCTGGAGGAGTTGGCTGAG-3’,
IL-33,上游引物序列:5’-AGACCAGGTGCTACTACGCTACTATG-3’,下游引物序列:5’-ACTCATGTTCACCATCAGCTTCTTCC-3’,
CXCL2,上游引物序列:5’-GACGGTCCGCTGCAACTGC-3’,下游引物序列:5’-GCGTCACACTCAAGCTCTGGATG-3’,
CXCL10,上游引物序列:5’-GACGGTCCGCTGCAACTGC-3’,下游引物序列:5’-CCGGATTCAGACATCTCTGCTCATC-3’,
GDF15,上游引物序列:5’-GAGAGGACTCGAACTCAGAACCAAG-3’,下游引物序列:5’-TCGGCGTCAGCAGGAGCAG-3’,
FOXO3,上游引物序列:5’-CCGTGAGCAAGCCGTGTACTG-3’,下游引物序列:5’-TATCCAGCAGGTCGTCCATGAGG-3’。
1.5 ELISA法测定细胞因子水平
细胞以5×105细胞/孔密度接种于24孔板中,分别培养6 h、12 h、24 h、48 h,每孔加入50 μg/ml LPS刺激24 h,PBS作为对照组。提取细胞上清液(4℃ 1 500 rpm 10 min),检测细胞培养上清液中IL-6 表达水平,数据以pg/ml表示。
1.6 统计分析
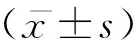
2 结果
2.1 CCK-8检测不同浓度LPS对细胞增殖的影响
为了探讨不同浓度LPS在不同时间点对于细胞增殖的影响,我们通过CCK-8实验在6、12、24 h分别检测了不同浓度 LPS(0-60 μg/ml)作用下L929和RAW264.7细胞增殖情况。两种细胞在450 nm波长下的吸光度值如图1所示。
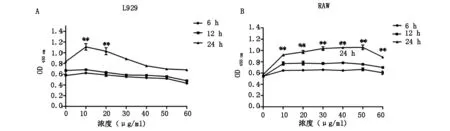
A:L929 B:RAW264.7 细胞分别用0、10、20、30、40、50、60 μg/ml LPS刺激0、6、12、24 h后CCK-8检测细胞增殖率。**P<0.01
L929细胞在(10-40 μg/ml) LPS作用6 h时与0 h对照组相比,增殖率无显著变化(P>0.05);而LPS浓度大于50 μg/ml时,细胞增殖率逐渐下降。当不同浓度LPS作用12 h时,细胞的生长曲线变化与6 h相似,说明LPS在短时间作用下对细胞的生长起持续抑制作用。当LPS刺激24 h,浓度小于20 μg/ml时,细胞增殖率显著上升(P<0.01);而随着浓度的增加(30-50 μg/ml),细胞增殖率开始下降;浓度到达50 μg/ml时,细胞增殖趋于平稳,说明LPS刺激能够引起细胞增长而高浓度则会抑制细胞的生长。因此在以后的实验中我们选择50 μg/ml LPS刺激24 h来检测小鼠L929细胞炎症因子的变化情况(图1A)。
RAW264.7细胞在LPS作用6 h,浓度小于10 μg/ml时,与0 h对照组相比,细胞增殖率升高。而LPS浓度增加对于细胞增殖无显著影响。不同浓度LPS刺激12 h细胞生长的曲线变化与6 h相似,说明在短时间内LPS能够促进细胞增殖。当LPS刺激24 h,浓度小于50 μg/ml时,细胞增殖率显著上升(P<0.01);而大于50 μg/ml时,细胞增殖率有所回落,说明长时间LPS刺激能够引起细胞明显增长而高浓度对细胞生长有抑制作用(图1B)。
2.2 RT-PCR检测L929细胞炎症因子、趋化因子及相关基因的表达变化水平
LPS(50 μg/ml)刺激24 h 检测TNF及炎症因子IL-1、IL-5、IL-6、IL-8、IL-33 mRNA表达水平。结果显示,与0 h相比,50 μg/ml的LPS刺激细胞24 h后,促炎因子TNF、IL-1、IL-5、IL-8、IL-33 的表达分别升高9.6、10.0、5.8、3.0、4.4倍,说明LPS刺激24 h能够引起炎症反应;而IL-6,IL-23没有发生明显变化。反之,抗炎因子IL-10、IL-13表达均下降了0.6倍,进一步证明炎症的发生。见图2。
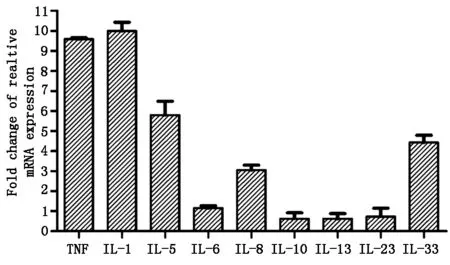
50 μg/ml LPS刺激L929细胞24 h后,RT-PCR检测细胞炎症因子的表达变化。相对mRNA表达倍数:50 μg/ml LPS刺激24 h相对mRNA表达量/0 μg/ml LPS刺激24 h相对mRNA表达量。
图2L929细胞炎症因子mRNA的表达量
此外,我们还检测了此炎症模型中趋化因子及相关基因的表达情况。结果发现,趋化因子CXCL2和转换生长因子GDF15 mRNA的表达分别升高5.2、6.9倍,说明LPS引起了炎症的发生,促进了CXCL2和GDF15的产生。而在LPS作用下转录因子FOXO3和趋化因子CXCL10的mRNA表达无明显变化(图3)。
2.3 ELISA检测细胞培养上清中IL-6的变化水平
如图4A 所示,用50 μg/ml LPS刺激L929细胞12、24、48 h,细胞上清中炎症因子IL-6 含量从0.75 pg/ml分别上升到13.69pg/ml(12小时)、45.52 pg/ml(48小时);100 μg/ml LPS刺激下IL-6 含量从0.75 pg/ml分别上升到7.00 pg/ml(12小时)、21.29 pg/ml(48小时);说明LPS能够引起L929细胞发生炎症反应。相同刺激时间内50 μg/ml LPS比100 μg/ml LPS刺激细胞分泌IL-6的含量多,说明LPS刺激L929细胞引起的炎症反应而分泌的IL-6不随着LPS浓度的升高而增加。
50 μg/ml LPS刺激0、6、12、24、48 h,RAW264.7细胞上清中炎症因子IL-6 含量分别为0.007、6.03、12.44、25.90、28.92 pg/ml;用100 μg/ml LPS刺激L929细胞0、6、12、24、48 h,细胞上清中炎症因子IL-6 含量分别为0.007、4.76、10.10、10.09、16.90、18.21 pg/ml,说明LPS刺激能够引起巨噬细胞发生免疫应答。与L929细胞一致,相同刺激时间内50 μg/ml LPS比100 μg/ml LPS刺激细胞分泌IL-6的含量多(图4B)。
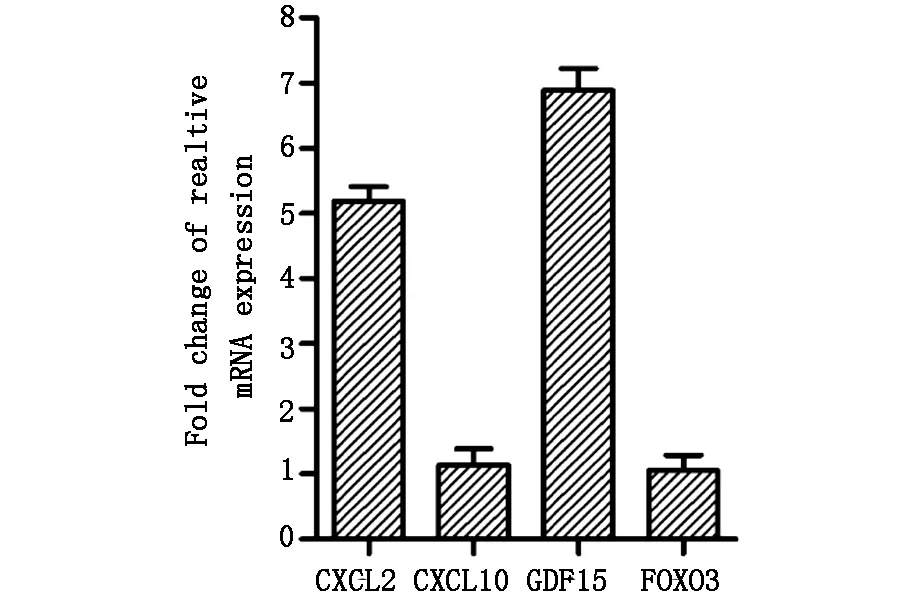
50 μg/ml LPS刺激L929细胞24 h后,RT-PCR检测细胞趋化因子及相关基因的表达变化。相对mRNA表达倍数:50 μg/ml LPS刺激24 h相对mRNA表达量/0 μg/ml LPS刺激24 h相对mRNA表达量。
图3L929细胞趋化因子及相关基因mRNA的表达量
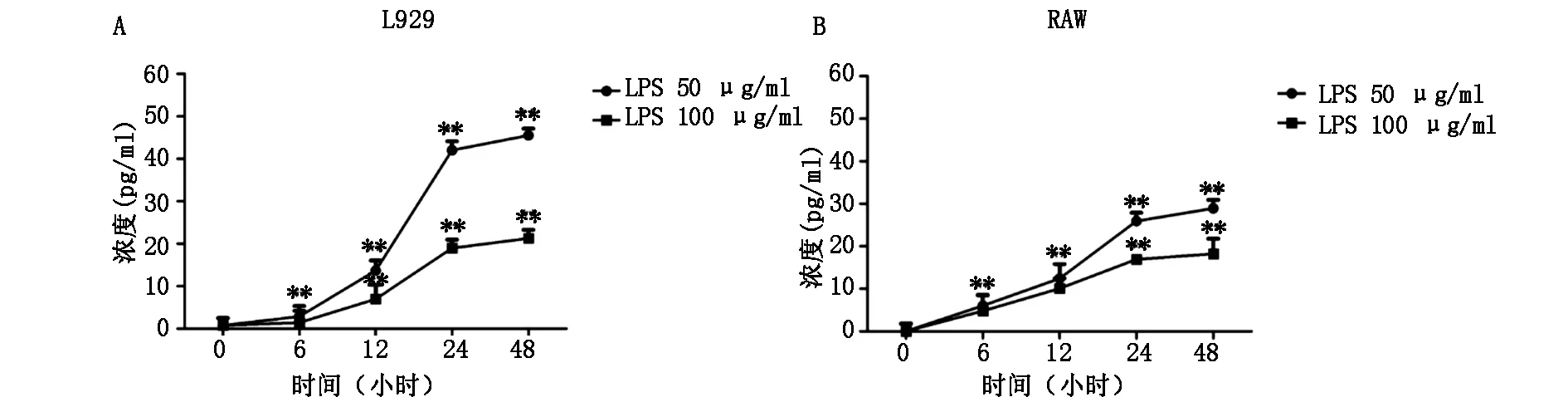
A:L929 B:RAW264.7 细胞分别用0、50、100 μg/ml LPS刺激0、6、12、24、48 h后,ELISA检测细胞炎症因子IL-6的含量变化。**P<0.01
3 讨论
口腔颌面部间隙感染是最常见的继发性口腔急性病症之一。由于颌面部软组织相互交错,之间存在不等量的疏松结缔组织和脂肪,并且包含丰富的淋巴及血液循环与之相通[6]。因此当发生感染时,疏松的结缔组织变性液化,形成脓肿,在疏松结缔组织内相互融通可以波及邻近间隙,进一步形成弥散性蜂窝织炎,严重感染者可引起全身中毒症状如脓毒血症,最后危及生命。由于疏松结缔组织是感染发生的关键部位,其存在成纤维细胞的活化表型,并且感染的发生可以使成纤维细胞活化,产生大量的促炎因子和趋化因子等,还能使其与中性粒细胞发生粘附作用,从而促进炎症的发生[6],因此我们选择了小鼠结缔组织成纤维细胞L929作为口腔颌面部感染体外模型的研究对象,利用这一细胞株研究了细菌感染对于细胞炎症因子的影响。
脂多糖是G-细菌细胞壁中的一种成分,脂多糖对宿主有毒性[7]。黄钢等人用LPS诱导U937(组织细胞淋巴瘤细胞)构建成了炎症模型,用LPS刺激U937,收集细胞上清液和细胞团块,采用ELISA检测其中B7-H1的表达,从而证明了LPS建立感染模型的成立[8]。链球菌和金黄色葡萄球菌是在成人口腔颌面部感染中最常检出的细菌[9],LPS能够识别分子在自然免疫的动态程序中发挥的作用。正因如此,我们选择LPS作为口腔颌面部感染模型中的治病因素[10],由LPS诱导L929感染招募了巨噬细胞的聚集,使巨噬细胞等免疫细胞释放某些炎症因子,造成细菌对组织和细胞的伤害要比自身对机体的影响更严重。
巨噬细胞是一种免疫细胞,它们的主要功能是以固定细胞或游离细胞的形式对细胞残片及病原体进行吞噬以及消化,并激活淋巴或相应的免疫细胞,令其对病原体作出反应[11]。张娜等人用LPS刺激巨噬细胞,构建感染模型证明 Foxo1 转录因子参与巨噬细胞引起的炎症反应。RAW264.7为小鼠腹腔巨噬细胞细胞株,在炎症细胞模型中常见[12]。我们研究在RAW264.7免疫细胞中可检测到炎症细胞因子的同时,也在L929 中检测到相关炎症因子,可以表明有感染和炎症的存在。
在炎症反应当中,主要致菌因素大多为细菌感染,所以在炎症环境下,常含有大量的细菌代谢产物,从而细胞释放出一些细胞炎症因子,可以趋化中性粒细胞、T细胞、嗜酸性粒细胞等向受感染的组织迁移[13],这些细胞和炎性细胞因子是引起炎症慢性化和组织损伤的重要因素。本实验研究中LPS可视为常见的金黄色葡萄球菌,用LPS感染L929结缔组织成纤维细胞初步模拟了体外感染模型,证实了金黄色葡萄球菌感染诱导炎症细胞因子TNF-α、IL-1α、IL-6、IL-8、IL-10、IL-13、IL-17、IL-33、CXCL2、CXCL10、GEF1B、GDF15 在颌面部感染中的表达变化,为临床上治疗口腔颌面部感染提供了实验依据。
参考文献:
[1]李佳伟,蔡协艺.口腔颌面部间隙感染病原菌研究现状[J].口腔颌面外科杂志,2013,23(3):225.
[2]Hsieh SF,Chou CT,Liang WZ,et al.The Effect of Magnolol on Ca2+Homeostasis and Its Related Physiology in Human Oral Cancer Cells[J].Arch Oral Biol,2018,89:49.
[3]白 虹,谢蜀生.炎症性细胞因子在沙眼衣原体肺感染中的表达及其与机体防御的关系[J].免疫学杂志,2004,20(4):274.
[4]Karta MR,Gavala ML,Curran CS,et al.Lps Modulates Rhinovirus-Induced Chemokine Secretion in Monocytes and Macrophages[J].Am J Respir Cell Mol Biol,2014,51(1):125.
[5]曹承华,贺雅静,高荧苒,等.LPS 介导的炎症反应过程及作用机制[J].河南大学学报(医学版),2017,36(1);70.
[6]Kaushansky K,Lin N,Adamson JW.Interleukin 1 Stimulates Fibroblasts to Synthesize Granulocyte-Macrophage and Granulocyte Colony-Stimulating Factors.Mechanism for the Hematopoietic Response to Inflammation[J].J Clin Invest,1988,81(1):92.
[7]Ma CY,Shi GY,Shi CS,et al.Monocytic Thrombomodulin Triggers Lps- and Gram-Negative Bacteria-Induced Inflammatory Response[J].J Immunol,2012,188(12):6328.
[8]黄 钢,姜 曼,白 云.LPS 调节 U937 细胞上 B7-H1 表达的初步研究[J].免疫学杂志,2006,22(5):480.
[9]Clayton A,Evans RA,Pettit E,et al.Cellular activation through the ligation of intercellular adhesion molecule-1[J].J Cell Sci,1998,111:443453.
[10]朱 珊,宋绍华,李学玉,等.口腔颌面部间隙感染的病原学分析及危险因素研究[J].中华医院感染学杂志,2017,27(13);3052.
[11]徐志鹏,左国平,靳建亮.巨噬细胞异质性及其在炎症调控中的研究进展[J].细胞与分子免疫学杂志,2015,31(12):1711.
[12]张 娜,张紫燕,赵凌霞,等.FoxO1转录因子在巨噬细胞中的表达与炎症的关系[J].系统医学,2016,1(9):1.
[13]Olas K.Immunomodulatory properties of human serum immunoglobulin A:anti-inflammatory and pro-inflammatory activities in human monocytes and peripheral blood mononuclear cells[J].Clin Exp Immunol,2005,140(3):478.

