近红外拉曼光谱分析用于胃肠道间质瘤诊断的研究
苏新喆,赵吉生,高永建,丁大勇
(吉林大学中日联谊医院 胃肠结直肠肛门外科,吉林 长春130033)
胃肠间质瘤(GIST),是起源于消化道的最常见的软组织肉瘤。病理诊断,尤其是免疫组织化学检测是确诊GIST的唯一手段。因为GIST质脆,活检过程中容易导致肿瘤出血和播散,因此GIST在术前诊断存在困难[1]。建立一种实时、无损、准确、客观的胃肠道间质瘤术前诊断方法具有极其重要的意义。近红外线激光拉曼光谱技术是一种以物质特定的分子振动光谱来识别不同的物质结构的无损检测技术。近年来,拉曼光谱技术成为研究生物物质分子结构的有效手段。本文采用近红外拉曼光谱检测、免疫组化等方法检测胃肠道间质瘤组织,对拉曼光谱检测在胃肠道间质瘤诊断的应用进行探讨。
1 材料与方法
1.1 材料
收集到中日联谊医院胃肠外科2011年-2015年胃肠道间质瘤术后肿瘤肿物及正常肠组织(距离病灶边缘2 cm以上)52份,其中胃间质瘤组织40份,小肠间质瘤组织10份,直肠间质瘤组织2份。组织样本离体后用生理盐水清洗3遍,每一份组织样品均分成两份,每份大小约0.5 cm3,一份放入10%福尔马林溶液固定,然后行常规石蜡包埋,制备成10 μm厚的连续切片,并行常规HE染色及免疫组织化学染色,病理证实;另一份放入冻存管中,放入液氮罐中保存。本研究纳入的患者未行术前靶向治疗,标本收集经患者及家属术前知情同意。
兔抗人CD117、DOG1单克隆抗体购自Life Science INC;辣根过氧化物酶偶联二抗购自Amersham Pharmacia。实验仪器激光共焦显微镜InVia+Plus型显微拉曼光谱仪(英国Renishaw 公司)。
1.2 方法
1.2.1免疫组织化学染色 标本置入10%福尔马林溶液中固定,石蜡包埋。石蜡标本10 μm厚连续切片,置56℃烤箱中干烤2小时,冷却后切片脱蜡,水化后用PBS冲洗。将组织切片放入装有0.01M枸橼酸钠缓冲液(pH6.0)的盒子中,微波炉中加热至沸腾,维持5分钟,自然冷却。每张切片加1滴过氧化酶阻断液,对内源性过氧化物酶进行灭活。灭活后用PBS冲洗。除去PBS液,每张切片加5%小牛血清,室温下孵育5分钟。除去血清,每张切片加1滴一抗(CD117抗体浓度1∶1 500,DOG1抗体浓度1∶1 000),4度冰箱内孵育过夜。PBS冲洗后切片加二抗(1∶1 000),室温孵育10分钟,PBS冲洗。除去PBS液,DAB显色。
1.2.2拉曼光谱分析 将装有组织样品的冻存管从液氮罐中取出,置于室温下解冻半小时,再用无菌镊将样品从冻存管中取出,表面处理平整后置于载玻片上,把载玻片连同组织样本放在样本台上。调节两个开关使自然光照到样品上;调节控制器移动样品台;调节焦点位置,使焦点聚集到组织样品上;调节允许激光通过,屏蔽白光,按预定设置的参数获取不同波数下的拉曼光谱,重复采集。光谱图输入计算机,再运用Origin8.5软件进行数据和图谱处理。
1.2.3统计方法 计数资料采用χ2检验,用SPSS20.0统计分析软件进行数据分析和统计学处理。绘图采用Origin8.5绘图软件。
2 结果
2.1 胃肠道间质瘤组织免疫组织化学染色结果分析
将PBS 作为阴性对照,CD117和DOG1蛋白阳性表达率分别为96.1%(50/52),94.2%(49/52)。DOG1、CD117 阳性染色主要定位在细胞膜和细胞质(图1)。CD117和DOG1蛋白表达与胃肠道间质瘤危险度分级无统计学差异(P>0.05)(见表1)。
2.2 拉曼光谱分析结果
2.2.1胃肠道间质瘤和正常对照组织的拉曼光谱比较 为明确胃肠道间质瘤和正常对照组织的拉曼光谱是否有明显差异,我们对44例胃肠道间质瘤组织标本和正常对照进行了拉曼光谱检测。结果显示胃肠道间质瘤组织在1 656 cm-1、1 452 cm-1处出现两个拉曼峰,而正常对照组织在1 452 cm-1不存在拉曼峰(图2)。说明拉曼位移1 452 cm-1是胃肠间质瘤组织的特征性拉曼峰。
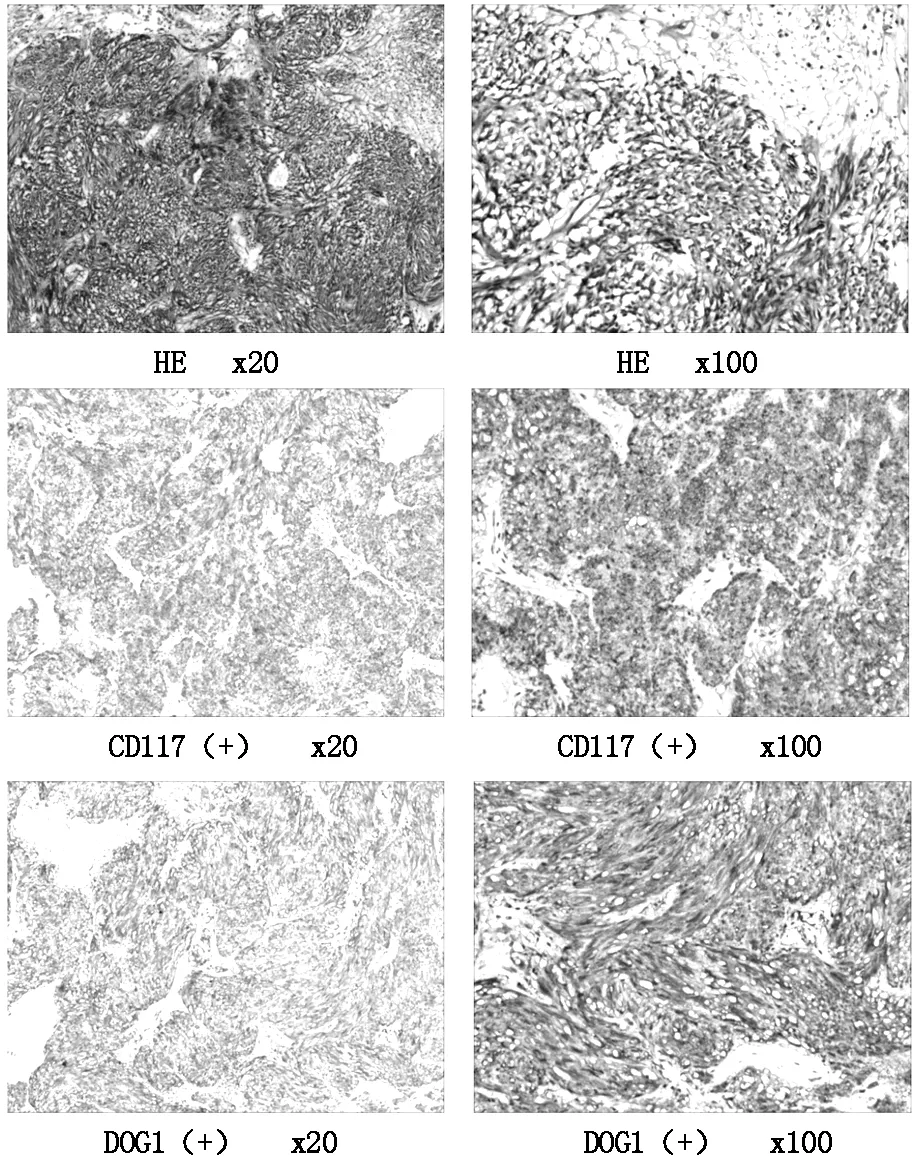
图1 胃肠道间质瘤组织的HE染色和免疫组织化学染色

CD117(+)DOG1(+)NIH分级低风险16/1615/16中风险5/55/5高风险29/3129/31
2.2.2分析组织拉曼光谱检测结果与危险度分级之间的关系 为明确胃肠道间质瘤组织的拉曼光谱是否与危险度分级有关,我们对胃肠道间质瘤低度恶性潜能组织标本和高度恶性潜能标本各15例进行了拉曼光谱检测。结果显示两组之间1 656 cm-1、1 452 cm-1处出现两个拉曼峰,两组在1 452 cm-1峰强之间有显著差异(图3、图4)。
3 讨论
人体细胞每一种生物大分子都有其对应的拉曼峰。蛋白质、DNA、脂类的部分原子团结构和键的位置对特定的振动频率敏感,生物分子的拉曼光谱中含有特定的的结构和成分信息[2]。肿瘤组织的生物大分子的结构和成分与正常组织相比发生了显著的变化,因此肿瘤组织的拉曼光谱有较高的特异性。同时,拉曼光谱在肿瘤血液标志物的检测及早期诊断方面也具有独特优势[3]。由于水的拉曼光谱非常弱,拉曼光谱可以在活体状态下来研究人体大分子的结构及其变化。已有研究表明在内镜下使用拉曼光谱对活体肿瘤进行早期原位检测具有较强的敏感性和特异性[4]。

图2 肠间质瘤和正常对照组织的拉曼光谱比较
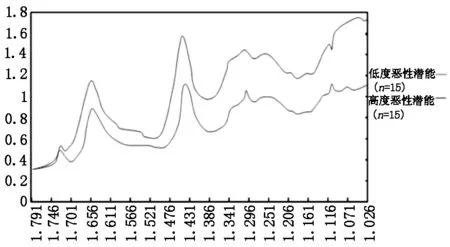
图3 胃肠间质瘤低度恶性潜能组织和高度恶性潜能组织的拉曼光谱比较

图4胃肠间质瘤低度恶性潜能组织和高度恶性潜能组织的拉曼光谱峰强比较
间质瘤组织和良性组织相比,具有细胞密度增高,细胞呈单一化。本研究结果显示胃肠间质瘤组织和正常对照组织的拉曼光谱存在明显差异,肿瘤组织特征性拉曼光谱位于1 452 cm-1波数处,这说明间质瘤组织与正常组织的明显差异。这样的结果需要进一步在活体中证实。
NCCN指南及中国胃肠道间质瘤专家共识中GIST根据部位、大小及核分裂像进行危险度分级,来评估其恶性潜能。但是该分级方式在术前难以做到,无法对手术方式的进行指导。因此建立一种无创的胃肠道间质瘤术前进行危险度分级的技术手段是非常必要的[1]。本文研究表明CD117和DOG1蛋白表达与胃肠道间质瘤危险度分级无统计学差异,而胃肠道间质瘤低度恶性潜能组织和高度恶性潜能组织的拉曼光谱在1 452 cm-1波数处峰强存在显著性差异。胃肠道间质瘤恶性潜能除了和大小及部位有关外,最主要与细胞核分裂像的多少有关。恶性潜能高的肿瘤细胞核核分裂像增多,有丝分裂活跃,而拉曼光谱的峰值与细胞的组成成分直接相关,所以恶性潜能不同的胃肠道间质瘤组织的拉曼光谱是存在异常的。
参考文献:
[1]Li J,Ye Y,Wang J,et al.Chinese consensus guidelines for diagnosis and management of gastrointestinal stromal tumor[J].Chin J Cancer Res,2017,29(4):281.
[2]Pappas D,Smith BW,Winefordner JD.Raman spectroscopy in bioanalysis[J].Talanta,2000,51(1):131.
[3]Shangyuan Fenga,Rong Chena,Juqiang Lina.Gastric cancer detection based on blood plasma surface-enhanced Raman spectroscopy excited by polarized laser light [J].Biosensors and Bioelectronics,2011 (26) 3167.
[4]Bergholt MS,Zheng W,Ho KY,et al.Fiber-optic Raman spectroscopy probes gastric carcinogenesis in vivo at endoscopy[J].J Biophotonics,2013,6(1):49.

