口腔鳞癌中IL-17和MMP-9的表达及意义
丁丽娜,于 烁,傅志华,武 照,李乾鹏,陈英新
(吉林大学口腔医院,吉林 长春130021)
口腔鳞状细胞癌(OSCC)是最常见的口腔癌类型,占口腔恶性肿瘤的90%以上。在肿瘤的发生与发展过程中,免疫细胞和炎性反应作为肿瘤微环境中的重要组成,起着关键的作用。Th17细胞以及其主要分泌的IL-17细胞因子不仅在炎症和免疫中发挥作用,在炎症相关的肿瘤疾病中也扮演着重要的角色。MMP-9是MMPs基质明胶酶类的一种,在肿瘤的发生发展中发挥重要作用。本研究通过免疫组化染色检测IL-17和MMP-9的表达,分析二者之间的相关性及临床意义,探讨二者在口腔鳞癌中的作用。
1 资料与方法
1.1 临床资料
31例鳞癌标本全部取自吉林大学口腔医院2017年手术切除并经石蜡包埋的组织;12例正常组织,其中6例来自于癌旁组织,6例来自智齿拔除患者。以上全部病例均经过我院病理科确诊。根据WHO病例分型,高分化鳞癌18例,中分化7例,低分化6例,共31例(男19例,女12例,年龄38-77岁,中位年龄60岁,≤60岁16例,>60岁15例;淋巴结转移22例,没有转移的9例,根据国际抗癌联盟肿瘤分期T1+T2 7例,T3+T4 24例);所有鳞癌患者术前均未接受过放化疗、激素等相关治疗。该研究已取得患者及家属的知情同意。
1.2 方法
IL-17多克隆抗体购买于Abcam公司,MMP-9单克隆抗体购买于北京中杉金桥生物有限公司,SP免疫组化试剂盒购买于福州迈新生物技术有限公司,按试剂盒说明操作。
1.3 结果判定
IL-17与MMP-9免疫组化阳性结果均为胞浆出现棕黄色或棕褐色颗粒。在400倍视野下,随机选8个染色效果较好的视野,双盲法判定结果,根据细胞着色程度及阳性细胞率进行评分:无显色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;着色细胞占计数细胞百分率 ≤25%为0分,25%-50%为1分,51%-75%为2分,>75%为3分。两项结果相加判定结果:0-2分(-)为阴性,3-4分(+),5-6分为(++),(+~++)为阳性。
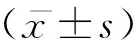
1.4 统计学分析
应用SPSS 21.0 统计软件进行数据分析,采用χ2检验进行分析,指标间相关性分析采用Pearson相关分析,以α=0.05为检验水准,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 IL-17、MMP-9的表达
IL-17在鳞癌组中肿瘤细胞的胞浆及周围间质细胞均可见阳性表达(如图1)。经比较发现,IL-17在鳞癌组的表达高于对照组,两者之间差异具有统计学意义(90.3%、58.3%;P<0.05);IL-17在高、中、低分化鳞癌中的表达率经统计学分析,差异具有统计学意义(100%、85.7%、66.7%;P<0.05);IL-17在鳞癌组中的表达与性别、年龄、TNM分期、淋巴结是否转移差异无统计学意义(P>0.05)。
MMP-9在鳞癌组织中主要以肿瘤细胞胞浆表达为主,部分间质内也可见,癌巢的边缘实质细胞多见,可呈散在分布(如图2)。经比较发现,MMP-9在鳞癌组的表达高于对照组,两者表达差异具有统计学意义(80.6%、16.7%;P<0.05);有无淋巴结转移组MMP-9表达率有显著性差异(90.9%、55.6%;P<0.05);MMP-9在鳞癌中的表达与年龄、性别及肿瘤分化程度及TNM分期差异均无显著性差异(P>0.05)。见表1、表2。
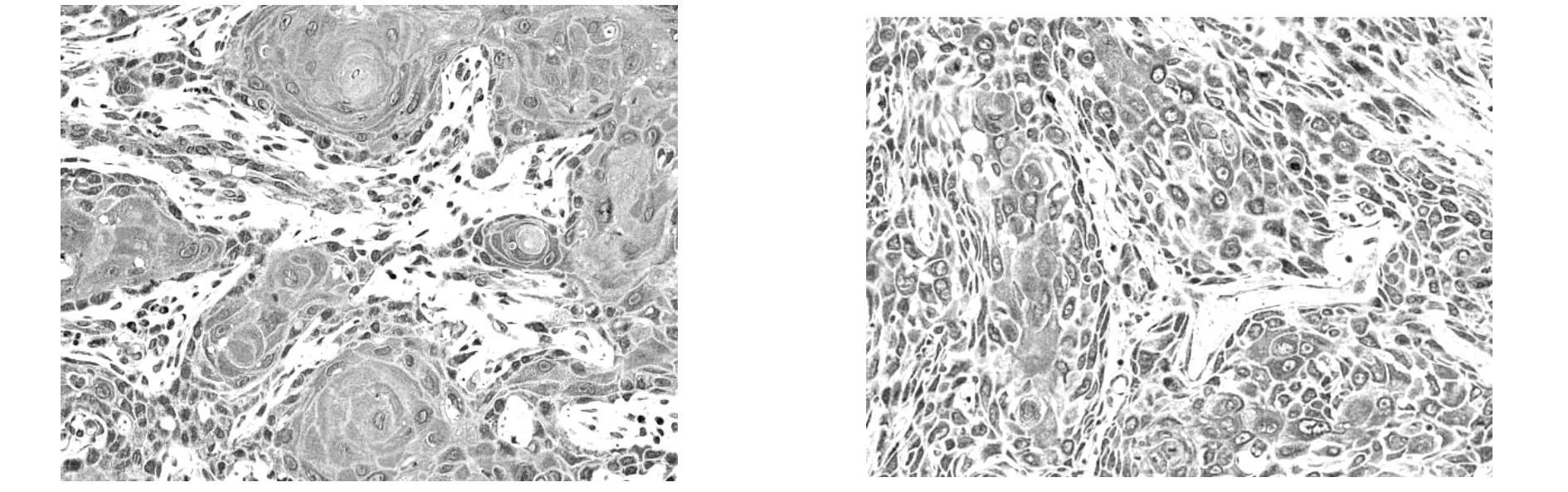
图1IL-17在口腔鳞癌的表达(×200)图2MMP-9在口腔鳞癌的表达(×200)
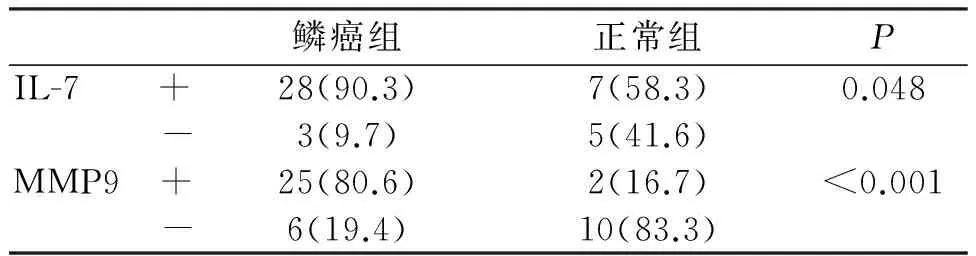
表1 IL-17、MMP-9在口腔鳞癌和正常组织中的表达 例(%)
2.2 IL-17、MMP-9相关性分析
IL-17、MMP-9 阳性表达的强度以平均光密度值的大小来表示,在口腔鳞癌中,IL-17、MMP-9二者的MD值分别是(0.327±0.080;0.245±0.065)。口腔鳞癌组IL-17与MMP-9的表达呈正相关(r=0.373,P<0.05)。
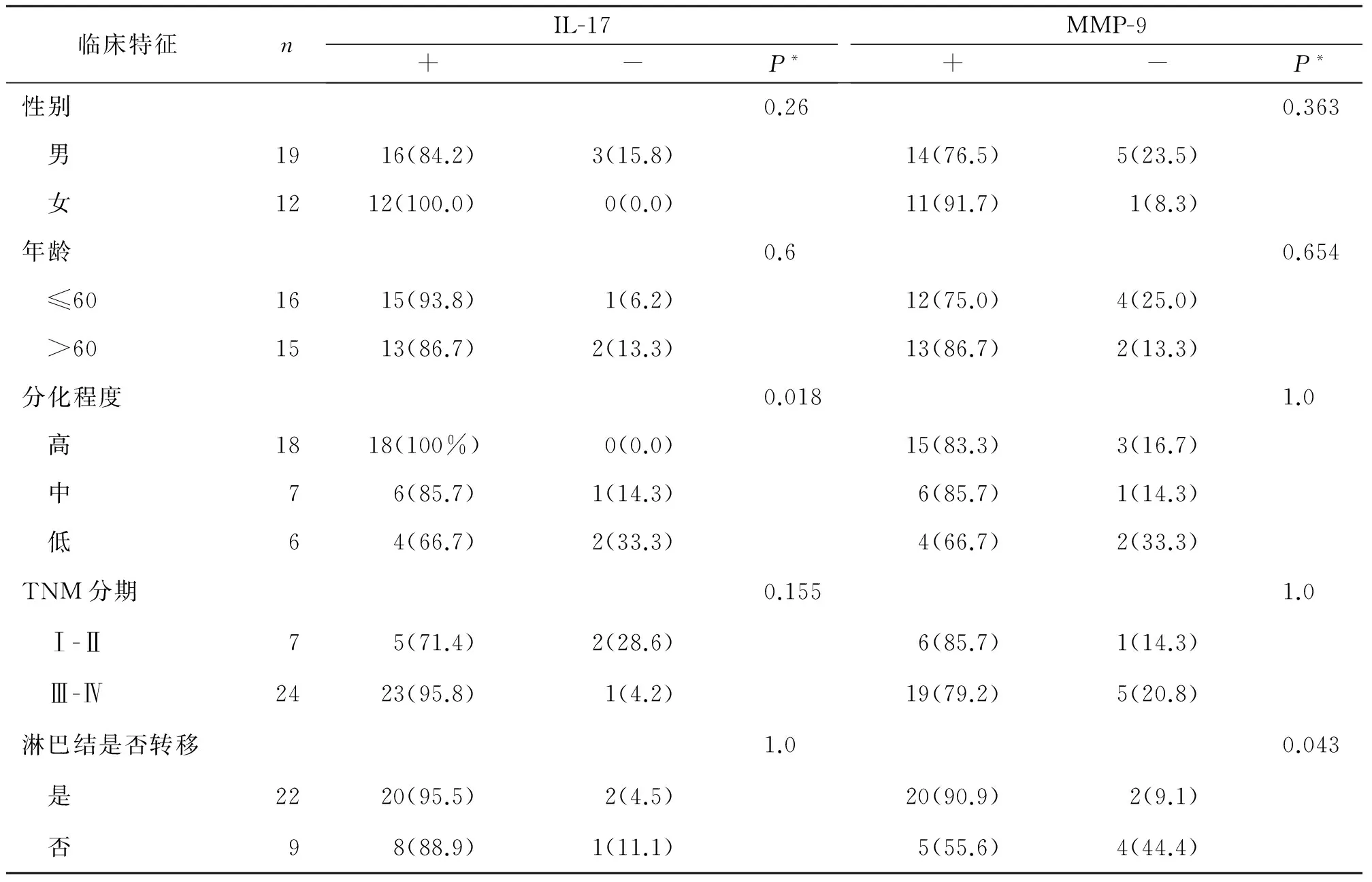
表2 口腔鳞癌中IL-17、MMP-9的表达与各临床特征的关系 例(%)
注:P值采用Fisher精确检验。
3 讨论
口腔鳞状细胞癌的发病机制是复杂的,据研究显示,肿瘤微环境(TME)中的炎症反应可能在口腔鳞癌的发生发展中起作用[1]。细胞因子、趋化因子、前列腺素、活性氧和氮物质作为TME中炎症环境的一部分,已被证明有助于癌症的起始,促进其侵袭和转移[1,2]。许多流行病学和分子生物学研究也表示,炎症极大地增加了癌症的风险。慢性炎症可诱导持续的组织损伤,并改变组织微环境中存在的炎症细胞和细胞因子。已知IL-17在包括肿瘤相关炎症的炎症中起关键作用[3,4]。图2为鳞癌患者HE染色图片,发现在癌细胞周围有大量炎性细胞的浸润,说明口腔鳞癌的发生与炎症有着密切的关系。IL-17在乳腺癌,卵巢癌,胃癌和肝癌中与对照组织相比均检测到IL-17阳性细胞的增加[5-8]。在本研究中,IL-17在鳞癌组的表达率与对照组存在差异,并且具有统计学意义(90.3%、58.3%;P<0.05),初步推断,IL-17在口腔鳞癌中也扮演着重要角色。IL-17在鳞癌中的表达与分化程度的相关提示IL-17在口腔癌的发展中起到一定作用。
在炎症及肿瘤的发生过程中,炎症介质被大量释放,造成细胞外基质的溶解及基膜的破坏,进一步导致炎性细胞的浸润以及肿瘤的转移。而溶解细胞外基质的酶与基质金属蛋白酶(MMPs)有关[9,10]。MMP-9是MMPs基质明胶酶类的一种。普遍认为MMP-9可以降解几乎所有的细胞外基质成分。MMP-9在多种肿瘤中如胃癌等都有不同程度的表达[11,12]。有学者[13,14]发现,MMP-9在口腔鳞癌组织中表达,并且表达与血管密度相关,从而推断MMP-9 可促进口腔鳞癌血管生成,在肿瘤的侵袭与转移中发挥作用。本研究显示,MMP-9在口腔鳞癌组织中的表达与对照组相比差异具有统计学意义(80.6%、16.7%;P<0.05),同其他研究相一致[15,16];无淋巴结转移患者的阳性表达率要明显低于有淋巴结转移的患者,差异具有统计学意义(90.9%、55.6%;P< 0.05),从而推测MMP-9的表达可能与肿瘤转移能力相关,肿瘤中的MMP-9的表达不利于患者寿命的延长。但在本研究中有一部分鳞癌组织表达较弱,推断并不是所有的肿瘤细胞都具有转移潜能。
目前研究认为IL-17与炎性反应及免疫相关疾病有密切关系[17]。此外,炎症中IL-17的活性可能与基质金属蛋白酶(MMPs)的组织破坏有关[18]。已经发现IL-17通过MMP-9促进肿瘤的扩散或诱导血管生成[19]。本实验应用统计学分析,IL-17与MMP-9两者具有相关性(r=0.373,P<0.05)。由此得出,IL-17与MMP-9在口腔鳞癌的发生发展过程中起重要作用。有学者指出,IL-17诱导IL-6产生,IL-6反过来激活致癌信号转导和转录激活因子(Stat)3,从而进一步促进促生长因子和促血管生成基因的表达。Th17反应可以部分通过IL-6-Stat3途径促进肿瘤生长[20]。可以肯定的是在口腔鳞癌中IL-17与MMP-9在鳞癌的发生发展中起到重要作用。那么在口腔鳞癌中,IL-17与MMP-9之间的作用是如何发挥的?是否具有相同的信号转导?还需要进一步探索。
参考文献:
[1]Feller L,Altini M,Lemmer J.Inflammation in the context of oral cancer[J].Oral Oncol,2013,49(9):887.
[2]Grivennikov SI,Greten FR,Karin M.Immunity,inflammation,and cancer[J].Cell,2010,140(6):883.
[3]Maione F,Paschalidis N,Mascolo N,et al.Interleukin 17 sustains rather than inducesinflammation[J].Biochem Pharmacol,2009,77(5):878.
[4]Jin W,Dong C.IL-17 cytokines in immunity and inflammation[J].Emerg Microbes Infect,2013,2:e60.
[5]Chen WC,Lai YH,Chen HY,et al.Interleukin-17-producing cell infiltration in the breast cancer tumour microenvironment is a poor prognostic factor[J].Histopathology,2013,63(2):225.
[6]Miyahara Y,Odunsi K,Chen W,et al.Generation and regulation of human CD4+ IL17-producing T cells in ovarian cancer[J].Proc Natl Acad Sci USA,2008,105(40):15505.
[7]Chen JG,Xia JC,Liang XT,et al.Intratumoral expression of IL-17 and its prognostic role in gastric adenocarcinoma patients[J].Int J Biol Sci,2011,7(1):53.
[8]Zhang JP,Yan J,Xu J,et al.Increased intratumoral IL-17-producing cells correlate with poor survival in hepatocellular carcinoma patients[J].J Hepatol,2009,50(5):980.
[9]Evrosimovska B, Dimova C, Kovacevska I, et al. Concentration of collagenases ( MMP-1,-8,-13 ) in patients with chronically inflamed dental pulp tissue[J].Prilozi,2012,33(2):191.
[10]Chien MH, Lin CW, Cheng CW,et al.Matrix metalloproteinase-2 as a target for head and neck cancer therapy[J].Expert Opin Ther Targets,2013,17(2):203.
[11]崔若凡,张宝刚,姬 静,等.ARK5、MMP-2 和 MMP-9 在胃癌中的表达及与侵袭转移的关系[J].实用医学杂志,2012,28(7):1074.
[12]Gilles C,Polette M,Piette J,et al.High level of MT-MMP expression is associated with invasiveness of cervical cancer cells[J].Int J Cancer,1996,65(2):209.
[13]Andishehtadbir A,Mardani M,Pourshahidi S,et al.Prognostic value of matrix metalloproteinase-9 expression inoral squamous cell carcinoma and its association with angiogenesis[J].J Clin Exp Dent,2016,8(2):130.
[14]Fink K,Boratyński J.The role of metalloproteinases in modification of extracellular matrix in invasive tumor growth,metastasis and angiogenesis[J].Postepy Hig Med Dosw(Online),2012,66(151):609.
[15]刘 健,浦剑虹,惠建华.MMP-9在口腔鳞癌组织中的表达及其意义[J].苏州大学学报,2004,24(1):66.
[16]薛昌敖,张建华,刘炜.口腔颌面部鳞癌SNCG、MMP-9的表达及其临床意义[J].口腔生物学,2014(2):78.
[17]Chen Z,Laurence A,Kanno Y,et al.Selective regulatory function of Socs3 in the formation of IL-17-secreting T cells [J].Proc Natl Acad Sci U S A,2006,103(21):8137.
[18]Murugaiyan G,Saha B.Protumor vs antitumor functions of IL-17[J].J Immunol,2009,183(7):4169.
[19]Miossec P,Kolls JK.Targeting IL-17 and TH17 cells in chronic inflammation[J].Nat Rev DruDiscovery,2012,11(10):763.
[20]Lin Wang,Tangsheng Yi,Marcin Kortylewski,et al.IL-17 can promote tumor growth through an IL-6-Stat3 signaling pathway[J].J E M,2009,206(7):1457.

