预防性切除双附件降低高级别浆液性卵巢癌风险的临床研究
黄礼燕,黄安亮,刘金星,杨 帆
(四川大学华西第二医院 病理科·出生缺陷与相关妇儿疾病教育部重点实验室,四川 成都610041)
高级别浆液性卵巢癌是卵巢上皮性恶性肿瘤中最常见的组织学类型,约占70%,大多数患者发现时已是晚期阶段。高达20%的高级别浆液性卵巢癌患者携带基因BRCA1或2的突变,突变患者常常表现为明显的乳腺-卵巢肿瘤家族史[1]。BRCA1或2基因是肿瘤抑制基因,在染色体损伤的修复中有重要作用,BRCA1或2基因突变增加了乳腺-卵巢癌的风险,因此,预防性输卵管-卵巢切除可以降低这些携带者发生卵巢癌的风险。现回顾性总结6例预防性切除输卵管-卵巢妇女的临床病理资料,进一步分析并复习相关文献,探讨BRCA突变携带者预防性输卵管-卵巢切除对降低高级别浆液性卵巢癌的临床意义。
1 材料与方法
回顾性分析2015-2017年四川大学妇女儿童医院收集的6例BRCA基因突变携带者行预防性输卵管-卵巢切除的临床资料,送检输卵管卵巢组织全部取材,组织块用10%中性甲醛固定,石蜡包埋、切片,HE染色。免疫组化采用Envision法。所有抗体及试剂盒均购自北京中杉金桥生物技术有限公司。
2 结果
2.1临床资料患者年龄30-65岁,平均年龄47岁。6例患者均有遗传性卵巢肿瘤家族病史,基因检测发现有BRCA基因突变,其中BRCA1基因突变者5例,BRCA2突变者1例。6例患者均已生育,其中3例已绝经。因卵巢肿瘤家族史,主动要求行预防性输卵管-卵巢切除术。实验室检查均为阴性,影像学B超检查发现其中1例患者有子宫肌瘤,余5例患者子宫及双附件未见异常。5例患者行预防性全子宫及双附件切除术,1例患者行预防性卵巢-输卵管切除术。
2.2病理检查(1)大体观察:6例双侧卵巢表面光滑,3例卵巢正常大小,切面灰白,可见0.1-0.2 cm的小囊腔;余3例卵巢萎缩体积缩小,切面灰白,实性质中。6例双侧输卵管浆膜均光滑,伞端开放,未见异常。(2)镜下观察:3例正常大小卵巢镜下可见卵巢白体及囊性滤泡,3例萎缩卵巢见卵巢白体。1例输卵管查见高级别浆液性腺癌(图1),位于输卵管伞端,大小约0.2 cm×0.2 cm×0.1 cm,癌旁查见输卵管黏膜上皮内癌,STIC(图2)。2例输卵管黏膜灶性增生(位于输卵管伞端,细胞排列成单层或假复层,细胞无异型性)。1例输卵管黏膜生理性萎缩,余2例输卵管黏膜未见异常。(3)免疫组化结果:输卵管高级别浆液性腺癌雌激素受体(ER)+、孕激素受体(PR)+、P53+、WT-1(图3)+、Ki67阳性指数约10%;2例输卵管黏膜局灶增生者ER+、灶性PR-、灶性P53+(图4)、Ki67阳性指数1%-5%(P53印记);1例输卵管黏膜ER+、PR+,P53-,ki67灶区阳性指数约20%;余两例输卵管ER+、PR+,P53-,ki67阳性指数<1%。患者临床病理特征详见表1。
2.3随访术后随访7个月至2年,输卵管高级别浆液性腺癌患者术后接受2次化疗,未发现复发,余病例未发现肿瘤。
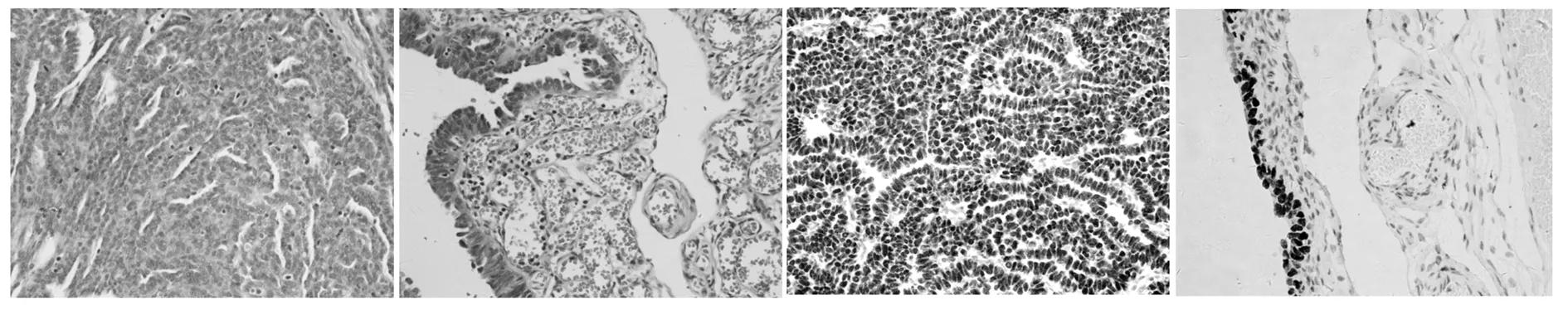
图1输卵管高级别浆液性腺癌HEx100图2STICHEx100图3WT-1弥漫阳性图4P53印记

表1 BRCA基因突变患者临床病理特征
3 讨论
BRCA基因突变携带者一般无临床症状,常因明显的乳腺-肿瘤家族病史于医院预防性检查,经BRCA基因测序而发现。BRCA1基因突变携带者一生中约有40%-60%的风险发展成高级别浆液性卵巢癌,而BRCA2只有11%-27%的风险[2]。因此,这些携带者常主动要求行降低风险的输卵管-卵巢切除术。美国肿瘤治疗(NCCN)指南建议BRCA携带者40岁以前行降低风险的预防性手术切除,但是很多患者担心术后对健康及生活质量的影响不愿行手术或者推迟手术时间。在该研究中,患者年龄30-65岁(平均年龄47岁),只有1例年龄在40岁以下,余5例高于NCCN指南建议的年龄。且患者都是生育以后无生育要求才行预防性手术,这也是影响患者年龄较指南偏高的因素。Powell[3]整合了BRCA突变病人接受预防性输卵管-卵巢手术的所有数据,发现不管是STIC或者隐匿性癌,其患者发生的中位年龄是50岁。我们研究中只发现1例隐匿癌合并STIC,年龄45岁,小于中位年龄,因此对于BRCA基因携带者在生育完成后40岁以前行预防性输卵管-卵巢切除术是必要的。
卵巢-盆腔浆液性腺癌的起源有多种学说,近来通过对降低风险的双侧输卵管-卵巢切除的输卵管彻底的检查,开始认识到输卵管是高级别浆液性卵巢癌的起源[4]。这个发现提示高风险妇女(BRCA携带者)发生的隐匿性肿瘤大多数在输卵管而不是在卵巢。而且,越来越多的证据表明,盆腔高级别浆液性腺癌来源于输卵管末端的黏膜内癌STIC[5]。我们通过对BRCA携带者预防性切除的输卵管-卵巢标本全部取材制片,发现1例输卵管末端黏膜的浆液性癌合并STIC,在双侧卵巢未发现病变,也验证了大多数高级别浆液性腺癌来源于输卵管末端而并非卵巢表面上皮。Powell等人[6]复习了9项关于BRCA基因突变携带者手术的研究报道,总结出隐匿癌的检出率在2.2%-17%,我们的研究中发现浆液性癌1例(16.7%),这与Powell等人提出的检出率相似。并且,我们还发现隐匿癌更易发生在BRCA1突变携带患者,这不排除与我们病例少且大多数是BRCA1突变者的因素相关,这有待更多的研究去证实。
分子水平,高级别浆液性卵巢癌以P53突变及BRCA基因功能障碍为特征,STIC也显示存在P53的突变[7]。我们的病例中HE染色切片可以直接观察到STIC与浆液性腺癌的过渡,通过免疫组化染色显示STIC与浆液性癌P53的一致强阳性,说明这两者是同种疾病发展的两个阶段。在疾病发展至STIC前,也存在P53过表达,即癌前病变“P53印记”,其定义为6个以上连续输卵管上皮细胞核染色强阳性[8]。P53印记形态上呈良性外观或仅有轻度非典型性的输卵管分泌上皮,但分子水平上已发生了改变,其特征是P53阳性,ki67阳性指数低[9]。我们的研究中2例表现为输卵管伞端黏膜的局灶增生,细胞排列成假复层,细胞无异型性,通过免疫组化检测出“P53印记”:输卵管黏膜灶性P53阳性,Ki67指数<3%。P53印记作为可能具有潜在危险的癌前病变[10],在我们研究中高发率(33.3%),提示BRCA基因突变携带者预防性切除输卵管-卵巢可以阻断癌前病变(P53印记)向STIC及浆液性癌的进展。Ki67作为增殖标记其过表达往往预示细胞增殖能力活跃,在我们的病例中,除了浆液性癌及STIC存在P53、Ki67高表达外,还有1例输卵管黏膜形态学正常,免疫组化染色显示灶性Ki67阳性指数约20%。这是否做为另一种癌前病变,有待基因检测进一步确定。
输卵管高级别浆液性腺癌患者术后接受化疗,尤其是位于输卵管伞端的癌灶,以防止脱落的癌细胞播散至腹腔扩散,并定期监测随访复查。对STIC患者术后的监测文献中提到很多,差异很大。Powell[3]回顾文献中提到的62例STIC发现仅有3例复发(复发率4.84%),复发的3例女性均是BRCA1基因突变者。这3例患者诊断STIC之后仍然无病生存79.33个月,也说明STIC预后良好。这与现有的建议对细胞学阴性的STIC进行手术分期没必要是一致的,并且对STIC患者预防性化疗不被人信服[11]。他们也发现51例STIC患者腹腔灌洗液7例阳性(14%),这高发率建议对于预防性输卵管-卵巢手术切除的诊断STIC的高风险病人应该把腹腔灌洗液检查作为例行检查。存在浆液性癌前病变(P53印记)的患者,手术切除即可,我们的病例随访7月-15月无肿瘤发生,预后很好。但Patrono[12]最近公布的数据中显示BRCA突变者原发腹膜癌的发生率4.5%,因此,高风险的患者也需要继续进行监测。
我们通过BRCA基因突变携带者预防性手术切除的标本的研究发现,切除双输卵管远端存在隐匿性浆液性腺癌、STIC、癌前病变“P53印记”,提示BRCA突变携带者预防性切除双侧输卵管-卵巢可以降低高级别浆液性卵巢癌的发生。由于BRCA基因检测国内未普及,大部分BRCA携带者在未患病情况下不愿行预防性手术,以及对输卵管标本取材未执行输卵管伞端分段及广泛检查(SEE /FIM)原则,我们获得的病例数有限。关于预防切除输卵管-卵巢术后患者的治疗及检测还需要等待进一步研究。
参考文献:
[1]Hennessy BT,Timms KM,Carey MS,et al.Somatic mutations in BRCA1 and BRCA2 could expand the number of patients that beneft from poly (ADP ribose) polymerase inhibitors in ovarian cancer[J].J Clin Oncol ,2010,28(22):3570.
[2]Young-Jae Lee,Shin-Wha Lee,Kyu-Rae Kim,et al.Pathologic findings at risk-reducing salpingo-oophorectomy (RRSO) in germline?BRCA?mutation carriers with breast cancer:significance of bilateral RRSO at the optimal age in germline?BRCA?mutation carriers[J].J Gynecol Oncol,2017,28(1):e3.
[3]Powell CB.Risk reducing salpingo-oophorectomy for BRCA mutation carriers:20 years later[J].Gynecol Oncol,2014,132(2):261.
[4]Erickson BK,Conner MG,Landen CN,Jr.The role of the fallopian tube in the origin of ovarian cancer[J].Am J Obstet Gynecol,2013,209(5):409.
[5]Kindelberger DW,Lee Y,Miron A,et al.Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma:evidence for a causal relationship[J].Am J Surg Pathol,2007,31(2):161.
[6]Powell CB,Chen LM,McLennan J,et al.Risk-reducing salpingo-oophorectomy (RRSO) in BRCA mutation carriers:experience with a consecutive series of 111 patients using a standardized surgical-pathological protocol[J].Int J Gynecol Cancer,2011,21(5):846.
[7]Poon C,Hyde S,Grant P,et al.Incidence and characteristics of unsuspected neoplasia discovered in high-risk women undergoing risk reductive bilateral salpingooophorectomy[J].Int J Gynecol Cancer,2016,26(8):1415.
[8]Cass I,Walts AE,Barbuto D,et al.A cautious view of putative precursors of serous carcinomas in the fallopian tubes of BRCA mutation carriers[J].Gynecol Oncol,2014,134(3):492.
[9]Leonhardt K,Einenkel J,Sohr S,et al.P53 signature and serous tubal in-situ carcinoma in cases of primary tubal and peritoneal carcinomas and serous borderline tumors of the ovary[J].Int J Gynecol Pathol,2011,30(5):417.
[10]Chen EY,Mehra K,Mehrad M.Secretory cell outgrowth,PAX2 and serous carcinogenesis in the Fallopian tube[J].J Pathol,2010,222(1):110.
[11]Conner JR,Meserve E,Pizer E,et al.Outcome of unexpected adnexal neoplasia discovered during risk reduction salpingo-oophorectomy in women with germ-line BRCA1 or BRCA2 mutations[J].Gynecol Oncol,2014,132(2):280.
[12]Patrono MG,Iniesta MD,Malpica A,et al.Clinical outcomes in patients with isolated serous tubal intraepithelial carcinoma (STIC):a comprehensive review[J].Gynecol Oncol,2015,139(3):568.

