两种木质素对纤维素酶水解的影响机制
吴 凯,应文俊,郑志锋,史正军,杨海艳,杨 静*
(1.西南林业大学 化学工程学院,云南 昆明 650224;2.云南省生物质高效利用工程实验室,西南林业大学, 云南 昆明 650224)
受全球能源紧缺和环境恶化所带来的严峻挑战,以生物质为原料开发新能源和新型化学品的研究越来越受到国内外研究者的关注。木质纤维是世界上最丰富的一种可再生生物质原料,利用其中的纤维素生产和制备乙醇成为了近年来的研究热点[1]。大量的研究发现,纤维素酶解过程中,木质素是主要抑制剂,一方面,木质纤维原料中的木质素和半纤维素、木质素和纤维素之间复杂的结构构成了纤维素的“天然抗降解屏障”[2-4];另一方面,木质素对纤维素酶的非生产性吸附将减少纤维素对纤维素酶的有效吸附[5-7]。尽管通过预处理手段可以除去大量木质素,但并不能从根本上解决木质素对纤维素酶水解的抑制。为了解决这个难题,研究人员试图通过探讨木质素在纤维素酶水解中的影响机制找到解决办法。如Li等[8]在碱木质素对酶蛋白的吸附中发现随着相对分子质量的递增,碱木质素对纤维素酶蛋白的亲和力和分配系数减小,从而推测木质素分子中可能存在一些功能基团可导致其疏/亲水性、电负性等性能改变,最终影响纤维素酶解效率。本研究以云南苦竹为原料,经有机溶剂和球磨预处理制备乙醇木质素(EOL-B)和磨木木质素(MWL-B),采用FT-IR和13C NMR分析木质素结构,并探究其对纤维素酶解效率、纤维素吸附酶蛋白的影响作用及机制,以期为纤维素酶水解的研究提供理论依据。
1 实 验
1.1原料、试剂与仪器
苦竹,采自云南省普洱市,粉碎,取0.3~0.45 mm粉末。微晶纤维素(Avicel PH-101),购自Sigma公司。纤维素酶(UTA-8),购于湖南尤特尔生化有限公司,滤纸酶活100 FPIU/mL,β-葡萄糖苷酶活72 IU/mL;纤维素酶(C2730)来源于里氏木霉(ATCC 26921),购自Sigma公司,滤纸酶活128 FPIU/mL,β-葡糖苷酶酶活27 IU/mL。乙醇、甲苯、98 %硫酸、二氧六环,均为分析纯。水热反应器,郑州博科仪器设备有限公司;球磨机,德国FRITSCH公司;冷冻干燥机,德祥科技有限公司;Agilent 1200 series高效液相色谱仪(HPLC),美国Agilent公司;红外吸收光谱仪(Madison, WI),美国Thermo Nicolet公司。
1.2木质素制备
1.2.1乙醇木质素 参照文献[9]将20 g苦竹与140 mL 75 %乙醇混合,固液比1∶7(g∶mL),加入 98 %硫酸0.102 g。将混合液装入1 L的水热反应器中,在170 ℃下反应1 h。反应结束后,迅速冷却反应器,取出反应后的混合物,过滤,滤液中加入3倍的水,将醇溶木质素沉淀,过滤,即得到乙醇木质素(EOL-B)。
1.2.2磨木木质素 参照文献[10~11],将 30 g 苦竹用甲苯-乙醇抽提6 h, 甲苯200 mL,乙醇100 mL,抽提后的苦竹风干并取 20 g 球磨 8 h,球磨后的样品15 g 用300 mL 96 %二氧六环常温避光抽提48 h,固液比为1∶20(g∶mL),过滤,调节pH值 5.5,将滤液减压浓缩至 30 mL,将浓缩后的滤液逐滴加入到 90 mL 的 95 %乙醇溶液中沉淀,离心分离半纤维素。将离心后的滤液减压浓缩5 mL,加入 50 mL 酸(pH值 2.0),离心,冷冻干燥,即得磨木木质素(MWL-B)。
1.3纤维素酶水解
取微晶纤维素0.4 g,分别加入0、 40、 80、 160 mg 的EOL-B和MWL-B,加入18.6 mL水、1 mL柠檬酸缓冲液和0.4 mL纤维素酶液,酶用量为10 FPIU/g(以葡聚糖计,下同),总体系20 mL。充分搅拌均匀后,置于(50±1) ℃、 150 r/min的摇床中反应。分别于2、 4、 8、 12、 24、 48和72 h取样,于3 000 r/min下离心10 min,取1 mL清液适当稀释后用高效液相色谱测定反应液中葡萄糖和纤维二糖的浓度变化,并计算纤维素酶水解得率[12-13]。纤维素水解葡萄糖得率按式(1)计算:
Y=(c×0.02×0.9)/(m×W)×100 %
(1)
式中:Y—纤维素水解葡萄糖得率,%;0.02—水解糖液体积,L;c—水解液中葡萄糖和纤维二糖质量浓度,g/L;0.9—纤维素和葡萄糖、纤维二糖的转换系数;m—原料质量,g;W—原料中纤维素质量分数,%。
1.4纤维素酶吸附
分别称取EOL-B和MWL-B各0.1 g于50 mL三角瓶中,加入一定量的水、0.25 mL柠檬酸缓冲液和纤维素酶液(0.02~0.1 g/L),使底物质量分数为2 %。充分搅拌均匀后,置于(4±1) ℃、150 r/min的摇床中反应3 h。通过测定上清液中蛋白质含量(Bradford法)来评价不同时间纤维素酶蛋白的吸附情况[14]。蛋白质标准方程:y=1.094 8x-0.562 8,R2=0.994(x为吸光值,y为上层液酶量)。用Langmuir等温吸附方程拟合不同底物对纤维素酶的吸附性能[13],其中,Γmax和K值可由Langmuir线性方程拟合得出,分配系数R=Γmax×K。方程如式(2)所示:
Γ=KCΓmax/(1+KC)
(2)
式中:C—上清液中的游离酶质量浓度,g/L;Γ—底物上结合酶的浓度,mg/g;Γmax—纤维素酶在底物上的饱和吸附量,mg/g;K—Langmuir常数,表示纤维素酶的亲和力。
1.5分析表征
1.5.1化学组分分析 样品的纤维素、半纤维素和木质素的组成按美国可再生能源实验室公布的方法测定[15]。采用HPLC测定酶水解液中的糖组分,酶水解后的上清液经0.45 μm 滤膜过滤后,用Bio-Rad Aminex HPX-87H(300 mm×7.8 mm)色谱柱,以0.005 mol/L 的硫酸作为流动相,流速为0.6 mL/min,在色谱柱温为55 ℃,示差折光检测器(RI)上进行检测。
1.5.2红外光谱分析 样品采用红外吸收光谱仪进行分析,波数范围400~4000 cm-1,扫描32次和分辨率2 cm-1透射模式下采集数据。
1.5.3核磁共振分析 样品采用布鲁克400 M超导核磁共振仪进行测定。以氘代DMSO为溶剂,在FTr模式100.6 MHz下进行信号采集,选取DMSO的(39.5)进行校标。采样条件为:采用30度脉冲序列,采样时间1.36 s,弛豫时间1.89 s,累积30 000次。
2 结果与分析
2.1成分分析
从苦竹中提取的乙醇木质素(EOL-B)和磨木木质素(MWL-B)的主要化学成分如表1所示。
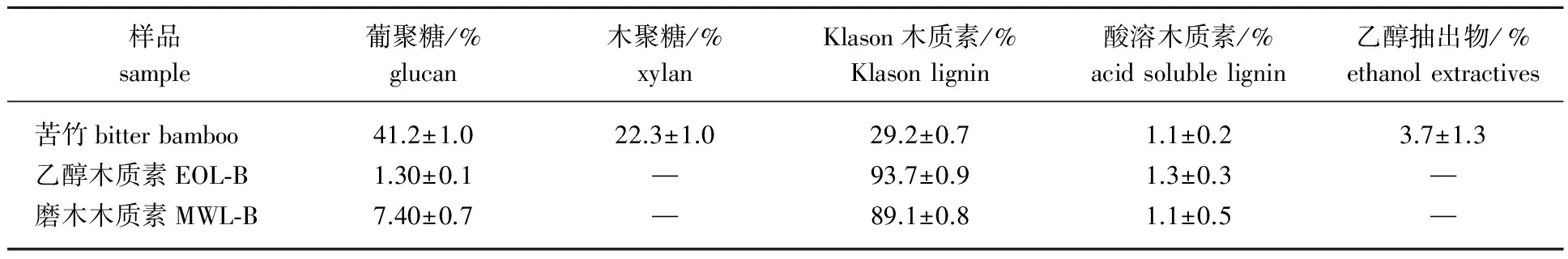
表1 苦竹、乙醇木质素和磨木木质素成分Table 1 Constituent of bitter bamboo, EOL-B and MWL-B
从表1可得出,苦竹含葡聚糖41.2 %,木聚糖22.3 %,木质素30.3 %;经乙醇和球磨处理后得到的EOL-B和MWL-B中木质素质量分数分别为95 %和90.2 %,葡聚糖质量分数均小于8 %,无木聚糖和乙醇抽出物,两者都具有较高的纯度,可作为木质素的模型物用于木质素结构对纤维素酶吸附和酶水解的研究。MWL-B是采用深度球磨和溶剂萃取(二氧六环)分离出的木质素,这种木质素在结构上与原本木质素相近,被广泛充当原本木质素的模型物来研究木质素的结构。
2.2纤维素酶水解
以磨木木质素(MWL-B)和乙醇木质素(EOL-B)作为模型物,研究木质素对纤维素酶水解的影响。以微晶纤维素和添加了0、 40、 80、 160 mg的EOL-B或MWL-B的微晶纤维素为底物,在纤维素酶用量10 FPIU/g、pH值4.8和50 ℃条件下水解,葡萄糖得率随时间的变化见图1。由图1可知,随着MWL-B的用量增加,72 h葡萄糖得率从 51.34 %降低至 46.06 %,葡萄糖得率降低了10 %。Sun等[15]研究发现紫丁香基单元和愈创木基单元能对纤维素酶水解产生联合抑制效应,这主要是由于缩合的芳环增加了木质素分子的疏水性,而紫丁香基和愈创木基提高了木质素的氢键结合力,因此对木质纤维素的酶水解过程产生了协同抑制作用。然而,从图1还可看出,随着EOL-B的用量增加,葡萄糖72 h得率分别为56.06 %、60.61 %和61.06 %;与对照的葡萄糖得率51.34 %相比,加入8 g/L EOL-B后,72 h葡萄糖得率增加了19 %。Zhou等[16]认为磺酸盐木质素可能作为一种表面活性剂来提高纤维素的酶水解效率。MWL-B经过球磨、二氧六环抽提制得,而EOL-B为经乙醇萃取,溶解于乙醇溶液中的木质素。不同的预处理方式得到的木质素,化学结构及其表面化学性质也不同,这些变化会影响到纤维素的酶解效率。
2.3木质素对纤维素酶吸附的影响
以微晶纤维素、MWL-B和EOL-B为底物,酶用量10 FPIU/g,在pH值4.8、4 ℃、 150 r/min条件下反应3 h,Langmuir吸附等温线及其参数如图2和表2所示。
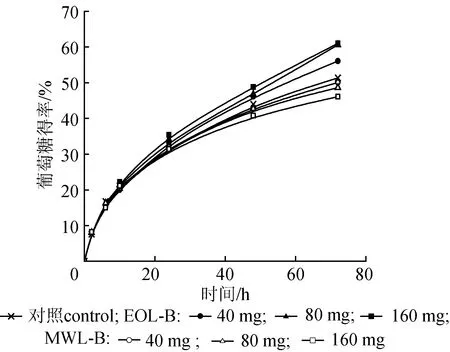
图1 木质素添加量对纤维素酶解的影响Fig.1 Effects of adding isolated lignins on enzymatic hydrolysis of cellulose
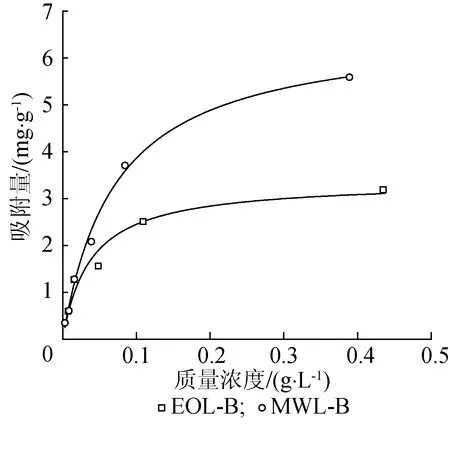
图2 不同木质素与纤维素酶蛋白的等温吸附曲线Fig.2 Isothermal adsorption curves of different lignin and cellulase proteins
从图2可以看出,MWL-B对纤维素酶等温吸附曲线上的斜率大于EOL-B,意味着MWL-B与纤维素酶间的亲和力大于EOL-B与纤维素酶间的亲和力。MWL-B对纤维素酶最大吸附量为EOL-B的1.96倍,表明MWL-B上有更多的纤维素酶吸附位点。

表2 纤维素酶蛋白在不同底物上的Langmuir吸附等温曲线参数Table 2 Langmuir adsorption isotherm parameters of cellulase proteins on different substrates
从表2可知,Langmuir常数K表示纤维素酶与底物之间的相对亲和力,意味着在纤维素的酶水解过程中,不仅纤维素与纤维素酶之间有亲和力,木质素与纤维素酶之间也有强的结合力,其中,MWL-B的纤维素酶亲和力是EOL-B的1.17倍。因此,在酶水解过程中,木质素将会与纤维素竞争吸附纤维素酶。Langmuir方程中分配系数R用于估计纤维素酶与底物之间结合力的强弱。纤维素酶在Avicel、MWL-B和EOL-B上的R分别为0.47、 0.04和0.09,并且纤维素酶与MWL-B之间的分配系数是EOL-B的2.25倍。以上数据表明与MWL-B相比,EOL-B与纤维素酶之间具有较低的亲和力和结合力,故对纤维素酶的最大吸附量也低于MWL-B。
因此,推测如下:相比MWL-B,在EOL-B上可能存在一些基团,能够排斥、阻止纤维素酶的靠近,使纤维素底物周围的酶蛋白浓度增加,进而促进了酶解效率,这与2.2节的分析结果相一致。
2.4红外光谱分析
为了探讨MWL-B和EOL-B的结构对酶水解和酶吸附的影响,分别对它们进行红外光谱(FT-IR)分析,结果如图3所示。从图中b、c线可以看出,在1597、 1506和1427 cm-1处的吸收峰为木质素苯环骨架振动的特征吸收峰[17],说明MWL-B和EOL-B具有木质素特有的苯环结构;1506 cm-1处的吸收峰为与苯环相连的C—H变形振动吸收峰。1330、 1270 cm-1处的吸收峰分别由紫丁香基和愈创木基的苯环伸缩振动引起。1165、 830 cm-1处的2个峰以及1162 cm-1处的肩峰[18]表明竹材木质素属于典型的禾草类木质素(GSH型),其大分子由对羟基苯丙烷、愈创木基丙烷和紫丁香基丙烷3种基本结构单元组成。以上结果表明:2个木质素模型物具有木质素的基本的苯基丙烷结构。

2.5核磁共振光谱分析
13C NMR是检测木质素碳骨架结构的有效手段,可用来确定木质素的基本成分,如芳基醚键、缩合和非缩合的结构单元、甲氧基单元等信息,能提供木质素大分子的整体结构信息,MWL-B和EOL-B的13C NMR谱图如图4所示。
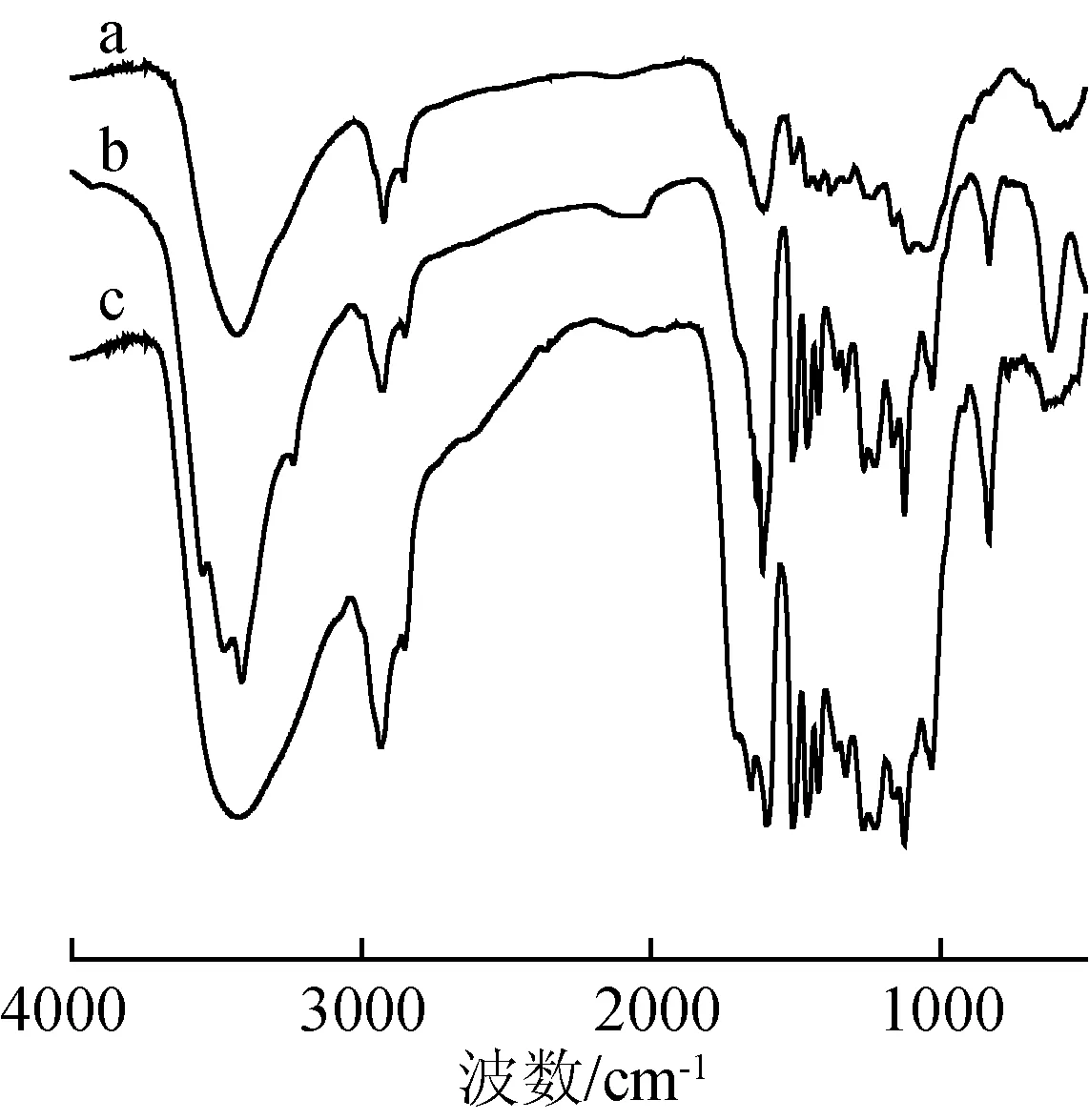
图3 苦竹(a)、苦竹磨木木质素(b)和乙醇木质素(c)红外吸收光谱图Fig.3 FT-IR spectra of bitter bamboo(a), MWL-B(b)and EOL-B(c)
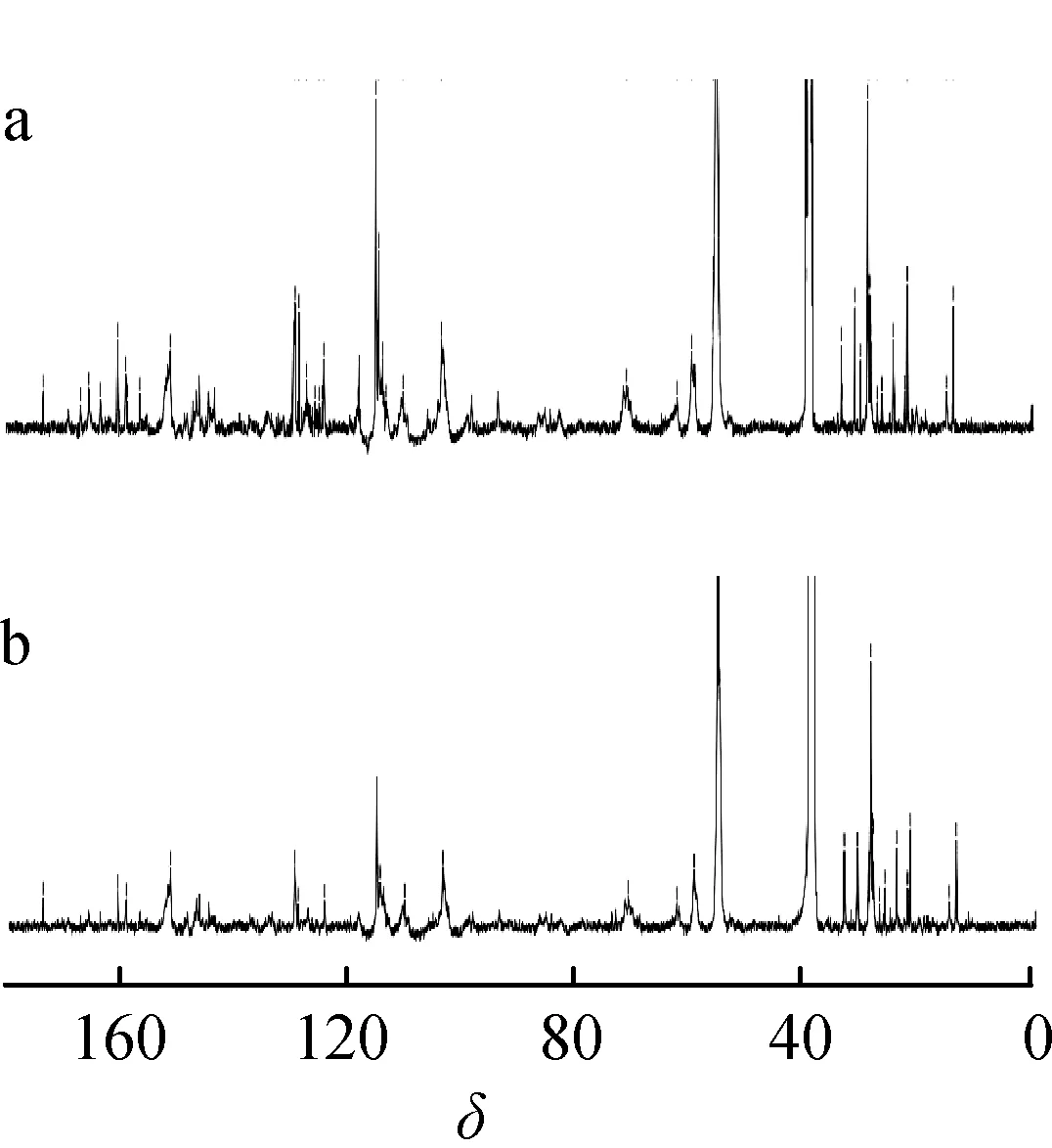
图4 苦竹磨木木质素(a)和乙醇木质素(b) 的13C NMR谱图Fig.4 13C NMR spectra of MWL-B(a) and EOL-B(b)
从图4可以看出,MWL-B(a)和EOL-B(b)的碳水化合物信号(δ90~102)强度很弱,说明这2种木质素中的糖含量较低,这与其化学成分分析中葡聚糖和木聚糖质量分数小于8 %是一致的,因此其作为模型物来分析木质素结构对纤维素酶水解和酶吸附的影响较为合理。木质素13C NMR的芳环区分为3个区域:δ140~160为氧化的芳基碳,δ123~140 为芳环碳碳键和δ103~123的芳环亚甲基碳[19-20]。与MWL-B相比较,EOL-B的氧化碳、芳环的碳碳键和芳环的亚甲基碳信号强度均降低,表明经乙醇预处理后,β-β、β-5键含量降低,即木质素中的β-β、β-5键发生了断裂。EOL-B来源于乙醇预处理竹材后,溶解于乙醇中的木质素,从图4还可以看出,在这一过程中,原本木质素在β碳上的烷醚键或芳醚键断裂,并且断裂后的小分子片段没有继续缩合,因此在EOL-B中凝缩单元少于MWL-B。研究已经表明木质素结构中凝缩单元含量高将增加木质素分子的疏水性能,终将增加木质素对纤维素酶蛋白疏水性氨基酸的吸附,导致酶水解效率降低[21]。
木质素各单元间的连接键的信号峰出现在δ50~90区域,β-O- 4′信号出现在δ72.3和δ60.2处,β-β位于δ71.9处,β-5在δ62.8处[19-20]。正如图4所示,EOL-B在此区域的信号峰强度大于MWL-B,表明在乙醇预处理过程中,木质素的β-O- 4′断裂,大分子碎片化,并且碎片化的小分子发生缩合反应的几率较小。这与Hallac和Sannigrahi的研究结果一致[22-23]。β-O- 4′断裂后,引入了大量的亲水性基团羟基,这与EOL-B在FT-IR中3448 cm-1处的羟基的O—H振动吸收峰的强度大于MWL-B是一致的。此外,δ56.35处为甲氧基的信号峰,说明球磨过程中甲基芳醚键没有断裂。研究表明木质素分子与纤维素酶之间的疏水作用导致了它们之间的非特异吸附现象[24-25]。木质素分子上亲水基团的增加,导致木质素分子亲水性能增强,对纤维素酶产生排斥作用,从而使纤维素周围纤维素酶的浓度增加,因此,EOL-B对纤维素酶的亲和力和最大吸附量均小于MWL-B,加入EOL-B的纤维素的酶水解得率升高。
3 结 论
3.1从苦竹中提取乙醇木质素(EOL-B)和磨木木质素(MWL-B),并以2种木质素为模型物添加到微晶纤维素中,研究木质素对纤维素酶解的影响。结果表明:当0.4 g微晶纤维素中加入40、80和160 mg EOL-B时,反应72 h葡萄糖得率逐渐升高,分别为56.06 %、 60.61 %和61.06 %;但葡萄糖得率随MWL-B的添加量增大而降低,与对照葡萄糖得率51.34 %相比,加入8 g/L MWL-B的葡萄糖得率降低了10 %。
3.2与MWL-B相比较,EOL-B与纤维素酶之间具有较低的亲和力和结合力,纤维素酶在MWL-B上的最大吸附量为EOL-B的1.96倍。
3.3MWL-B对纤维素酶的非生产性吸附降低了酶解得率;苦竹经乙醇预处理后,β碳上的芳醚键和烷醚键发生断裂,引入了大量的亲水性基团羟基,增加了木质素分子的亲水性能,并在β碳上形成碳碳凝缩单元的机率较小,致使EOL-B分子对纤维素酶蛋白的吸附量减少,导致纤维素酶水解得率增加。
参考文献:
[1]ZHANG K,PEI Z J,WANG D H.Organic solvent pretreatment of lignocellulosic biomass for biofuels and biochemicals: A review[J].Bioresource Technology,2016,199:21-33.
[2]苏东海,孙君社.提高纤维素酶水解效率和降低水解成本[J].化学进展,2007,19(718):1147-1152.
[3]仉磊,李涛,王磊,等.糠醛渣的纤维素酶水解及其最优纤维素转化条件[J].农业工程学报,2009,25(10):226-230.
[4]陈帅.酶水解对麦草纤维结构和性能及微纤丝初步制备的影响[D].西安:陕西科技大学硕士学位论文,2015.
[5]YAN Z P,LI J H,LI S Z,et al.Impact of lignin content on the sweet sorghum bagasse enzymatic hydrolysis[J].Energy Procedia,2014,61:1957-1960.
[6]LIU W,CHEN W,HOU Q X,et al.Surface lignin change pertaining to the integrated process of dilute acid pre-extraction and mechanical refining of poplar wood chips and its impact on enzymatic hydrolysis[J].Bioresource Technology,2016,228:125-132.
[7]LIN X L,QIU X Q,YUAN L,et al.Lignin-based polyoxyethylene ether enhanced enzymatic hydrolysis of lignocelluloses by dispersing cellulase aggregates[J].Bioresource Technology,2015,185:165-170.
[8]LI Y,QI B K,LUO J Q,et al.Effect of alkali lignins with different molecular weights from alkali pretreated rice straw hydrolyzate on enzymatic hydrolysis[J].Bioresource Technology,2016,200:272-278.
[9]LAI C H,TU M B,LI M,et al.Remarkable solvent and extractable lignin effects on enzymatic digestibility of organosolv pretreated hardwood[J].Bioresource Technology,2014,156(4):92-99.
[10]文甲龙.生物质木质素结构解析及其预处理解离机制研究[D].北京:北京林业大学博士学位论文,2014.
[11]史正军.甜龙竹及巨龙竹半纤维素、木质素结构诠释及相互间化学键合机制解析[D].北京:北京林业大学博士学位论文,2013.
[12]LI Y F,SUN Z P,GE X Y,et al.Effects of lignin and surfactant on adsorption and hydrolysis of cellulases on cellulose[J].Biotechnology for Biofuels,2016,9(1):1-9.
[13]BALLESTEROS I,OLIVAl J M,NEGRO M J,et al.Enzymic hydrolysis of steam exploded herbaceous agricultural waste(Brassicacarinata) at different particule sizes[J].Process Biochemistry,2002,38(2):187-192.
[14]CHEN M,ZHAO J,XIA L M.Enzymatic hydrolysis of maize straw polysaccharides for the production of reducing sugars[J].Carbohydrate Polymers,2008,71(3):411-415.
[15]SUN S L,HUANG Y,SUN R C,et al.The strong association of condensed phenolic moieties in isolated lignins with their inhibition of enzymatic hydrolysis[J].Green Chemistry,2016,18:4276-4286.
[16]ZHOU H F,LOU H M,YANG D J,et al.Lignosulfonate to enhance enzymatic saccharification of lignocelluloses: Role of molecular weight and substrate lignin[J].Industrial and Engineering Chemistry Research,2013,52(25):8464-8470.
[17]NONAKA H,KOBAYSASHI A,FUNAOK M.Behavior of lignin-binding cellulase in the presence of fresh cellulosic substrate[J].Bioresource Technololy,2013,135:53-57.
[18]GUO F F,SHI W J,SUN W L,et al.Differences in the adsorption of enzymes onto lignins from diverse types of lignocellulosic biomass and the underlying mechanism[J/OL].Biotechnology for Biofues,2014,7:38[2017-09-26].https://doi.org/10.1186/1754-6834-7-38.
[19]YANG H T,XIE Y M,ZHENG X,et al.Comparative study of lignin characteristics from wheat straw obtained by soda-AQ and kraft pretreatment and effect on the following enzymatic hydrolysis process[J].Bioresource Technology,2016,207:361-369.
[20]SUN S L,WEN J L,LI M F,et al.Revealing the structural inhomogeneity of lignins from sweet sorghum stem by successive alkali extractions[J].Journal of Aaricultural and Food Chemistry,2013,61(18):4226-4235.
[21]YU H,LI X,ZHANG W,et al.Hydrophilic pretreatment of furfural residues to improve enzymatic hydrolysis[J].Cellulose,2015,22(3):1675-1686.
[22]HALLAC B B,PU Y,RAGAUSKAS A J.Chemical transformations ofBuddlejadavidiilignin during ethanol organosolv pretreatment[J].Energy Fuel,2010,24(4):2723-2732.
[23]SANNIGRAHI P,RAGAUSKAS A,MILLER S.Lignin structural modifications resulting from ethanol organosolv treatment of Loblolly pine[J].Energy Fuel,2010,24(1):683-689.
[24]WANG W X,ZHU Y S,JING D,et al.Influence of lignin addition on the enzymatic digestibility of pretreated lignocellulosic biomasses[J].Bioresource Technology,2015,181:7-12.
[25]LI Y,SUN Z,GE X,et al.Effects of lignin and surfactant on adsorption and hydrolysis of cellulases on cellulose[J/OL].Biotechnology for Biofuels,2016,9(20)[2017-09-26].https://doi.org/10.1186/s13068-016-0434-0.

