佳乐麝香对萝卜种子发芽及DNA损伤的生态毒理影响
姜丽思,张倩茹,王建美,李斯雯,宋婕,3,崔伟娜,刘宛
1. 中国科学院沈阳应用生态研究所 污染生态与环境工程重点实验室,沈阳 110016 2. 中国科学院大学,北京 100049 3. 辽宁大学环境学院,沈阳 110036 4. 上海应用技术学院,上海 201418
佳乐麝香(HHCB)是一种典型的半挥发疏水性多环类人工合成麝香[1],具有特殊的香味、良好的提香和定香能力以及价格低廉等优点,现已作为工业香料被广泛地应用于日用化工产品,如香水、面霜、洗发水、沐浴露、柔顺剂、肥皂和洗衣粉等[2]。由于被大量使用,HHCB被持续不断地释放到环境中,所产生的生态风险已引起各国政府及学界的高度重视[3]。已有研究表明,HHCB极易通过食物摄入、吸入吸收和皮肤接触等途径进入人和动物体内,抑制细胞抵御化学物质的能力,并在体内蓄积进而导致潜在危害[2-4]。毒理学研究也表明,其对水生生物具有亚急性毒性、弱的雌激素作用与抗雌激素效应,以及发育毒性和内分泌干扰等效应[5-7]。HHCB能够通过污水灌溉、污泥农用、大气沉降和垃圾填埋等多种途径进入并积累于环境中,从而提高其对生物的胁迫水平。目前,针对HHCB的研究主要集中于水体、沉积物和污泥中的分布特征[8-9],对其毒性效应的研究多局限于水生生态系统,大部分也是针对水生植物、鱼类等细胞毒性测试[10],而对于陆生植物基因组DNA损伤方面的研究工作鲜有报道。
随机引物扩增多态性(Random Amplification of Polymorphic DNA, RAPD)技术是美国学者Williams和Welsh于1990年首先创立的,该技术是利用随机引物对目的基因组DNA进行PCR扩增,并分析扩增产物DNA多态性的一种DNA分子标记技术[11-12]。由于其具有操作简单、通用性好、灵敏度高等优点,RAPD技术被广泛应用于遗传图谱构建、遗传多样性分析、土壤酶活性、微生物群落结构分析等生物学领域[13]。在生态毒理学研究中,RAPD技术多以人和动物为研究对象[14-17],近年来才逐渐应用于植物,例如,研究逆境胁迫下植物的基因突变[18-20],检测污染物对植物胁迫造成的DNA损伤,包括DNA加合物、插入缺失、断裂、碱基置换等[20-23]。目前,利用RAPD技术已成功检测出重金属、雌激素、多环芳烃、农药等多种污染物胁迫条件下对细胞DNA造成的损伤和突变[31-33]。因此,本研究选用RAPD技术来探究不同浓度HHCB胁迫是否能够对大田作物萝卜基因组造成DNA损伤,以期为农田污染生态毒理学诊断提供快速灵敏的生物标记物,为制定农田污染安全预警标准提供理论依据和方法指导。
本研究选用大田常见作物十字花科植物萝卜(Raphanus sativus L.)为受试植物,通过发芽实验以及RAPD分析,研究HHCB对萝卜发芽率、芽伸长、根伸长及DNA损伤的影响,探究各项表观生长指标和基因组对HHCB胁迫的敏感程度,分析胁迫造成的DNA损伤状态,并通过不同浓度处理间的遗传相似性比较,筛选出可用于检测HHCB遗传毒性效应的敏感生物标记物,为农业实践提供理论和方法学指导。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
主要仪器:分子凝胶成像系统(BIO-RAD,美国);小型台式高速离心机(Eppendorf,德国);植物培养箱(Panasonic,日本);PCR仪(Biometra,德国);核酸蛋白测定仪(Eppendorf,德国)。
主要试剂:佳乐麝香(50%邻苯二甲酸二乙酯溶液,北京祥云兴业科技有限公司);新型植物基因组DNA提取试剂盒(北京康维世纪生物科技有限公司);LA Taq(TaKaRa,日本);dNTP Mixture(TaKaRa,日本);DL2000 DNA Marker(TaKaRa,日本);Agarose Regular(TaKaRa,日本);30%过氧化氢(北京博艾远上生物科技有限公司)。
1.2 种子萌发实验
1.2.1实验方法
根据预实验结果及相关文献,设置HHCB浓度为0、5、10、25、50 mg·L-1[28],每个处理设置3个平行。全部实验均在无菌条件下操作。实验前,每个培养皿放置25粒饱满、均匀的萝卜(Raphanus sativus L.)种子(购自于沈阳农业大学种子站),用3%过氧化氢溶液消毒5 min,以避免微生物等原因对种子萌发的影响;再用ddH2O冲洗3次,以清除残留过氧化氢。在无菌培养皿中平整地放入2层滤纸,分别加入5 mL不同浓度的经超声震荡制备均匀的HHCB悬浊液,并用封口膜沿皿壁密封,以防止HHCB的快速挥发及保持相对一致的呼吸和无菌环境。将培养皿放置在(25 ± 1) ℃的光照培养箱中黑暗培养5 d,对芽长大于2 mm的萝卜幼苗进行计数及根长与芽长的测量,并计算各处理组种子发芽率、根伸长抑制率和芽伸长抑制率。
1.2.2数据分析
发芽率计算:发芽率=发芽种子数/种子总数 × 100%
根伸长(或芽伸长)抑制率计算:抑制率=(1-处理/对照) × 100%
数据采用SPSS 23.0进行处理,结果以平均值±标准差表示;利用单因素方差分析中的 LSD多重比较检验不同处理间的结果差异显著性:P < 0.05为差异显著,P < 0.01为差异显著。
1.3 DNA损伤实验
1.3.1实验方法
实验材料的培养与处理同1.2.1,将相同处理的萝卜幼苗根尖(1~2 cm)进行混合,按照试剂盒说明书提取幼苗全基因组DNA,所得DNA用核酸蛋白测定仪检测其纯度及含量,根据测定结果,上样100 ng DNA进行1.2%琼脂糖凝胶电泳,并用DL2000 DNA Marker进行含量校准,再进行分装,于-20 ℃保存备用。
参照Liu等[20-21]方法进行RAPD分析,对PCR条件略做优化,从GC含量较高(50%~60%),一般为9~10个寡核苷酸的12条随机引物中筛选出4条能够获得清晰条带,重复性好的引物P3、P9、P10、P11(表2)。随机引物扩增反应体系(25 μL)如下:2.5 μL 10 × PCR Buffer,0.2 mmol·L-1dNTP Mixture,1 U LA Taq DNA聚合酶,0.5 μmol·L-1引物,80 ng DNA模板,并用ddH2O补足体系。PCR条件:94 ℃预变性5 min,94 ℃变性60 s,38 ℃退火60 s,72 ℃延伸90 s,循环35次,72 ℃延伸10 min。每次PCR反应均设3~4个重复,并取5 μL PCR产物进行1.2%琼脂糖凝胶电泳检测,以验证RAPD可重复性。再将验证结果良好的PCR产物用5%半变性聚丙烯酰氨凝胶(含50%尿素)电泳检验,银染显色并拍照记录电泳结果。
1.3.2数据分析
电泳图谱使用Image Lab(Bio-Rad)软件对重复性好的条带(包括亮带和可识别的暗带)进行分析,每一个条带为一个标记,代表一个引物的结合位点。根据各个分子标记的迁移率及其有无统计数据,若有条带(包括清晰条带、可识别弱带)出现记作“1”,同一位置没有条带记为“0”。应用Microsoft Excel 2010建立各引物不同浓度间的“0、1”数据库,统计不同胁迫浓度下扩增出来的总条带数和多态性条带数。
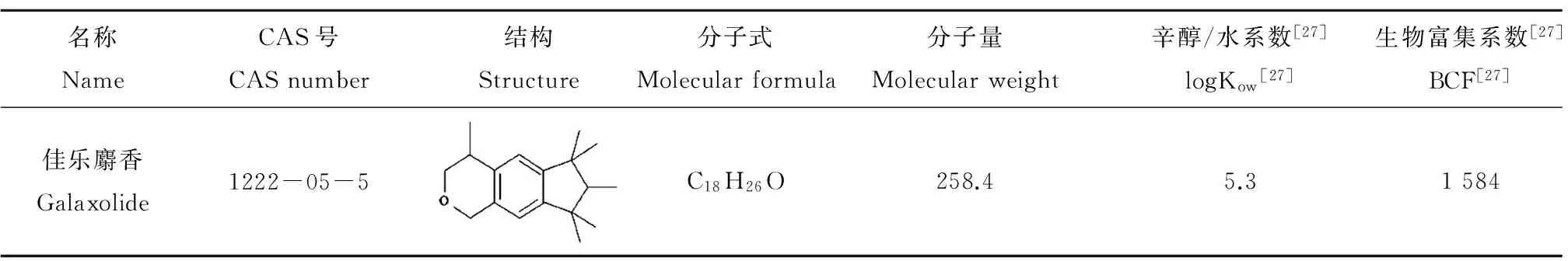
表1 佳乐麝香(HHCB)的基本理化性质Table 1 Physiochemical properties of galaxolide (HHCB)
各引物的多态性条带百分率(percentage of polymorphic bands, PPB)计算:
PPB=(多态位点数/位点总数) × 100%
基因组模板稳定性(GTS)计算:GTS= (1-a/n) × 100%。式中,a为处理组幼苗根尖的RAPD多态性条带数;n为对照组的总条带数。多态性条带数为与对照组相比,处理组出现的和消失的PCR条带数的总和[29]。
用NTSYS 2.10软件计算遗传相似性系数(Genetic similarity,GS),采用UPGMA方法进行聚类分析,构建遗传相关聚类图。
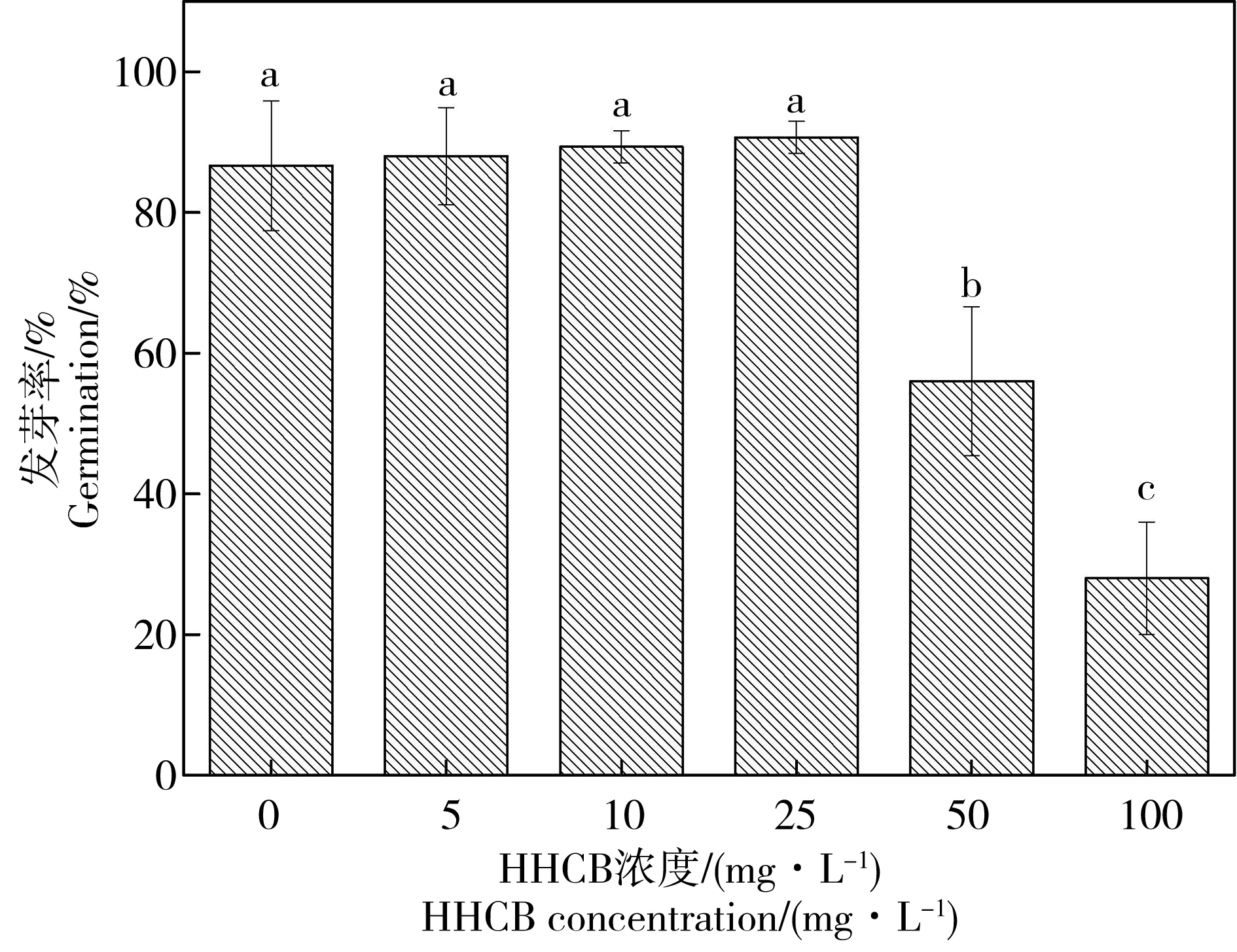
图1 HHCB对萝卜发芽率的影响注:字母不相同表示各处理组之间差异显著(P < 0.05),下同。Fig. 1 Effects of HHCB on the germination rate of Raphanus sativus L.Note: Values with different letters are significantly different from each other (P < 0.05). The same below.
2 结果(Results)
2.1 HHCB对萝卜种子表观生长指标的影响
2.1.1对发芽率的影响
从图1和图2A可以看出,当HHCB胁迫浓度低于25 mg·L-1时,萝卜发芽未受到显著影响(P > 0.05),发芽率基本维持在86.7%~90.7%;当HHCB胁迫浓度达到50 mg·L-1,甚至更高时(100 mg·L-1),萝卜发芽受到显著抑制(P < 0.05)作用,发芽率分别为56%和28%。这表明萝卜种子的发芽率与HHCB胁迫浓度之间存在明显的剂量-效应关系,HHCB的存在与否及浓度高低能够对萝卜种子萌发产生显著的生理生化反应,最终降低种子萌发率,甚至产生严重的抑制效果。
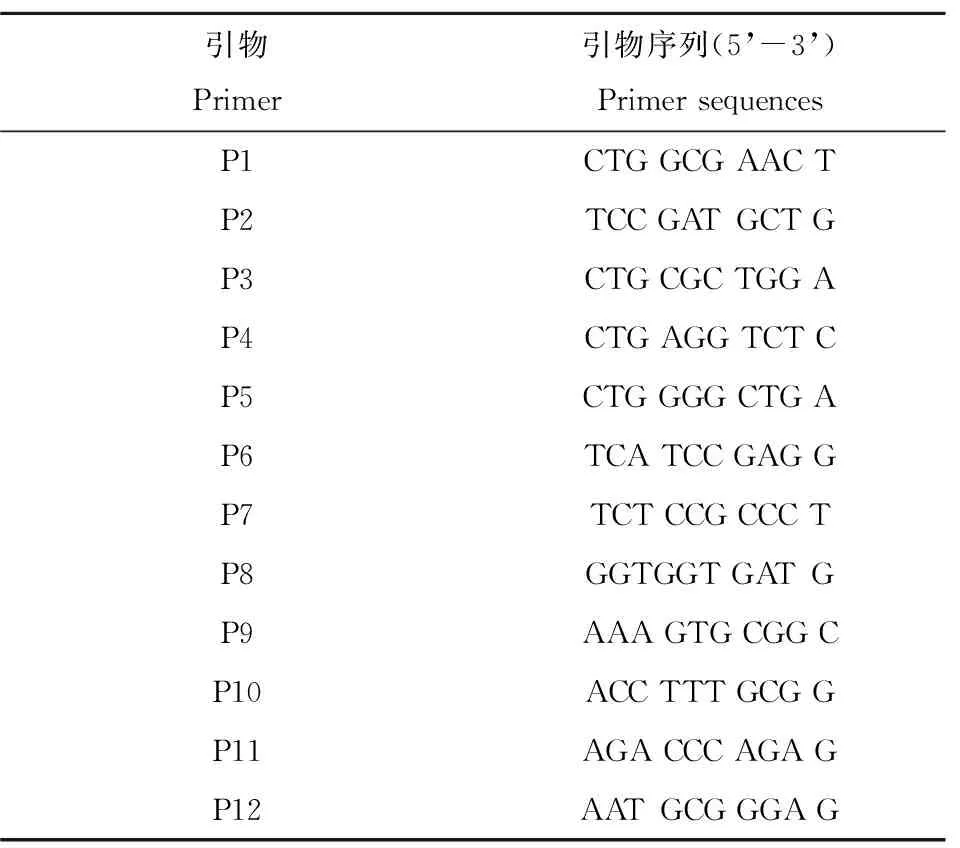
表2 RAPD实验所用随机引物序列Table 2 Sequences of 12 primers used in the RAPD experiment

图2 HHCB对萝卜生长的影响Fig. 2 Effects of HHCB on the growth of Raphanus sativus L.
2.1.2对萝卜根长和芽长的影响
从图2B和图3可以看出,HHCB对萝卜根及芽的生长具有明显的抑制作用。随着HHCB的浓度从0增加至100 mg·L-1,萝卜的根长从10.15 cm显著缩短至2 cm以下,芽长从4.66 cm缩短至1 cm以下。特别是当HHCB浓度超过25 mg·L-1时,萝卜根长和芽长已不及对照组的二分之一,根长分别为1.69 cm和0.61 cm;芽长分别为1.15 cm和0.34 cm。
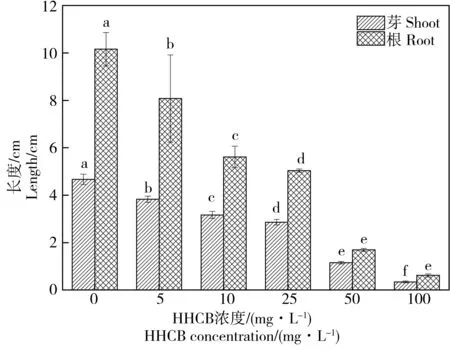
图3 HHCB对萝卜根长和芽长的影响Fig. 3 Effects of HHCB on the root and shoot length of Raphanus sativus L.
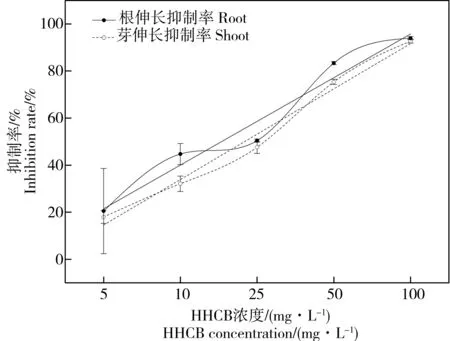
图4 HHCB对萝卜根伸长和芽伸长抑制率的影响Fig. 4 Effects of HHCB on the inhibition rates of root and shoot elongation of Raphanus sativus L.
2.1.3对萝卜根伸长和芽伸长抑制率的影响
由图4可知,HHCB在5~100 mg·L-1的浓度范围内,萝卜的根伸长和芽伸长抑制率均随污染物浓度增加而呈现上升的趋势。特别是当HHCB浓度达到100 mg·L-1时,萝卜的根伸长和芽伸长抑制率非常接近,达93.00%左右。回归分析表明(表3),线性和对数方程均可以很好地拟合根伸长和芽伸长抑制率与HHCB浓度之间的关系,特别是芽伸长抑制率与HHCB浓度呈现显著正相关(R2=0.91),可以明显表征HHCB对萝卜的胁迫效应。采用SPSS 23.0 统计软件中Probit回归计算出HHCB对萝卜根长和芽长的EC50分别为13.76 mg·L-1和21.66 mg·L-1, 这表明萝卜根系较芽对HHCB胁迫更为敏感。
2.2 对萝卜幼苗DNA损伤的影响
2.2.1对根尖基因组DNA含量的影响
提取的萝卜幼苗根尖全基因组DNA经琼脂糖凝胶电泳检测,条带清晰整齐,无杂质污染和降解(图5),且A260/A280比值均在1.8~2.0之间,说明提取的DNA质量较好,符合RAPD的分析要求。对不同样品DNA含量检测也发现,HHCB能够显著抑制萝卜幼苗根尖DNA的产生(图6)。与对照组相比,随着HHCB浓度的增加,DNA含量显著降低,从116.4 μg·g-1降低至76.38 μg·g-1(50 mg·L-1处理组);而100 mg·L-1处理组萝卜发芽量及根长量不足,不能进行全基因组DNA提取。特别当HHCB浓度从0增加至25 mg·L-1,DNA含量基本呈线性降低,此后下降略微缓慢。这表明HHCB的胁迫使萝卜幼苗根尖基因组DNA发生断裂降解,且随着胁迫浓度的增加,基因组DNA降解程度增加,甚至其合成也受到显著抑制,使其含量处于较低水平。
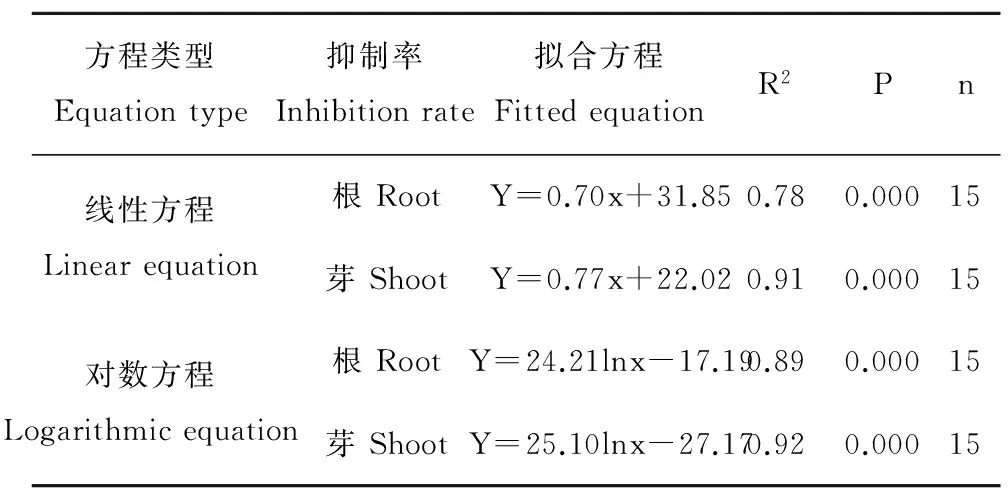
表3 HHCB浓度与根伸长和芽伸长抑制率的拟合方程Table 3 Fitted equations between the concentrations of HHCB and the inhibition rates of root and shoot elongation of Raphanus sativus L.
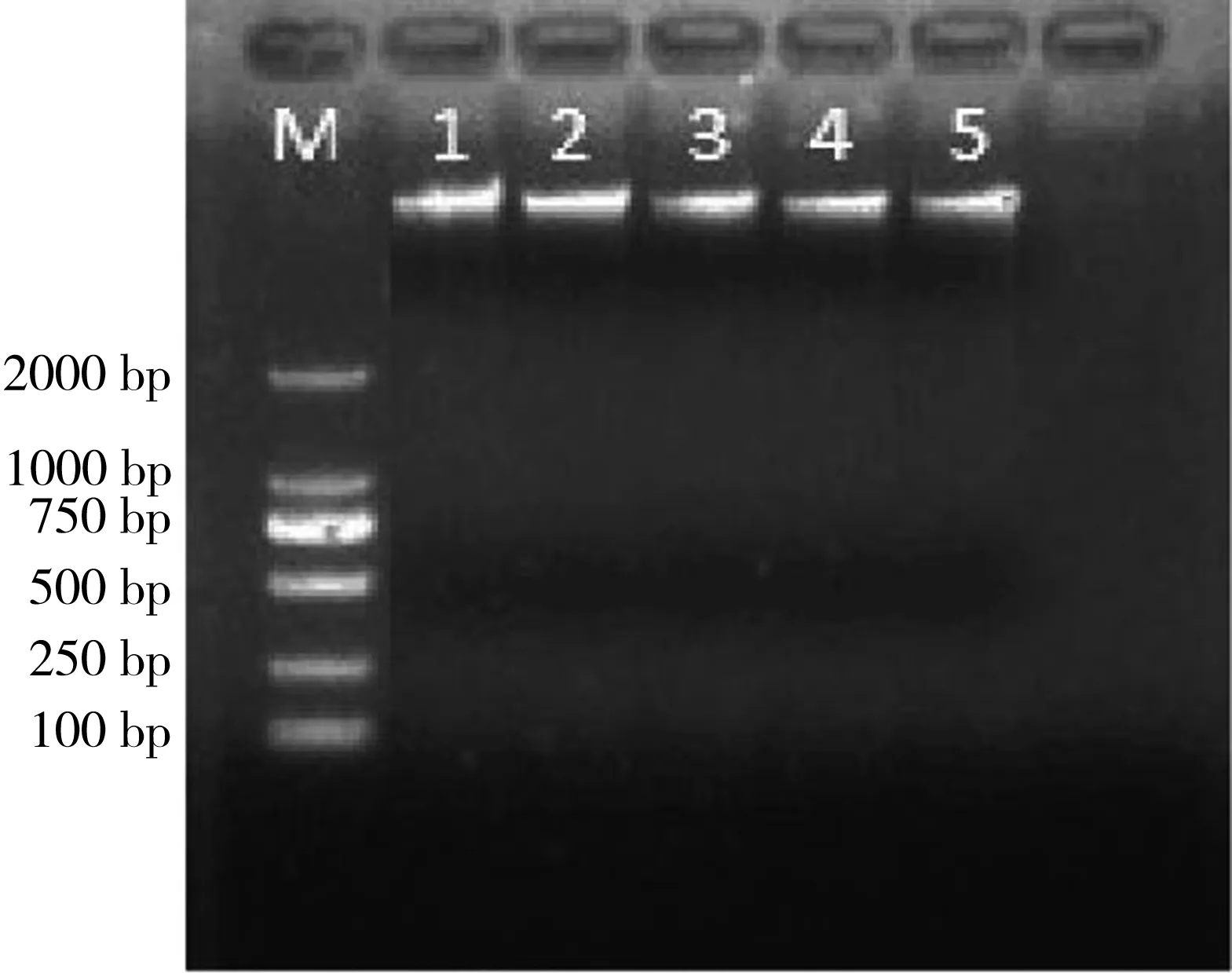
图5 萝卜根尖基因组DNA电泳图注:M为DL2000 DNA marker;1~5分别表示HHCB的不同胁迫浓度(0、5、10、25、50 mg·L-1)。Fig. 5 Electrophoretogram of the genomic DNA in the seedling roots of Raphanus sativus L.Note: Lane M is DL2000 DNA marker. Lane 1 to 5 represent the different concentrations of HHCB (0, 5, 10, 25 and 50 mg·L-1).
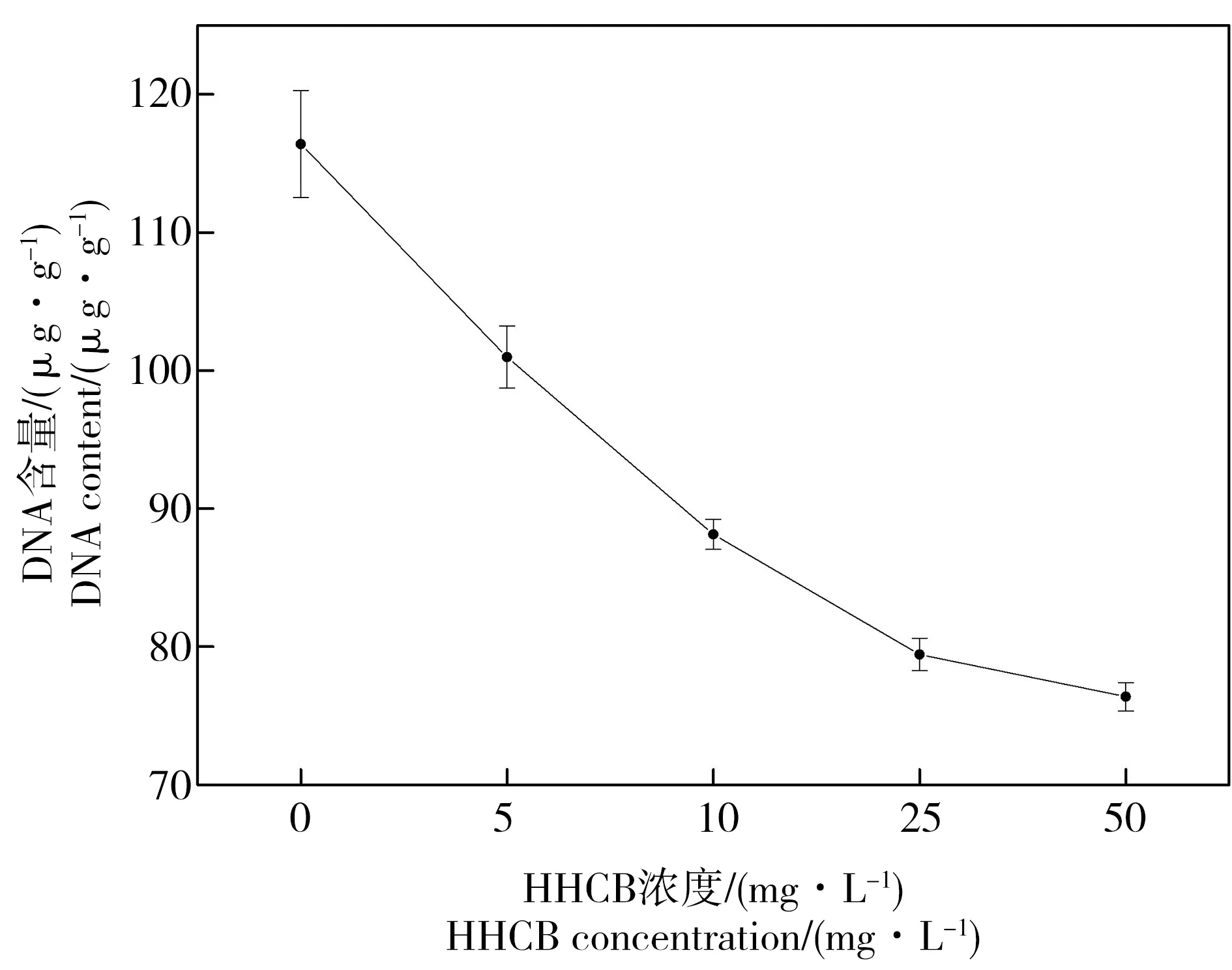
图6 HHCB对萝卜根尖全基因组DNA含量的影响Fig. 6 Effects of HHCB on the contents of the genomic DNA in the seedling roots of Raphanus sativus L.
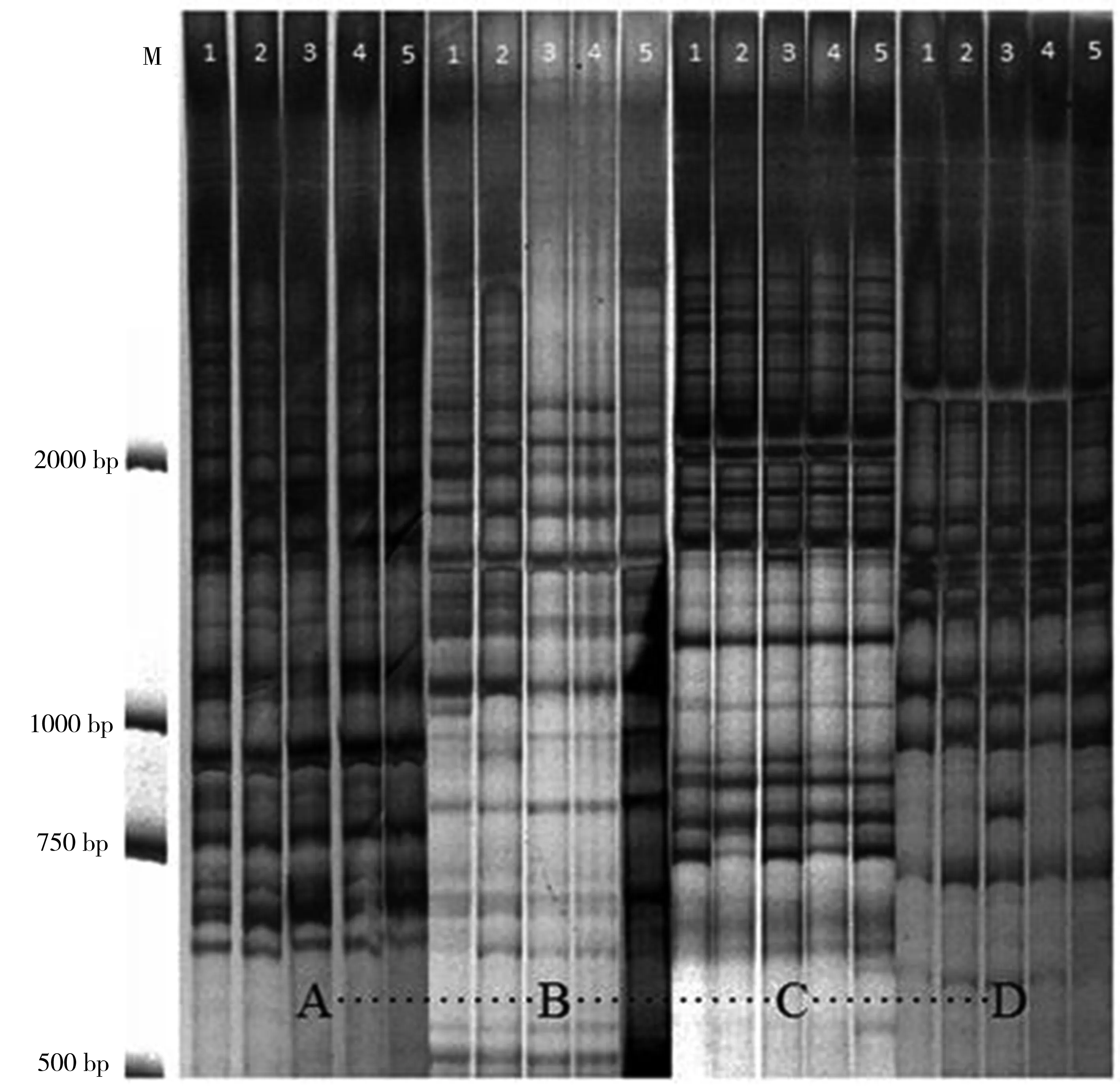
图7 萝卜根尖基因组RAPD电泳图注:M为DL2000 DNA marker; 1~5分别表示HHCB的不同胁迫浓度(0、5、10、25、50 mg·L-1);A~D分别表示不同引物 P3、P9、P10、P11。Fig. 7 Electrophoretogram of the genomic RAPD in the seedling roots of Raphanus sativus L.Note: Lane M is DL2000 DNA marker. Lane 1 to 5 represent the different concentrations of HHCB (0, 5, 10, 25 and 50 mg·L-1). Letter A to D represent the primers of P3, P9, P10 and P11.
2.2.2对根尖基因组DNA损伤的影响
选用4条能够获得清晰条带、重复性好的RAPD引物对萝卜根尖基因组DNA进行PCR扩增。从图7可以看出,4条引物均扩增出特异性强且稳定性较好的PCR产物。所得扩增条带的相对分子量集中在500~2 150 bp之间。各处理组萝卜根尖基因组DNA的RAPD图谱在数目、位置及荧光强度上均发生了明显的变化,表明在此PCR条件下的扩增效果较为理想。利用Image Lab软件对RAPD图谱的条带数量进行统计分析。由表4可知,在5 mg·L-1时,DNA多肽率和基因组模板稳定性(GTS)均为对照的50.0%,即HHCB胁迫导致萝卜根尖基因组DNA损伤的最低观察效应浓度为5 mg·L-1。由此可见,低浓度的HHCB胁迫就足以对萝卜根尖基因组DNA造成严重损伤,且随着HHCB处理浓度的增加,DNA多态率增加,基因组模板稳定性(GTS)减小。这些都表明HHCB能够造成植物严重的DNA损伤,对基因组的稳定性产生较大影响。
对RAPD电泳图谱进行分析,计算不同处理组间的遗传相似性系数,采用UPGMA法构建遗传关系聚类图(图8)。结果显示,处理组间的遗传相似性系数变化范围在0.59~0.72之间,遗传多样性存在一定的差异。5个不同浓度处理组在遗传相似性系数0.65的位置上可分为3类:对照组和高浓度组(50 mg·L-1)各为一类,中低浓度组(5、10、25 mg·L-1)归为一类;而处理组在遗传相似性系数0.72的位置上可分为3类:低浓度组(5和10 mg·L-1)为一类,中浓度组(25 mg·L-1)为一类,它们之间的相似性系数最大为0.72。5和10 mg·L-1处理组间的遗传相似性系数高于25和50 mg·L-1处理组间的相似性系数,表明HHCB的浓度对受试植物的遗传多样性具有显著影响,随着化学品浓度的升高,DNA损伤程度增大,遗传相似性变远。
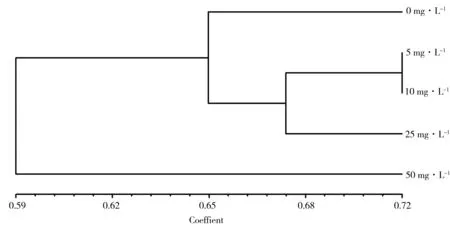
图8 不同处理组间聚类分析图Fig. 8 Dendrogram of cluster analysis for different treatments
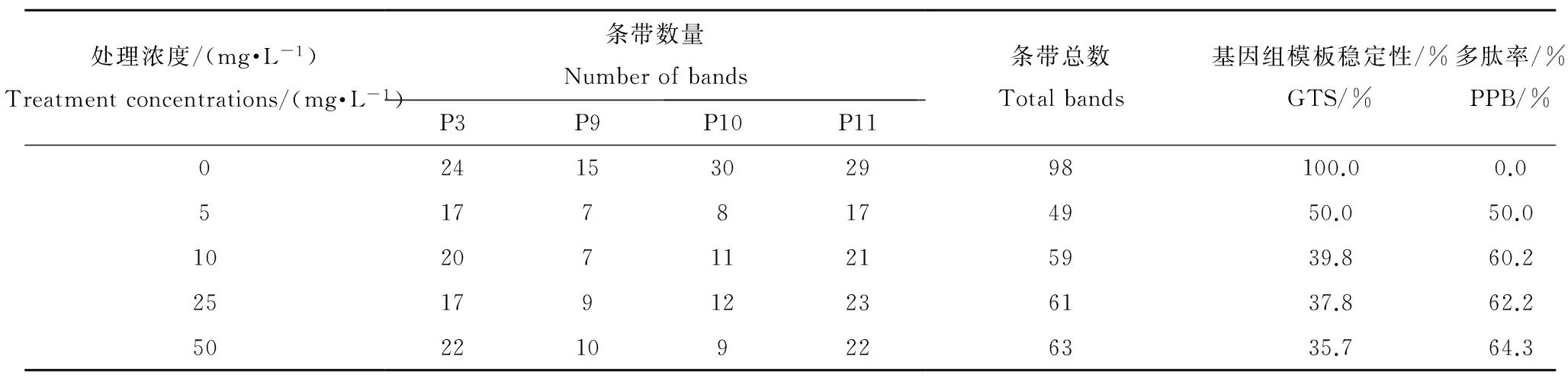
处理浓度/(mg·L-1)Treatmentconcentrations/(mg·L-1)条带数量NumberofbandsP3P9P10P11条带总数Totalbands基因组模板稳定性/%GTS/%多肽率/%PPB/%02415302998100.00.051778174950.050.01020711215939.860.22517912236137.862.25022109226335.764.3
3 讨论(Discussion)
在以植物作为模式生物的生态毒理学评价中,经常使用较为容易获得的表观生长指标,如发芽率、根长、芽长或生物量等来考察污染物的生态毒性效应[30],虽然这可以在一定程度上简便、快速地评价污染物毒性,但往往也忽略了很多潜在的毒性风险。从本研究中,我们可以清晰地观察到HHCB在一定浓度范围内(5~25 mg·L-1)对萝卜发芽无显著性影响,而陈苏等[28]的研究显示,一定浓度的HHCB(50~150 mg·kg-1)对小麦(Triticum aestivum)发芽有促进作用。研究人员认为[28],这是由于HHCB所具有的类雌激素作用所导致的,低剂量HHCB可以使某些中毒植物细胞产生兴奋效应,进而在一定程度上刺激植物生长。虽然污染物同为HHCB且浓度相近,但对于不同的受试植物,发芽效应所表现出的敏感程度却不尽相同。此外,我们还发现HHCB对萝卜的根伸长抑制率明显高于芽伸长抑制率,这与范飞等[31]研究麝香酮对小麦种子发芽和根伸长的毒性效应结果一致,即亦显示麝香酮胁迫小麦的根长抑制率明显大于芽长抑制率。本研究中,萝卜种子发芽、根伸长、芽伸长对HHCB的敏感度依次为:根伸长>芽伸长>发芽率,这与Liu等[32]提出的植物种子发芽相关各项指标的敏感度顺序一致,而这一现象可能与种子发芽和根、芽伸长的生长过程有关。种子发芽所需能量主要来自于胚内养分的供应,所以外源污染物对种子芽长的影响在一定浓度下表现得不是很明显,只有当外源污染物达到一定浓度时,种子的发芽过程才会被抑制。根据宋玉芳等[33]的研究,小麦种子发芽对有机污染物的敏感度较重金属强,而且在根系的受害症状与受害机制上都存在明显的差异。植物受到重金属(Cu、Pb、Zn、Cr)胁迫后,仅仅是根伸长受到抑制,没有其他明显的受害症状;而本研究中,植物受到新型污染物HHCB胁迫后,不仅根伸长受到抑制,芽伸长也受到明显的抑制。且当HHCB浓度较高时,萝卜的根和芽均有矮化变粗的现象(图2),这与范飞等[31]的研究结果一致。有研究表明,有机污染物的生态毒性不仅与其浓度有关,还可能与它的其他化学特性及其对靶标生物的毒性机制有关[31]。水培实验中,萝卜幼苗的根从一开始就直接浸入到溶液中,其生长和发育全过程均通过根系来直接接触外源污染,因而根部对污染物的胁迫响应更直接,更敏感。本研究结果是在水培条件下获得的,干扰因素相对较少,更适宜研究单纯污染物对生物的影响;而在土壤环境中存在诸多能够影响HHCB化学性质的因素,因此水培实验所获得的结果更有利于污染物作用机制的研究,也必然与土培条件下的结果存在一定差异。
生物基因组DNA是遗传信息的载体,具有良好的稳定性。环境污染物可以诱导生物体细胞内发生DNA损伤和突变,从而导致引物结合位点的核苷酸增加或缺失,并最终影响DNA片段的图谱形态[29]。张义贤等[34]和齐雪梅等[35]的研究均发现,Cu可造成谷子、大麦和玉米基因组DNA的多态性增加,增加量与Cu浓度存在剂量-效应关系。Mengoni等[36]的研究表明,Cu污染可以导致奇异花瓶草(Silene paradoxa L.)RAPD谱带的增加,且增加的2条谱带为Cu污染所特有的。解莉婧等[37]、詹振楠等[38]和刘宛等[39]的研究指出,Cd可造成蚕豆(Vicia faba)、拟南芥(Arabidopsis thaliana)和大麦(Hordeum vulgare)RAPD谱带的增加、缺失及荧光强度的改变,且基因组模板稳定性下降。本研究结果与上述现象类似,在HHCB胁迫条件下,萝卜幼苗根尖DNA含量明显降低,基因组模板稳定性下降,且有4条随机引物扩增得到的RAPD电泳图谱显示出明显的差异,即条带的减少或增加、荧光强度的减弱或增强。这些都表明HHCB胁迫对萝卜造成了非常严重的DNA损伤。而造成萝卜根尖基因组DNA损伤的可能原因如下:(1)由于基因组重排引起了寡核苷酸引发位点变化;(2)由于HHCB胁迫诱导了生物体细胞内与引物结合位点的DNA片段的断裂、插入、缺失或碱基突变等,使引物无法与结合位点匹配,进而引起DNA构象的改变,呈现出多态性,形成了新的RAPD电泳图谱[40-41];(3)由于在多拷贝引物结合位点上,某些位置的碱基发生了突变,导致结合量增加或减少,扩增的DNA量也随之变化,使RAPD谱带强度变化[42],最终导致幼苗根尖基因组模板的稳定性下降;(4)幼苗根尖细胞内的DNA聚合酶与受损伤的DNA相互作用,这些过程可能会降低或阻止PCR反应中旁路DNA片段的聚合。旁路聚合反应是非常复杂的过程,与DNA聚合酶活性、损伤DNA的结构及其序列等因素有关[39]。聚类分析结果表明,不同浓度HHCB处理组间遗传多样性存在一定的差异,HHCB的浓度对受试植物的遗传多样性具有一定的影响,且随着其浓度的升高,DNA损伤程度增大,其遗传相似性变远(图8)。该结果与萝卜幼苗的发芽生态毒性指标(发芽率、根伸长和芽伸长抑制率等)相一致,即HHCB对萝卜幼苗生长的显著抑制作用与其RAPD电泳图谱的变化之间存在良好的相关性,说明幼苗根尖大多数细胞中DNA损伤程度可能比较严重,HHCB亦影响基因组模板的稳定性。因此,利用RAPD分析植物DNA多态性变化可作为检测HHCB污染的敏感生物标记物。
此外,有研究也表明,HHCB污染胁迫能够引起蚯蚓体内活性氧自由基累积、脂质过氧化并导致内质网损伤[3]。而细胞内的活性氧若不及时清除,会对机体造成氧化胁迫,可与蛋白质、核酸和脂类作用,进而引起DNA损伤、酶失活、膜脂过氧化作用,甚至细胞死亡[43]。这可能是由于ROS几乎杂乱地与细胞内的组分发生反应[44],破坏蛋白质的结构,引起DNA断裂、降解及修饰,从而影响了DNA复制,进而造成DNA损伤。尹冬雪等[45]的研究表明:多环芳烃(PAHs)对拟南芥(Arabidopsis thaliana)的毒害主要是某种自由基的产生引发了氧化胁迫作用。HHCB是一类典型的疏水性有机污染物,与多环芳烃的理化性质具有一定的相似性,因此其所引起的毒害效应可能与多环芳烃相似,即HHCB通过对细胞造成氧化胁迫作用,进而引发一系列的生理生化毒性效应。为了深入探讨HHCB的生态毒性效应,有必要在分子水平上进一步明确其具体作用机制,探究在氧化胁迫中占主导因素的自由基类别,及HHCB胁迫诱导萝卜关键基因的响应机制和产生氧化胁迫的具体过程。
参考文献(References):
[1]Balk F, Ford R A. Environmental risk assessment for the polycyclic musks, AHTN and HHCB : II. Effect assessment and risk characterisation [J]. Toxicology Letters, 1999, 111(1-2): 81-94
[2]周启星, 王美娥, 范飞, 等. 人工合成麝香的环境污染、生态行为与毒理效应研究进展[J]. 环境科学学报, 2008, 28(1): 1-11
Zhou Q X, Wang M E, Fan F, et al. Research progress in environmental pollution, ecological behavior and toxicological effects of synthetic musks [J]. Acta Scientiae Circumstantiae, 2008, 28 (1): 1-11 (in Chinese)
[3]陈春, 刘潇威, 郑顺安, 等. 多环麝香污染胁迫对蚯蚓特异性蛋白基因表达的影响[J]. 环境科学, 2013, 34(5): 1857-1863
Chen C, Liu X W, Zhen S A, et al. Polycyclic musks exposure affect gene expression of specific protein in earthworm Eisenia fetida [J]. Environmental Science, 2013, 34(5): 1857-1863 (in Chinese)
[4]Sommer C. The role of musk and musk compounds in the fragrance industry [J]. The Handbook of Environmental Chemistry, 2004, 3: 1-16
[5]李卓娜, 周群芳, 刘稷燕, 等. 多环麝香(PCMs)的环境行为及毒性效应[J]. 化学进展, 2012, 1(4): 606-615
Li Z N, Zhou Q F, Liu J Y, et al. Environmental behavior and toxicological effects of polycyclic musks [J]. Progress in Chemistry, 2012, 1(4): 606-615 (in Chinese)
[6]Api A M, Smith R L, Pipino S, et al. Evaluation of the oral subchronic toxicity of AHTN (7-Acetyl-1,1,3,4,4,6-hexamethyl-1,2,3,4-tetrahydronaphthalene) in the rat [J]. Food and Chemical Toxicology, 2004, 42(5): 791-801
[7]Van D B B, Schreurs R, Van D L S, et al. Endocrine effects of polycyclic musks: Do we smell a rat? [J]. International Journal of Andrology, 2008, 31(2): 188-193
[8]郭亚文, 张晓岚, 钱光人, 等. 城市污泥中合成麝香的分布特征[J]. 环境科学, 2009, 30(5): 1493-1498
Guo Y W, Zhang X L, Qian G R, et al. Distribution character of synthetic musks in urban sewage sludges [J]. Environmental Science, 2009, 30(5): 1493-1498 (in Chinese)
[9]陈多宏, 胡学玲, 盛彦清, 等. 典型污水处理厂中多环麝香的污染特征[J]. 生态环境学报, 2009, 18(1): 101-105
Chen D H, Hu X L, Sheng Y Q, et al. The pollution character of polycyclic musks in a typical wastewater treatment plant [J]. Ecology and Environment Sciences, 2009, 18(1): 101-105 (in Chinese)
[10]Saraiva M, Cavalheiro J, Lanceleur L, et al. Synthetic musk in seafood products from south Europe using a quick, easy, cheap, effective, rugged and safe extraction method [J]. Food Chemistry, 2016, 200: 330
[11]Williams J G K, Kubelik A R, Livak K J, et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers [J]. Nucleic Acids Research, 1990, 18(22): 6531-6535
[12]Welsh J, Mcclelland M. Fingerprinting genomes using PCR with arbitrary primers [J]. Nucleic Acids Research, 1990, 18(24): 7213-7218
[13]高扬, 毛亮, 周培, 等. Cd, Pb污染下植物生长对土壤酶活性及微生物群落结构的影响[J]. 北京大学学报: 自然科学版, 2010, 46(3): 339-345
Gao Y, Mao L, Zhou P, et al. Effect of plant growth on soil enzyme activity and microbe community structure under Cd and Pb stress [J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2010, 46(3): 339-345 (in Chinese)
[14]Misra A, Chosdol K, Sarkar C, et al. Alteration of a sequence with homology to human endogenous retrovirus (HERV-K) in primary human glioma: Implications for viral repeat mediated rearrangement [J]. Mutation Research Aundamental & Molecular Mechanisms of Mutagenesis, 2001, 484(1-2): 53-59
[15]Garnis C, Rosin M P, Zhang L, et al. Alteration of AKAP220 , an upstream component of the Rb pathway, in oral carcinogenesis [J]. International Journal of Cancer, 2005, 116(5): 813-819
[16]Singh K P, Roy D. Somatic mutations in stilbene estrogen-induced Syrian hamster kidney tumors identified by DNA fingerprinting [J]. Journal of Carcinogenesis, 2004, 3(1): 4
[17]Singh K P, Roy D. Identification of novel breast tumor-specific mutation(s) in the q11.2 region of chromosome 17 by RAPD/AP-PCR fingerprinting [J]. Gene, 2001, 269(1-2): 33-43
[18]Miki Y, Hashiba M, Hisajima S. Establishment of salt stress tolerant rice plants through step up NaCl treatment in vitro [J]. Biologia Plantarum, 2001, 44(3): 391-395
[19]Chao Y E, Feng Y, Yang X E, et al. Effect of long-term stress of high Pb/Zn levels on genomic variation of Sedum alfredii Hance [J]. Bulletin of Environmental Contamination and Toxicology, 2008, 81(5): 445-448
[20]Liu W, Li P J, Qi X M, et al. DNA changes in barley (Hordeum vulgare) seedlings induced by cadmium pollution using RAPD analysis [J]. Chemosphere, 2005, 61(2): 158-167
[21]Liu W, Yang Y S, Li P J, et al. Risk assessment of cadmium-contaminated soil on plant DNA damage using RAPD and physiological indices [J]. Journal of Hazardous Materials, 2009, 161(2-3): 878-883
[22]Liu W, Sun L, Zhong M, et al. Cadmium-induced DNA damage and mutations in Arabidopsis plantlet shoots identified by DNA fingerprinting [J]. Chemosphere, 2012, 89(9): 1048-1055
[23]Gjorgieva D, Kadifkova P T, Ruskovska T, et al. Influence of heavy metal stress on antioxidant status and DNA damage in Urtica dioica [J]. Biomed Research International, 2013, 2013(1): 276-417
[24]Atienzar F A, Jha A N. The random amplified polymorphic DNA (RAPD) assay and related techniques applied to genotoxicity and carcinogenesis studies: A critical review [J]. Mutation Research Aundamental and Molecular Mechanisms of Mutagenesis, 2006, 613(2-3): 76-102
[26]Rong Z, Yin H. A method for genotoxicity detection using random amplified polymorphism DNA with Danio rerio [J]. Ecotoxicology & Environmental Safety, 2004, 58(1): 96-103
[27]范飞. 土壤环境中人工合成麝香的生态行为及效应研究[D]. 北京:中国科学院研究生院, 2008: 11
Fan F. Ecotoxical behavior and effects of synthetical musks in burozem [D]. Beijing: Graduate School of Chinese Academy of Sciences, 2008: 11 (in Chinese)
[28]陈苏, 孙丽娜, 孙铁珩, 等. 人工合成麝香对小麦种子发芽的生态毒性[J]. 环境科学, 2011, 32(5): 1477-1481
Chen S, Sun L N, Sun T H, et al. Ecotoxicity of synthetical musks on wheat (Triticum aestivum) based on seed germination [J]. Environmental Science, 2011, 32(5): 1477-1481 (in Chinese)
[29]Atienzar F A, Cordi B, Donkin M E, et al. Comparison of ultraviolet-induced genotoxicity detected by random amplified polymorphic DNA with chlorophyll fluorescence and growth in a marine macroalgae, Palnaria palnata [J]. Aquatic Toxicology, 2000, 50(1-2): 1-12
[30]范飞, 周启星, 王美娥. 基于小麦种子发芽和根伸长的麝香酮污染毒性效应[J]. 应用生态学报, 2008, 19(6): 1396-1400
Fan F, Zhou Q X, Wang M E. Toxic effect of musk ketone based on the determinations of wheat (Triticum aestivum) seed germination and root elongation [J]. Chinese Journal of Applied Ecology, 2008, 19(6): 1396-1400 (in Chinese)
[31]张保仁, 崔英, 孟明占. 镉硒互作对萝卜种子发芽和幼苗生长的影响[J]. 潍坊学院学报, 2011, 11(6): 68-72
Zhang B R, Cui Y, Meng M Z. Effect of cadmium and selenium on germination and seedling growth of radish seed [J]. Journal of Weifang University, 2011, 11(6): 68-72 (in Chinese)
[32]Liu X, Zhang S, Shan X, et al. Toxicity of arsenate and arsenite on germination, seedling growth and amylolytic activity of wheat [J]. Chemosphere, 2005, 61(2): 293-301
[33]Song Y F, Zhou Q X, Xu H X, et al. Eco-toxicology of heavy metals on the inhibition of seed germination and root elongation of wheat in soils [J]. Chinese Journal of Applied Ecology, 2002, 13(4): 459-462
[34]张义贤, 付亚萍, 肖志华, 等. 铜胁迫对不同基因型谷子幼苗基因组DNA多态性的影响[J]. 环境科学, 2013, 34(10): 4090-4095
Zhang Y X, Fu Y P, Xiao Z H, et al. Effect of Cu2+stress on DNA polymorpphism of genome in Foxtail millet of different genotypes [J]. Environmental Science, 2013, 34(10): 4090-4095 (in Chinese)
[35]齐雪梅, 李培军, 刘宛. Cu胁迫对大麦幼苗生长及DNA 损伤效应的研究[J]. 农业环境科学学报, 2008, 27(5): 1925-1928
Qi X M, Li P J, Liu W. Plantlets growth and DNA damage of barley (Hordeum valgare L) under copper stress [J]. Journal of Agro-Environment Science, 2008, 27(5): 1925-1928 (in Chinese)
[36]Mengoni A, Gonnelli C, Galardi F, et al. Genetic diversity and heavy metal tolerance in population of Silene paradoxa L. (Caryophyllaceae): A random amplified polymorphic DNA analysis [J]. Molecular Ecology, 2000, 9(9): 1319-1324
[37]解莉婧, 刘宛, 李培军, 等. 隔胁迫对蚕豆幼苗基因组DNA多态性的影响[J]. 生态学杂志, 2007, 26(1): 35-39
Xie L J, Liu W, Li P J, et al. Effect of cadmium stress on DNA polymorphism of genome in Vicia faba seedlings [J]. Chinese Journal of Ecology, 2007, 26(1): 35-39 (in Chinese)
[38]詹振楠, 刘宛, 孙梨宗, 等. 镉胁迫对拟南芥幼苗基因组DNA 多态性的影响[J]. 生态学杂志, 2011, 30(6): 1234-1239
Zhan Z N, Liu W, Sun L Z, et al. Effect of cadmium stress on DNA polymorphism of genome in Arabidopsis thaliana seedlings [J]. Chinese Journal of Ecology, 2011, 30(6): 1234-1239 (in Chinese)
[39]刘宛, 郑乐, 李培军, 等. 镉胁迫对大麦幼苗基因组DNA 多态性影响[J]. 农业环境科学学报, 2006, 25(1): 19-24
Liu W, Zheng L, Li P J, et al. Effect of cadmium stress on DNA polymorphism of genome in barley seedlings [J]. Journal of Agro-Environment Science, 2006, 25(1): 19-24(in Chinese)
[40]孙梨宗, 刘宛, 马珊珊, 等. 镉诱导拟南芥幼苗DNA损伤[J]. 生态学杂志, 2012, 31(9): 2337-2343
Sun L Z, Liu W, Ma S S, et al. Cadmium-induced DNA damage of Arabidopsis seedlings [J]. Chinese Journal of Ecology, 2012, 31(9): 2337-2343 (in Chinese)
[41]李慧, 丛郁, 王宏伟, 等. 镉对草莓幼苗根尖氧化系统和基因组DNA损伤的影响[J]. 园艺学报, 2010, 37(5): 721-730
Li H, Cong Y, Wang H W, et al. Effects of cadmium stress on oxygen enzyme system and genome DNA polymorphism in the root tips of strawberry plants [J]. Acta Horticulturae Sinica, 2010, 37(5): 721-730 (in Chinese)
[42]Jones C, Kortenkamp L. RAPD library fingerprinting of bacterial and human DNA: Applications in mutation detection [J]. Teratogenesis, Carcinogenesis, and Mutagenesis, 2000, 20(2): 49-63
[43]马俊旭, 朱大海. 植物超氧化物歧化酶(SOD)的研究进展[J]. 遗传, 2003, 25(2): 225-231
Ma J X, Zhu D H. Functional roles of plant superocide dismutase [J]. Hereditas(Beijing), 2003, 25(2): 225-231 (in Chinese)
[44]Berlett B S, Stadtman E R. Protein oxidation in aging, disease, and oxidative stress [J]. Journal of Biological Chemistry, 1997, 272(33): 20313-20316
[45]尹冬雪, 苏玉红, 乔敏. 多环芳烃芘对拟南芥的生物毒性效应[J]. 安徽农业科学, 2011, 39(23): 818-822
Yin D X, Su Y H, Qiao M. Bio-toxicity effect of polycyclic aromatic hydrocarbons pyrene on Arabidopsis thaliana [J]. Journal of Anhui Agricultural Sciences, 2011, 39(23): 818-822 (in Chinese)

