面向人体暴露评价的植物中抗生素分析进展
杨晓静,薛伟锋,陈溪,田润,乔显亮,*
1. 大连理工大学环境学院,工业生态与环境工程教育部重点实验室,大连 100624 2. 大连出入境检验检疫局检验检疫技术中心,庄河116400
抗生素是一类对细菌、真菌、支原体、衣原体等致病微生物具有抑制或杀灭作用的天然、半合成或完全人工合成的药物,按其化学结构可以分为磺胺类、喹诺酮类、四环素类、大环内酯类和β-内酰胺类等。抗生素因具有预防和治疗疾病、促进生长的作用,被广泛应用于人类和动物医疗和牲畜饲养业[1]。抗生素进入人体或动物体后仅有一小部分被吸收,约有10%~90%以原药形式随着动物粪便排放到环境中[2]。另外,抗生素在城市污水处理系统中,一般去除效果并不理想,导致部分抗生素随出水或者污泥排放进入到环境中[3]。目前,已在土壤[4-6]、沉积物[6]和地表水[7-8]等多种环境介质中检出抗生素。抗生素最受关注的生态环境效应是能够导致抗性基因和抗性细菌的产生[9]。近些年,已经在土壤、沉积物和地表水中检测到磺胺类、β-内酰胺类、四环素类、氯霉素和大环内酯类等多种抗生素的抗性基因[9-10]。目前,国内外一系列研究表明,很多农作物可以从土壤中吸收抗生素,会导致人体的低剂量被动暴露,引起较广泛的关注和研究。
1 植物对土壤中抗生素的吸收(Uptake of antibiotics by plants from soils)
土壤是环境中抗生素重要的汇。在农业生产中,动物粪便和市政污泥被作为有机肥施用以及再生水灌溉,是抗生素进入土壤中的主要途径[11-13]。我国是世界上抗生素生产和使用第一大国,据估计,仅2013年抗生素使用总量就达16.2万吨,对于最常使用的36种抗生素,其随动物和人体排泄的总量达5.4万吨[14]。其中,畜禽粪便中不少抗生素浓度在mg·kg-1水平,一些区域的畜禽粪便中抗生素浓度高达几十到几百mg·kg-1[15-16]。我国不少区域的土壤中存在抗生素包括磺胺类、四环素类和喹诺酮类等检出,其浓度在μg·kg-1至mg·kg-1(干重)水平[4-5, 17]。如Hu等[18]在施加畜禽粪便的土壤中,检测出抗生素浓度为0.1~2.683 mg·kg-1。土壤是农业生产最重要的介质和载体。植物在土壤中除了吸收需要的养分,也会吸收共存的污染物。目前,国内外一系列研究表明,不少农作物可以从土壤中吸收抗生素。前人已考察了多种植物(如生菜、菠菜、芹菜、萝卜、番茄和黄瓜等)对最常用的几类抗生素(磺胺类、喹诺酮类、四环素类和大环内酯类)的吸收[18-22]。研究结果表明,植物吸收抗生素受植物种类、抗生素理化性质(如正辛醇水分配系数Kow和解离常数pKa等)、培养介质以及暴露浓度等多个因素的影响。
与疏水性化合物不同,大多数抗生素属于可电离化合物,有2个或多个pKa值,使其在不同的pH条件下能够以阴离子、阳离子或者两性离子存在[21, 23]。不同形态的抗生素,其化学属性差异很大,与生物膜的作用机制也存在差异,因此也会影响其植物吸收的过程[24-25]。表1中列举了一些植物吸收抗生素的研究。一般实验室模拟条件下抗生素的暴露水平较高,造成植物中抗生素浓度也较高。例如,Ahmed等[19]研究发现,磺胺类抗生素暴露浓度为20 mg·kg-1时,番茄根部中磺胺甲恶唑的积累浓度可达34 mg·kg-1。但是,在接近实际环境水平下对植物进行暴露,植物吸收抗生素的浓度水平一般较低,检出水平为μg·kg-1[12, 18, 27]。Hu等[18]研究了畜禽养殖场粪便施加于土壤中,油菜、芹菜、香菜和胡萝卜对11种抗生素的吸收,结果表明,植物中土霉素和四环素的浓度分别为76.8和79.3 μg·kg-1,其他抗生素浓度都小于10 μg·kg-1。我国既是农业大国,又是抗生素使用大国,农业生产中普遍将畜禽粪便作为有机肥使用到农田,使我国土壤中的抗生素污染问题非常严峻,植物吸收可能引起的抗生素人体暴露问题非常值得关注和研究。
2 植物中抗生素的分析方法 (Analytical procedure of antibiotics in plants)
为了评估抗生素在植物中的积累所引发的人类健康风险问题,建立植物样品中抗生素的分析方法十分必要。植物样品中抗生素的分析,与其他环境样品如土壤[6, 28]、污泥[29]、沉积物[6]、粪便[28]和地表水[30]等的抗生素分析既相似,又存在一些区别。目前,关于植物样品中抗生素的分析(见表2),一些是专门针对抗生素构建的方法,还有一些方法旨在分析多种药物和个人护理用品(Pharmaceutical and Personal Care Products, PPCPs),其中涵盖一些抗生素,这类方法的分析条件和参数并非针对抗生素确定和优化[35-36]。本文对目前植物样品中抗生素的分析研究进行了综述,结合植物样品中抗生素的主要分析流程(见图1),重点介绍了样品的提取、净化和仪器分析等方面的研究进展。
2.1 样品准备
植物样品采集方式取决于实验目的,可以整棵植株采集处理[18],也可以将植株分成不同部位(如根、茎、叶和果实等)分别保存处理[11, 37]。用于分析的样品可以选择鲜样或冻干。一些研究中选择鲜样,直接破碎或加入提取剂后破碎混匀,进行样品前处理[26, 38]。对于短期内不能处理的样品,多数采用真空冷冻干燥处理,然后研磨成粉[12, 37],-4 ℃~-20 ℃条件下保存[11-12, 37]。

表1 植物吸收抗生素的研究Table 1 Studies of antibiotics accumulation in plants
注: a, ND,未检出;b, 富集系数为植物组织中抗生素浓度与土壤中抗生素浓度比值;c, 该富集系数为植物组织中抗生素浓度与灌溉水中浓度比值。
Note: a, ND, not detected; b, Bioconcentration factor is the ratio of antibiotic concentration in plant tissue to the concentration in soils; c, Bioconcentration factor is the ratio of antibiotic concentration in plant tissue to the concentration in irrigation water.
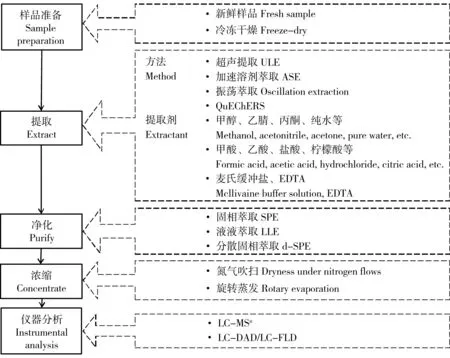
图1 植物中抗生素分析的一般流程Fig. 1 General procedure of antibiotics analysis in plants
2.2 样品前处理
样品前处理的目的是将待测组分从样品基质中分离出来,以进行仪器分析。前处理的主要作用包括将目标化合物从样品中提取出来、除去样品中的干扰杂质、将待测组分转换为可检测的状态、达到可检测的浓度范围和溶于可进行分析的溶剂。由于植物组织中叶绿素、油脂及蜡质等物质的存在可能导致严重的基质干扰,相对于从其他环境介质,从植物组织中提取分析抗生素具有更大的挑战性。一般来说,植物样品前处理过程主要包括以下内容:提取、净化和浓缩。样品前处理方法必须考虑待测组分的理化性质,样品基质中主要的干扰物、处理方法对抗生素稳定性的影响与后续测定方法的衔接等因素。
2.2.1样品提取
提取的目的是最大可能地将目标化合物从基质中分离出来,进入到提取剂溶液中,同时尽量避免或减少基质中干扰物质的提取。目前,国内外对植物样品中抗生素的提取方法主要有超声提取法、加速溶剂萃取法、QuEChERS法、振荡萃取法和冻融裂解法等[18, 20, 32, 34-36, 39]。
多数抗生素的结构中包含极性较强的官能团,因此,常采用极性溶剂,如甲醇、乙腈、丙酮、水或几种试剂的混合物等作为提取剂。Chuang等[32]比较了不同比例的乙腈、甲醇和水的混合物对植物中11种化合物(包括7种抗生素)的提取,结果表明,当三者比例为46:25:29时,所有目标化合物的回收率均在70%以上,相对标准偏差都小于20%。除了甲醇和乙腈被作为常用的提取剂,也有研究利用极性较大的丙酮作为提取剂,来提升提取效率[12, 18, 39]。不少抗生素含有碱性或酸性基团,有2个或2个以上pKa值,受环境pH影响可以呈现出不同的离子形态,当化合物处于不带电状态时,可以增加其进入到溶剂的几率,因此在提取剂中常加入适量的酸(盐酸或甲酸等)或盐(麦氏缓冲盐Mcllvaine等)以提高目标化合物的提取效率。Lillenberg等[40]分析污泥中7种抗生素(包含喹诺酮类、四环素类和磺胺类),以甲醇、乙腈的水溶液作为提取剂时,多数抗生素的回收率较低,当在提取液中加入磷酸和柠檬酸后,提取效率有所提高。由于一些抗生素(如四环素类抗生素)可以与金属离子螯合形成络合物,在提取剂中需要添加络合剂(如EDTA)等[41]。Chitescu等[35]采用超声提取植物中抗生素时,发现提取剂中添加Na2EDTA后,之前未被检出的土霉素、双氯青霉素、红霉素都被检出。值得注意的是,在酸性条件下利用加速溶剂萃取提取目标化合物时,EDTA可能会析出并堵塞管路,可以采用柠檬酸或草酸等络合剂代替[6, 35]。
目前,超声提取法(Ultrasonic Liquid Extraction, ULE)和加速溶剂萃取法(Accelerated Solvent Extraction, ASE)是抗生素分析中应用较为广泛的提取方法(见表2)。超声提取法是利用超声波振动来使样品和溶剂充分接触,具有萃取效率高、费时少和易操作的特点。如Hu等[18]利用超声提取植物中抗生素,回收率均大于71%。提取液用量过少或提取时间较短,可能导致提取不完全,回收率偏低,而使用过多的提取液或提取时间过长,则可能导致提取的杂质较多,干扰大,影响抗生素回收率[42]。
加速溶剂萃取法,又称加压溶剂萃取法(Pressurized Liquid Extraction, PLE),是通过高温高压条件提高化合物从固相样品进入到有机溶剂中的提取方法,因其有机溶剂用量少,操作方便,快速且结果可重复性高等优点,被广泛应用于环境样品的提取分析。表2列举了采用加速溶剂萃取法提取植物中抗生素的部分研究。采用加速溶剂萃取法提取植物中抗生素,可以通过调整提取参数,包括样品量、提取剂组成、pH、温度、压力、时间、静态萃取时间和循环次数等,提高目标物的回收率[6, 29, 35, 40]。一般情况下,升高温度可以增加化合物在溶剂中的溶解,增加萃取时间也可以提高目标化合物的提取效率。然而,Chitescu等[35]发现过度的高温和过长的提取时间会使样品基质中的杂质更多地进入到提取液中,影响后续净化或分离检测。此外,高温容易造成一些目标化合物的热降解,从而影响提取效率[24, 29]。有研究在萃取池中加入一定的净化材料如佛罗里硅土(Fluorosil)和氧化铝等,在萃取同时进行样品的净化[20]。
振荡提取法是早期提取植物中抗生素采用的方法,其原理是通过振荡方式使样品和溶剂充分接触,增加目标化合物从样品进入到提取剂的效率。Migliore等[39]先后以甲醇/盐酸和丙酮为提取剂,手动振荡提取了大麦中磺胺间二甲氧嘧啶,回收率大于80%。虽然振荡提取操作简单、易于实现,但是当提取多种目标化合物时,其效果不如超声提取法或加速溶剂萃取法[43]。QuEChERS方法是一种新型的可用于有机物分析的前处理方法,因具有快速(Quick)、简单(Easy)、廉价(Cheap)、有效(Effective)、耐用(Rugged)和安全(Safe)的特点而得名,其原理是在一些盐分存在条件下,利用极性溶剂提取样品中化合物,同时通过分散固相萃取(d-SPE)对样品进行净化,是一种集提取净化于一体的分析方法。QuEChERS方法主要被应用在提取农作物产品中的农药残留分析,近年来经改进后被应用于环境样品(如动物[44]、土壤[45]以及植物[32])中的抗生素检测。Chuang等[32]应用QuEChERS方法对芹菜中的11种化合物(包含7种抗生素)进行提取,加标浓度为200 μg·kg-1时,回收率为70.1%~118.6%。冻融细胞裂解法(Freeze-and-thaw Cell Lysing)是对新鲜样品进行冷冻和溶解,使植物细胞破裂,释放出内含物的提取方法。Sallach等[34]利用冻融细胞裂解法,以异丙醇/缓冲溶液作为提取液,提取生菜中的林可霉素、环丙沙星、土霉素和磺胺甲恶唑4种抗生素,其回收率为43%~139%。
2.2.2净化与浓缩
植物组织中含有大量的叶绿素、油脂和蜡质材料等,可以随着目标化合物被提取剂所提取,继而影响后续检测分析,甚至会影响仪器的运行[20, 24]。对提取液进行净化,不仅能够减少基质效应,提高检测灵敏度,保证较高回收率,也能延长色谱柱寿命。目前,常用的净化方法有固相萃取技术(Solid Phase Extraction, SPE)和液液萃取技术(Liquid Liquid Extraction, LLE)等。
SPE是利用固体吸附剂将液体样品中的目标化合物吸附,使样品的基质和干扰化合物分离,然后再用洗脱液洗脱,达到分离和富集目标化合物的目的。该方法大大增强了对分析物的检出能力,提高了被测样品的回收率。SPE最初被应用于水中污染物的浓缩[30],后来逐渐应用于固体样品如污泥[40]、粪便[28]、土壤[28]和植物[12, 18, 26]中抗生素的净化,是目前抗生素分析中最广泛的净化技术[46]。亲水亲脂平衡柱(Hydrophilic Lipophilic Balanced, HLB)的填料为N-乙烯基吡咯烷酮和二乙烯苯的共聚物,是目前应用较广的固相萃取柱,对亲水和疏水化合物都有较强的保留能力,可以在较宽的pH范围内萃取酸性、中性和碱性目标物[46]。由于pH可以影响抗生素的电离形态,从而影响抗生素在SPE柱上的保留,因此,通过调节样品溶液的pH,可以提高富集净化能力[6, 40]。目标化合物与吸附剂接触的时间对富集净化有重要影响。流速过快容易使目标化合物与吸附剂接触不充分而造成损失,多数研究中进样速度控制在1~3 mL·min-1[19, 31, 33]。抗生素分析中多采用甲醇作为SPE的洗脱剂,用量一般为2.5~10 mL[12, 19, 26]。
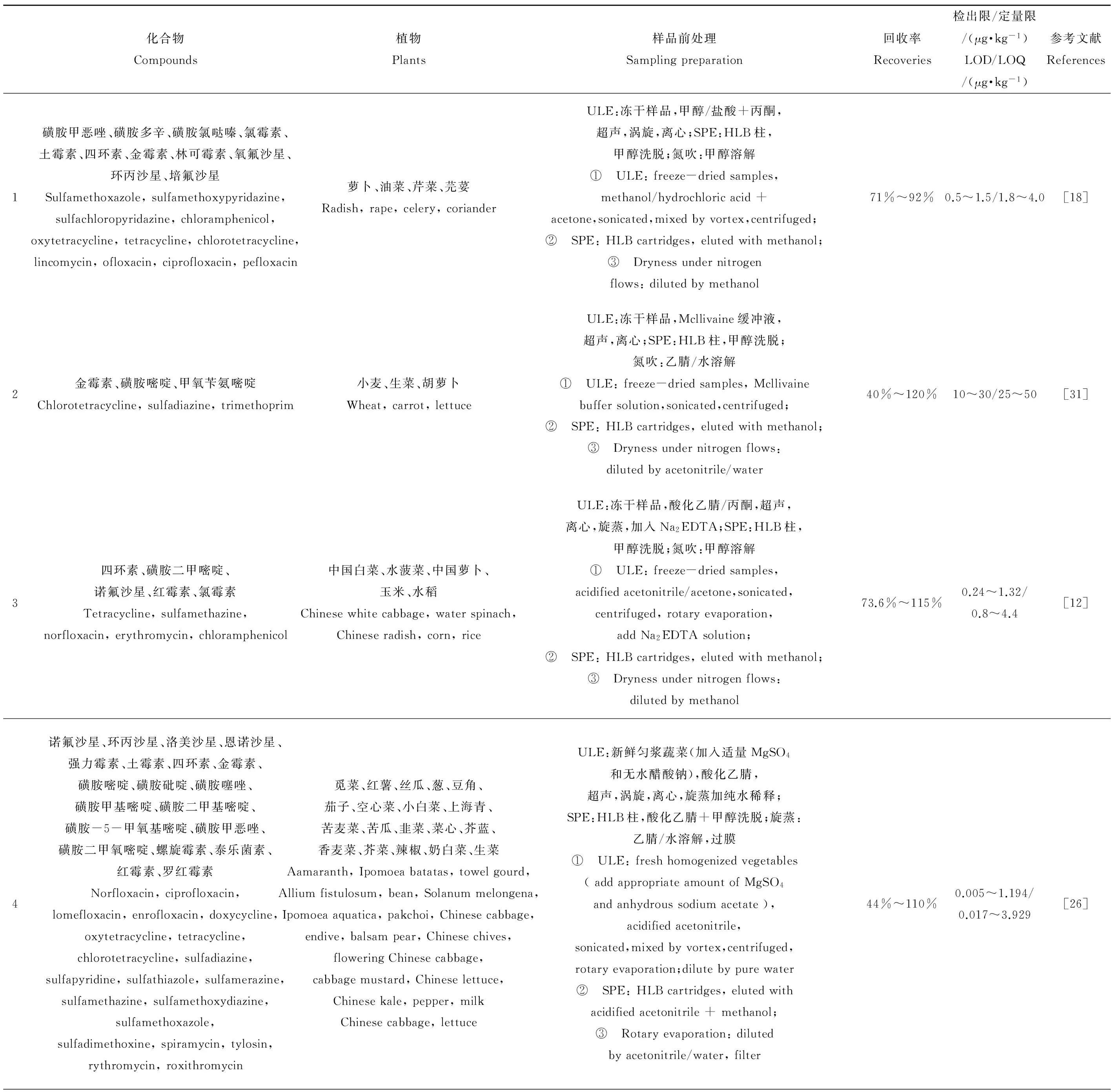
表2 植物中抗生素的分析检测方法Table 2 Analytical methods of antibiotics in plant tissues
注:表格中所列研究都是利用LC-MS/MS检测。LOD为检出限,LOQ为定量限。
Note: All the studies listed in this table are the results using LC-MS/MS. LOD stands for limit of detection; LOQ stands for limit of quantitation.
LLE是利用化合物在不相溶的溶剂中溶解度的不同,使目标化合物从溶解度低的溶剂中进入到高溶解度溶剂中的净化方法。前人研究中以己烷作溶剂,利用LLE方法去除疏水性杂质[20, 39]。但是,当分析中包含疏水性的目标物时,该方法需谨慎使用。QuEChERS方法中可以利用分散固相萃取(d-SPE)对提取物进行净化,N-丙基二乙胺(Primary Secondary Amine, PSA)是较常用的吸附剂,同时也可以利用C18和石墨化炭黑(GCB)等作为进一步的净化材料[32, 47]。Chuang等[32]利用QuEChERS方法,提取生菜和芹菜中的11种PPCPs时以d-SPE(其中,C18: 12.5 mg;PSA: 12.5 mg和Na2SO4: 225 mg)对提取液进行了净化。另外,加速溶剂萃取过程中,在萃取池中加入适当的吸附剂(如佛罗里硅土和氧化铝等),也可以在一定程度上实现样品的净化[20]。
抗生素分析中常用的浓缩方法为氮气吹扫和旋转蒸发(见表2)[12, 18, 20, 26]。氮气吹扫利用氮气流将溶剂带出,一般在低温加热条件下进行,该方法多用于少量液体的浓缩。旋转蒸发的浓缩速度相对较快,且溶剂可回收。
2.3 仪器分析
目前,对植物中抗生素的分析检测方法有液相色谱串联质谱联用(HPLC-MSn)、酶联免疫法(Enzyme Linked Immunosorbent Assay, ELISA)、液相色谱-紫外/二极管阵列检测器(HPLC-UV/DAD)和液相色谱-荧光检测器(HPLC-FLD)。HPLC-UV/DAD或HPLC-FLD是较早用来分离检测抗生素的方法[39, 48-49]。由于基质效应的存在,紫外或荧光检测有时会受到严重的干扰,而且灵敏度也不高,目前已经逐渐被HPLC-MSn所替代[50]。ELISA是把抗原抗体的免疫反应和酶的高效催化作用原理有机地结合起来的一种经济、快速检测技术,在植物中抗生素的检测也有应用[27, 51-52]。尽管ELISA对特定抗生素的检测可以实现快速筛查,但是由于其提取剂较温和,会影响抗生素的提取效率和分析的准确性[13, 46]。近年来,高效液相色谱-串联质谱联用(LC-MSn)技术发展迅速,因其灵敏度高、选择性强等优点逐渐成为检测环境基质中目标化合物的主流方法。基于三重四级杆的分析质谱(QqQ)是目前分析环境中抗生素应用最广泛的检测仪器,其具有较高的灵敏度、选择性和特异性,多反应检测(MRM)模式有效降低了分析中的干扰,为痕量分析提供了较好的选择性。
在抗生素分析中,C18柱是较常用的色谱柱[18, 26, 33],选择的流动相一般为甲醇或乙腈的有机相以及缓冲体系的水相两类,在流动相中加酸(如甲酸、乙酸等),可以改善色谱柱的分析和离子化效应[28]。进样溶剂也会影响色谱峰形。Ho等[28]分析9种抗生素时,比较了几种溶剂对色谱峰的影响,发现初始流动相作为溶剂时,分析物目标峰形较好。
抗生素分析中电喷雾离子化(ESI)是最常用的离子化方式,ESI易受到样品基质的干扰,导致目标化合物信号抑制或增强,从而影响检测结果的准确性,其中正离子模式一般比负离子模式表现出更强的基质效应[20, 43]。Wu等[36]在分析生菜中的19种PPCPs时发现,植物基质显著抑制对乙酰氨基酚(acetaminophen)的分析信号,使其无法准确分析;同时还发现,甲氧苄氨嘧啶在芹菜中回收率为50.6%,而在番茄中回收率仅有17.9%,说明对于同一目标物不同植物的基质效应差别很大。对于不同的目标化合物,植物的基质效应也不同。Jones-lepp等[20]采用加速溶剂萃取法从生菜等蔬菜中提取克拉霉素、阿奇霉素、罗红霉素和克林霉素时,由于样品的基质效应,目标物的回收率差异显著(2%~76%)。
对于环境样品的基质效应,一般无法彻底去除,但可以采取一些方法或措施来减小或校正。有效的样品净化措施,如固相萃取、液液萃取等,可以从样品中去除一部分的杂质,一定程度上减少基质效应[18, 20, 36]。其次,基质匹配法也可以校正基质干扰,即利用与样品基质成分尽可能一致的溶液配制标准曲线,从而校准基质效应带来的误差[53]。内标法也是校准基质效应较为有效的措施。Wu等[36]在分析7种蔬菜中PPCPs时,采用与目标物对应的氘代化合物作为回收率替代物,校正前回收率为2.5%~107.9%,校正后的回收率提升为56.3%~129.6%。同位素标记试剂价格昂贵,且并不是所有化合物都有相对应的标记试剂,因此在多数实验中都是采用一种或几种标记试剂作为回收率指示剂[11, 38]。Herklotz等[38]在分析卷心菜等蔬菜中的PPCPs时,通过在样品中同时添加13C和15N标记的卡马西平和目标物标样对基质效应进行校正,回收率可提升到>70%。
高分辨质谱主要包括飞行时间质谱(TOF)、四级杆-飞行时间质谱串联仪(Q-TOF)和轨道离子阱质谱(Orbitrap)等,因其可提供母离子和大量的多级碎片离子的精确质量以供结构鉴定,从而实现复杂基质中目标物的定性和定量。目前,高分辨质谱已经成功应用于环境样品中抗生素及其代谢产物的测定,如Hoff等[54]利用Orbitrap分离和鉴定了动物组织中磺胺喹喔啉的代谢产物。Perez-Parada等[55]利用Q-TOF鉴定了废水和地表水中阿莫西林及其代谢产物。前人研究表明,植物可以吸收抗生素的代谢产物或者被吸收的抗生素在植物体内可以代谢[56-57]。采用高分辨质谱对植物样品中抗生素代谢产物的定性和定量,可以更全面地评价抗生素对人体的暴露风险。
3 展望 (Prospect)
关于植物吸收抗生素的研究中,多数是在土壤中添加一定量抗生素标准品,或灌溉含有抗生素的再生水,或向土壤中施加含有抗生素的生物固体等,而关于实际农业生产条件下植物吸收抗生素的研究较少。今后的研究应该更关注田间实际生产条件下植物对抗生素的吸收研究,以更准确地评估抗生素通过食物链对人体的暴露风险。
从已有的研究可以看出,植物可以从培养基质中吸收包括磺胺类、喹诺酮类、四环素类、氯霉素类、β-内酰胺类和大环内酯类等多类抗生素。但目前关于植物中抗生素的分析方法中,包含抗生素的种类偏少,如一些方法中,仅选择性地包含了几种或者几类抗生素,方法的适用面较窄[32, 35-36]。另外,已有研究表明,田间条件下植物对抗生素的吸收浓度较低,一般为μg·kg-1水平。在开发植物中抗生素的分析方法时,需要在实际环境样品浓度水平下,开发包括多类抗生素的综合方法,以提高分析的效率和准确性。
当研究的目标物同时包含一些非离子型PPCPs类化合物时,要综合考虑化合物结构和理化性质的差异,针对目标物的性质来选择合适的提取剂和提取方法,有时可以采取多种提取剂分步组合的方法,来提高目标化合物的提取效率。虽然HLB是目前采用较多的固相萃取柱,考虑到PPCPs化合物结构和性质的广泛性,以及植物样品包含较多色素等物质的特点,需要进一步开发新型的净化材料和固相萃取柱,以更好的支撑植物样品的分析。
抗生素及PPCPs在植物体内可以被代谢生成产物,以往的分析方法中对代谢产物的检测分析研究较少。为了全面、准确地评估人类通过食物摄食的暴露风险,需要加强对抗生素及PPCPs代谢产物的研究。高分辨质谱分析技术的发展为分析植物中化合物的代谢产物提供了技术支撑,需要进一步开发相应的分析方法。
参考文献(References):
[1]Kümmerer K. Antibiotics in the aquatic environment—A review - part I [J]. Chemosphere, 2009, 75: 417-434
[2]Kumar K, Gupta S C, Chander Y, et al. Antibiotic use in agriculture and its impact on the terrestrial environment [J]. Advances in Agronomy, 2005, 87(5): 1-54
[3]Michael I, Rizzo L, Mcardell C S, et al. Urban wastewater treatment plants as hotspots for the release of antibiotics in the environment: A review [J]. Water Research, 2013, 47(3): 957-995
[4]Guo X Y, Hao L J, Qiu P Z, et al. Pollution characteristics of 23 veterinary antibiotics in livestock manure and manure-amended soils in Jiangsu Province, China [J]. Journal of Environmental Science and Health, Part B, 2016, 51(6): 383-392
[5]Li Y W, Wu X L, Mo C H, et al. Investigation of sulfonamide, tetracycline, and quinolone antibiotics in vegetable farmland soil in the Pearl River Delta area, Southern China [J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 7268-7276
[6]Vazquez-Roig P, Segarra R, Blasco C, et al. Determination of pharmaceuticals in soils and sediments by pressurized liquid extraction and liquid chromatography tandem mass spectrometry [J]. Journal of Chromatography A, 2010, 1217(16): 2471-2483
[7]Luo Y, Xu L, Rysz M, et al. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River basin, China [J]. Environmental Science and Technology, 2011, 45(5): 1827-1833
[8]Zhou L J, Ying G G, Liu S, et al. Simultaneous determination of human and veterinary antibiotics in various environmental matrices by rapid resolution liquid chromatography-electrospray ionization tandem mass spectrometry [J]. Journal of Chromatography A, 2012, 1244(12): 123-138
[9]Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(9): 3435-3440
[10]Pruden A, Pei R, Storteboom H, et al. Antibiotic resistance genes as emerging contaminants: Studies in Northern Colorado [J]. Environmental Science & Technology, 2006, 40(23): 7445-7450
[11]Azanu D, Mortey C, Darko G, et al. Uptake of antibiotics from irrigation water by plants [J]. Chemosphere, 2016, 157: 107-114
[12]Pan M, Wong C K C, Chu L M. Distribution of antibiotics in wastewater-irrigated soils and their accumulation in vegetable crops in the Pearl River Delta, Southern China [J]. Journal of Agricultural and Food Chemistry, 2014, 62(46): 11062-11069
[13]Dolliver H, Kumar K, Gupta S. Sulfamethazine uptake by plants from manure-amended soil [J]. Journal of Environmental Quality, 2007, 36(4): 1224-1230
[14]Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science and Technology, 2015, 49(11): 6772-6782
[15]Zhao L, Dong Y H, Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China [J]. Science of the Total Environment, 2010, 408(5): 1069-1075
[16]Chen Y S, Zhang H B, Luo Y M, et al. Occurrence and assessment of veterinary antibiotics in swine manures: a case study in East China [J]. Chinese Science Bulletin, 2012, 57(6): 606-614
[17]Wu X L, Xiang L, Yan Q Y, et al. Distribution and risk assessment of quinolone antibiotics in the soils from organic vegetable farms of a subtropical city, Southern China [J]. Science of the Total Environment, 2014, 487(1): 399-406
[18]Hu X, Zhou Q, Luo Y. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, Northern China [J]. Environmental Pollution, 2010, 158(9): 2992-2998
[19]Ahmed M B M, Rajapaksha A U, Lim J E, et al. Distribution and accumulative pattern of tetracyclines and sulfonamides in edible vegetables of cucumber, tomato and lettuce [J]. Journal of Agricultural and Food Chemistry, 2015, 63(2): 398-405
[20]Jones-lepp T L, Sanchez C A, Moy T, et al. Method development and application to determine potential plant uptake of antibiotics and other drugs in irrigated crop production systems [J]. Journal of Agricultural and Food Chemistry, 2010, 58(22): 11568-11573
[21]Hawker D W, Cropp R, Boonsaner M. Uptake of zwitterionic antibiotics by rice (Oryza sativa L.) in contaminated soil [J]. Journal of Hazardous Materials, 2013, 263: 458-466
[22]Tanoue R, Sato Y, Motoyama M, et al. Plant uptake of pharmaceutical chemicals detected in recycled organic manure and reclaimed wastewater [J]. Journal of Agricultural and Food Chemistry, 2012, 60(41): 10203-10211
[23]Qiang Z, Adams C. Potentiometric determination of acid dissociation constants (pKa) for human and veterinary antibiotics [J]. Water Research, 2004, 38(12): 2874-2890
[24]Wu X, Dodgen L K, Conkle J L, et al. Plant uptake of pharmaceutical and personal care products from recycled water and biosolids: A review [J]. Science of the Total Environment, 2015, 536: 655-666
[25]Miller E L, Nason S L, Karthikeyan K G, et al. Root uptake of pharmaceuticals and personal care product ingredients [J]. Environmental Science and Technology, 2016, 50(2): 525-541
[26]段夏珍. 惠州市蔬菜基地抗生素污染特征的初步研究[D]. 广州: 暨南大学, 2011: 27-53
Duan X Z. The preliminary studies on pollution characteristies of antibiotics from Huizhou vegetable base [D]. Guangzhou: Jinan University, 2011: 27-53 (in Chinese)
[27]Kang D H, Gupta S, Rosen C, et al. Antibiotic uptake by vegetable crops from manure-applied soils [J]. Journal of Agricultural and Food Chemistry, 2013, 61(42): 9992-10001
[28]Ho Y B, Zakaria M P, Latif P A, et al. Simultaneous determination of veterinary antibiotics and hormone in broiler manure, soil and manure compost by liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography A, 2012, 1262(21): 160-168
[29]Göbel A, Thomsen A, McArdell C S, et al. Extraction and determination of sulfonamides, macrolides, and trimethoprim in sewage sludge [J]. Journal of Chromatography A, 2005, 1085(2): 179-189
[31]Grote M, Schwake-Anduschus C, Michel R, et al. Incorporation of veterinary antibiotics into crops from manured soil [J]. Landbauforschung Volkenrode, 2007, 57(1): 25-32
[32]Chuang Y H, Zhang Y, Zhang W, et al. Comparison of accelerated solvent extraction and quick, easy, cheap, effective, rugged and safe method for extraction and determination of pharmaceuticals in vegetables [J]. Journal of Chromatography A, 2015, 1404: 1-9
[33]Rajapaksha A U, Vithanage M, Lim J E, et al. Invasive plant-derived biochar inhibits sulfamethazine uptake by lettuce in soil [J]. Chemosphere, 2014, 111: 500-504
[34]Sallach J B, Snow D, Hodges L, et al. Development and comparison of four methods for the extraction of antibiotics from a vegetative matrix [J]. Environmental Toxicologyand Chemistry, 2015, 35(4): 889-897
[35]Chitescu C L, Oosterink E, Jong J D, et al. Ultrasonic or accelerated solvent extraction followed by U-HPLC-high mass accuracy MS for screening of pharmaceuticals and fungicides in soil and plant samples [J]. Talanta, 2012, 88(1): 653-662
[36]Wu X, Conkle J L, Gan J. Multi-residue determination of pharmaceutical and personal care products in vegetables [J]. Journal of Chromatography A, 2012, 1254(17): 78-86
[37]Wu X, Conkle J L, Ernst F, et al. Treated wastewater irrigation: Uptake of pharmaceutical and personal care products by common vegetables under field conditions [J]. Environmental Science & Technology, 2014, 48(19): 11286-11293
[38]Herklotz P A, Gurung P, Heuvel B V, et al. Uptake of human pharmaceuticals by plants grown under hydroponic conditions [J]. Chemosphere, 2010, 78(11): 1416-1421
[39]Migliore L, Brambilla G, Casoria P, et al. Effect of sulphadimethoxine contamination on barley (Hordeum distichum L., Poaceae, Liliposida) [J]. Agriculture Ecosystems & Environment, 1996, 60(2): 121-128
[40]Lillenberg M, Yurchenko S, Kipper K, et al. Simultaneous determination of fluoroquinolones, sulfonamides and tetracyclines in sewage sludge by pressurized liquid extraction and liquid chromatography electrospray ionization-mass spectrometry [J]. Journal of Chromatography A, 2009, 1216(32): 5949-5954
[41]Oka H, Ito Y, Matsumoto H. Chromatographic analysis of tetracycline antibiotics in foods [J]. Journal of Chromatography A, 2000, 882(2): 109-133
[42]吴小莲, 向垒, 莫测辉, 等. 超高效液相色谱-电喷雾串联质谱测定蔬菜中喹诺酮类抗生素[J]. 分析化学, 2013, 41(6): 876-881
Wu X L, Xiang L, Mo C H, et al. Determination of quinolones in vegetables using ultra performance liquid chromatography-electrospray ionization tandem mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2013, 41(6): 876-881 (in Chinese)
[43]Matamoros V, Calderón-Preciado D, Domínguez C, et al. Analytical procedures for the determination of emerging organic contaminants in plant material: A review [J]. Analytica Chimica Acta, 2012, 722(7): 8-20
[44]Pérez-burgos R, Grzelak E M, Gokce G, et al. Quechers methodologies as an alternative to solid phase extraction (SPE) for the determination and characterization of residues of cephalosporins in beef muscle using LC-MS/MS [J]. Journal of Chromatography B, 2012, 899(9): 57-65
[45]Salvia M V, Cren-Olivé C, Wiest L, et al. Comparison of two analytical methods for the determination of traces of veterinary antibiotics and steroid hormones in soil based on pressurised liquid extraction (PLE) and quick, easy, cheap, effective, rugged, safe (modified-quechers) extraction [J].Pharmaceutica Analytica Acta, 2014, 5(9): 1000315
[46]Aga D S, Lenczewski M, Snow D, et al. Challenges in the measurement of antibiotics and in evaluating their impacts in agroecosystems: A critical review [J]. Journal of Environmental Quality, 2016, 45(2): 407-419
[47]Fussell R J, Lopez M G, Mortimer D N, et al. Investigation into the occurrence in food of veterinary medicines, pharmaceuticals, and chemicals used in personal care products [J]. Journal of Agricultural and Food Chemistry, 2014, 62(17): 3651-3659
[48]Boonsaner M, Hawker D W. Accumulation of oxytetracycline and norfloxacin from saline soil by soybeans [J]. Science of the Total Environment, 2010, 408(7): 1731-1737
[49]Li X, Yu H, Xu S, et al. Uptake of three sulfonamides from contaminated soil by pakchoi cabbage [J]. Ecotoxicology and Environmental Safety, 2013, 92: 297-302
[50]Tuerk J, Reinders M, Dreyer D, et al. Analysis of antibiotics in urine and wipe samples from environmental and biological monitoring — Comparison of HPLC with UV-, single MS- and tandem MS-detection [J]. Journal of Chromatography B, 2006, 831(1): 72-80
[51]Bassil R J, Bashour I I, Sleiman F T, et al. Antibiotic uptake by plants from manure-amended soils [J]. Journal of Environmental Science and Health Part B: Pesticides Food Contaminants and Agricultural Wastes, 2013, 48(7): 570-574
[52]Kumar K, Gupta S C, Baidoo S K, et al. Antibiotic uptake by plants from soil fertilized with animal manure [J]. Journal of Environmental Quality, 2005, 34(6): 2082-2085
[53]Hercegová A, Húšková R, Matisová E, et al. Evaluation of different calibration approaches in pesticide residues analysis in non-fatty food using fast GC-MS [J]. International Journal of Environmental Analytical Chemistry, 2010, 90(3-6): 188-204
[54]Hoff R B, Meneghini L, Pizzolato T M, et al. Structural elucidation of sulfaquinoxaline metabolism products and their occurrence in biological samples using high-resolution Orbitrap mass spectrometry [J]. Analytical Chemistry, 2014, 86(11): 5579-5586
[55]Pérez-Parada A, Agüera A, Gómez-Ramos M D M, et al. Behavior of amoxicillin in wastewater and river water: Identification of its main transformation products by liquid chromatography/electrospray quadrupole time-of-flight mass spectrometry [J]. Rapid Communications in Mass Spectrometry, 2011, 25(6): 731-742
[56]Topal M. Uptake of tetracycline and degradation products by phragmites australis grown in stream carrying secondary effluent [J]. Ecological Engineering, 2015, 79: 80-85
[57]Wu X, Fu Q, Gan J. Metabolism of pharmaceutical and personal care products by carrot cell cultures [J]. Environmental Pollution, 2016, 211: 141-147

