悬浮聚合法合成马拉硫磷分子印迹聚合物的吸附性能研究
芮超凡,宋立新,陈 思,李媛媛,温志兵,何 娟*,魏宏亮,谷克仁
(1.河南工业大学 化学化工与环境学院,河南 郑州 450001;2.河南水利与环境职业学院,河南 郑州 450001)
有机磷类农药主要有马拉硫磷、克线磷、特丁硫磷等,能够高效防治病虫害[1],因其应用相当普遍,因此有机磷类农药是目前农药残留的主要来源之一。通常被检样品中的农药含量非常低[2],而样品基质中常含有大量干扰物质,因此有必要建立一种简单、快速、有效的样品前处理方法。
固相萃取技术是利用填充的固体吸附剂对液体样品中的目标化合物进行吸附及解吸,最终达到对目标化合物分离和富集目的的一种样品前处理技术[3-4]。目前商品化的固相吸附剂缺乏专一选择性,对含复杂基质的样品中痕量有机磷类农药的提取净化效率较低。而分子印迹固相萃取吸附剂作为一种新型固相萃取填料,能对目标分析物进行选择性吸附而排除样品基质的干扰,不仅能降低目标分析物的检出限,还能提高痕量分析的精确性[5-6]。本文以马拉硫磷为模板,采用悬浮聚合的方法合成马拉硫磷分子印迹聚合物(MIPs),对其进行结构表征和吸附性能检测,并与合成的非印迹聚合物进行对比,测试其特异性吸附能力[7]。
1 实验部分
1.1 仪器与试剂
安捷伦7890气相色谱,检测器为 FPD(GC/FPD);HP-5色谱柱(30 m×0.25 mm,1.4 μm);JSM-6490LV扫描电子显微镜(日本电子株式会社)。
马拉硫磷(原药,国药试剂有限公司);α-甲基丙烯酸(α-MAA,上海麦克林生化科技有限公司);乙二醇二甲基丙烯酸酯(EDMA,上海麦克林生化科技有限公司);偶氮二异丁腈(AIBN,科密欧试剂公司);甲醇、乙醇、乙腈、正己烷和丙酮(上海阿拉丁试剂有限公司)均为色谱纯。实验用水为超纯水。
1.2 马拉硫磷分子印迹聚合物的合成方法
取马拉硫磷0.067 mL(0.25 mmol)、MAA 0.170 mL(2 mmol)、EDMA 1.889 mL(10 mmol)加到1%聚乙烯醇溶液中,再加入AIBN 24.24 mg,在60 ℃下反应8 h,得到马拉硫磷分子印迹聚合物。先将产物用甲醇-冰醋酸(体积比9∶1 )溶液洗脱模板分子,再用纯甲醇洗脱至中性,烘干备用。
采用相同方法在不加入模板分子的情况下合成非印迹聚合物(NIPs)。
1.3 聚合物对模板分子马拉硫磷的平衡吸附实验
配制一系列1~100 μg/mL的马拉硫磷水溶液,取20 mg的MIPs,分别加入上述质量浓度的马拉硫磷溶液各4 mL,振荡,静置20 h,取上清液,N2吹干后,用1 mL正己烷溶解,进气相色谱仪测定含量,计算出MIPs对不同底物浓度溶液的吸附量。
用与上述方法一致的步骤测定非印迹聚合物对不同浓度马拉硫磷溶液的吸附量。
1.4 吸附速率实验
分别取12组MIPs 20 mg于5 mL离心管中,编号为1~12,各加入2 μg/mL马拉硫磷溶液4 mL,振荡,静置,1~8号离心管每隔1 h测定1次;9~12号离心管每隔2 h测定1次。计算吸附量。
1.5 聚合物的选择性吸附实验
配制浓度相同的灭线磷、特丁硫磷、甲拌磷、克线磷、乐果与马拉硫磷混合溶液。取 20 mg MIPs于离心管中,加入混合溶液4 mL(6种有机磷标准溶液质量浓度均为5 μg/mL),封口,静置 20 h。用气相色谱测定吸附前后溶液的浓度,通过下式计算MIPs对各底物的吸附量Q:Q=(C0-C)V/m。其中,Q(μg/mg)为聚合物对底物的吸附量;C0(μg/mL)为吸附前溶液浓度;C(μg/mL)为吸附后溶液浓度;V(mL)为待吸附溶液体积;m(mg)为聚合物的质量。
采用相同方法测定NIPs对6种有机磷的吸附量。
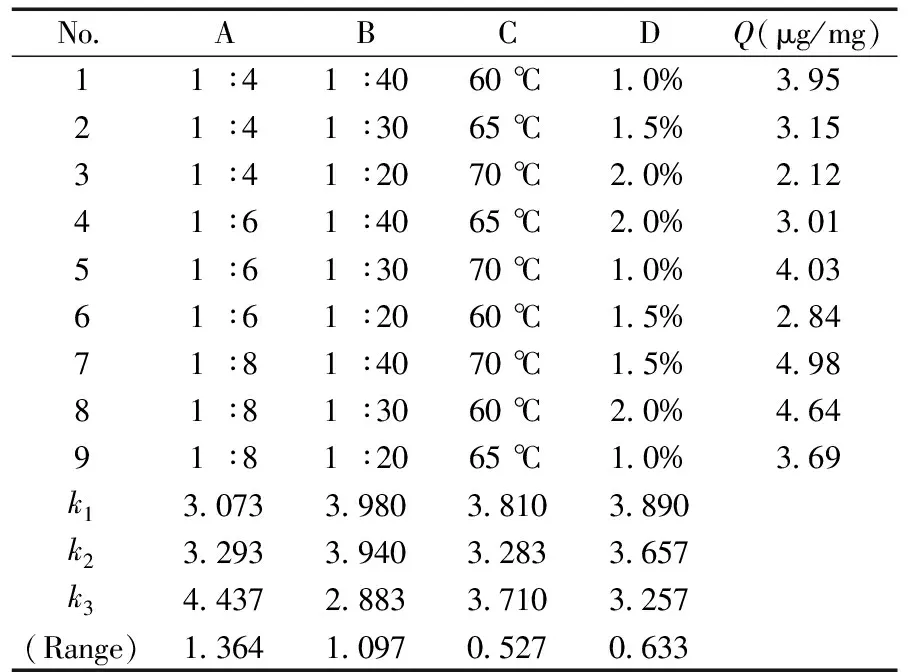
表1 正交实验结果Table 1 Orthogonal experimental results
2 结果与讨论
2.1 分子印迹聚合物的合成条件优化
通过测定合成的MIPs对马拉硫磷的吸附量,采用正交试验对合成条件进行了优化,其中因素A为模板分子与功能单体的比例(摩尔比);因素B为模板分子与交联剂的比例(摩尔比);因素C为温度(℃);因素D为引发剂的用量(%),如表1所示。
由直观分析可以看出,最佳的反应条件为A3B1C1D1,即模板分子∶功能单体=1∶8,模板分子∶交联剂=1∶40,温度为60 ℃,引发剂用量为单体和交联剂质量的1.0%。

图1 MIPs的扫描电镜图Fig.1 The scanning electron micrographs of MIP

图2 MIPs与NIPs对马拉硫磷的吸附等温线Fig.2 Isothermal adsorption of MIPs and NIPs to malathion
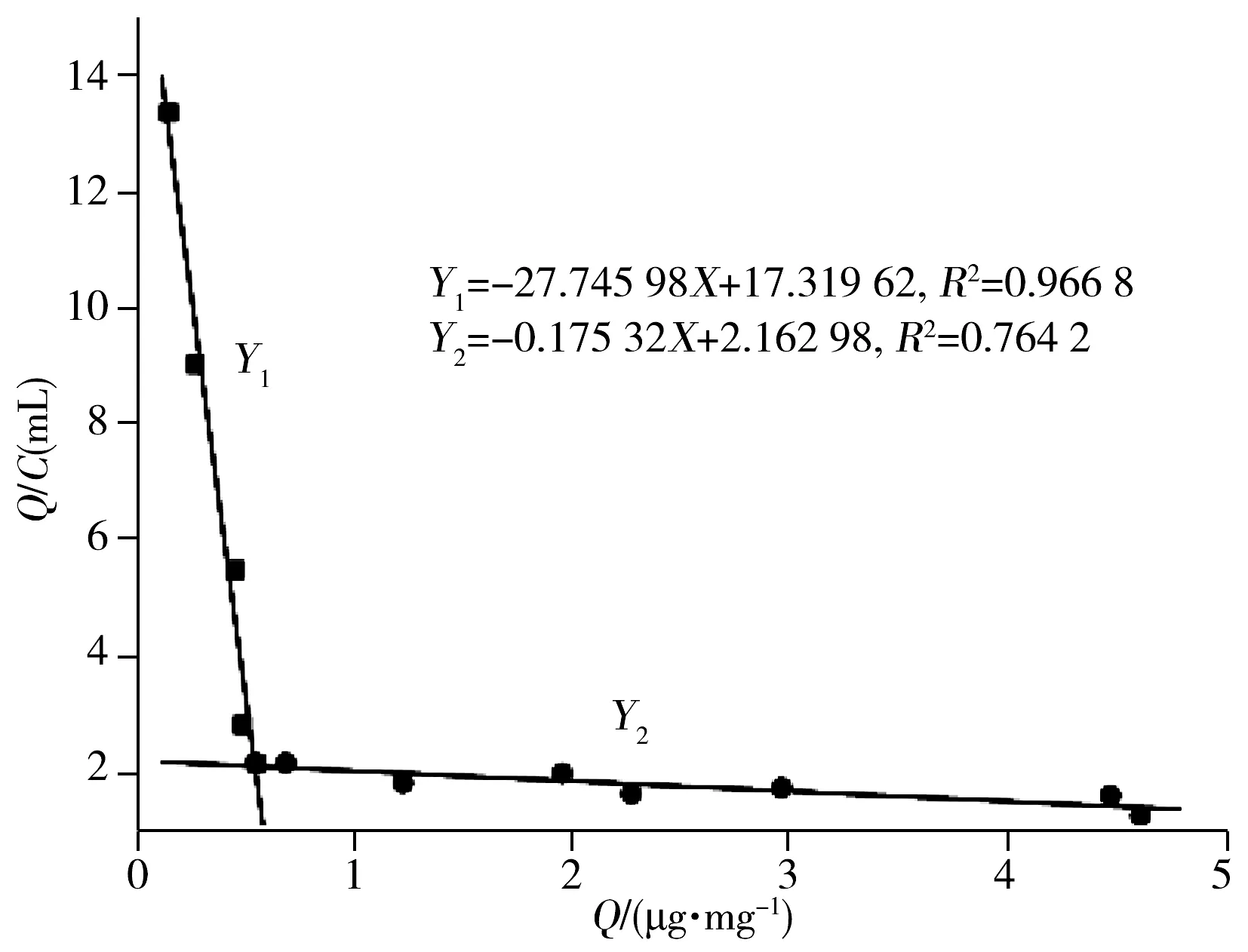
图3 MIPs的Scatchard方程Fig.3 Scatchard equation of MIPs
2.2 马拉硫磷分子印迹聚合物的性能表征
采用扫描电子显微镜对合成的MIPs进行表征,如图1所示。由放大500倍的扫描电镜图可看出:合成的MIPs为球状颗粒,直径约为100 μm,具有较大的比表面积,为其良好的特异性吸附性能打下了基础。
2.3 吸附性能测试
2.3.1平衡吸附实验MIPs、NIPs对马拉硫磷的吸附等温线见图2。由图2可知,MIPs对马拉硫磷的最大吸附量为4.62 μg/mg,NIPs对马拉硫磷的最大吸附量为2.21 μg/mg。MIPs和NIPs对马拉硫磷的吸附量随着马拉硫磷溶液浓度的升高而增大,而马拉硫磷溶液浓度相同时,MIPs的吸附量比NIPs高。这表明,MIPs因特异性吸附作用对马拉硫磷有着更强的亲和力,这是印迹聚合物特异性吸附的体现。
将图2中MIPs的平衡吸附实验获得的数据用于Scatchard分析。通过Scatchard方程式Q/C=(Qmax-Q)/Kd(其中C为吸附平衡浓度,Kd为结合位点的平衡离解常数,Q为聚合物吸附达到平衡时的吸附量,Qmax为结合位点的最大表现结合容量),以Q/C对Q作图得到MIPs的Scatchard曲线,如图3所示。
由图3可以看出:Q/C对Q呈非线性关系,而图中有两部分分别呈现线性关系,表明印迹聚合物与马拉硫磷的结合位点是非均一的,即有两种不同类型的结合位点,为非特异性结合位点和特异性结合位点。
2.3.2模板分子与功能单体作用形式的推测马拉硫磷分子中含有2个酯键,酯键中的氧原子均可与α-甲基丙烯酸中的氢原子作用形成氢键。根据马拉硫磷分子结构的特点,在合成其印迹聚合物时,单体与马拉硫磷分子的相互作用形式推测如图4所示。
2.3.3吸附速率测试测定MIPs随时间变化的吸附量,即吸附速率,结果如图5所示。由图可知,随着时间的增加,MIPs的吸附量逐渐增加,7 h后吸附逐渐变缓,趋于饱和状态,最终达到吸附平衡。
2.4 选择性吸附研究
测定了MIPs和NIPs对马拉硫磷、甲拌磷、克线磷、乐果、灭线磷、特丁硫磷的选择性吸附。结果显示,MIPs对灭线磷、甲拌磷、特丁硫磷、乐果、马拉硫磷、克线磷的吸附量分别为3.87、3.75、3.57、4.00、4.44、3.61 μg/mg,而NIPs的吸附量分别为1.42、1.37、1.30、1.43、1.12、1.23 μg/mg。MIPs对模板分子马拉硫磷的吸附量最大,表明MIPs有着与马拉硫磷分子立体结构互补的特定孔穴,实现了对马拉硫磷的特异性吸附;对其类似物的吸附量较小,说明MIPs有良好的选择性吸附性能。而NIPs对各有机磷的吸附量差别不大,是非特异性吸附。
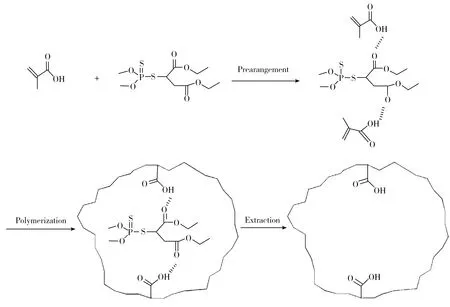
图4 模板分子与功能单体的相互作用推测Fig.4 The possible interaction between the template and functional monomers
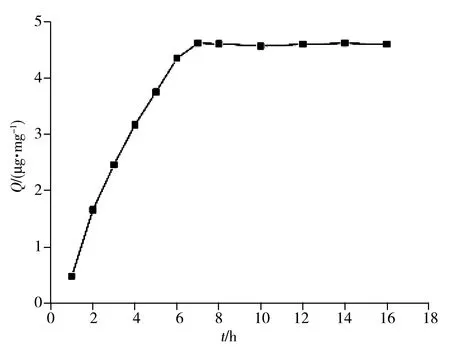
图5 MIPs的吸附速率曲线Fig.5 Adsorption rate curve of MIPs
3 结 论
通过实验得到最佳反应条件为模板分子∶功能单体∶交联剂(摩尔比)=1∶8∶40,反应温度60 ℃,引发剂用量1.0%。在最优条件下合成的MIPs对马拉硫磷的吸附量为4.62 μg/mg,NIPs对马拉硫磷的吸附量为2.21 μg/mg,表明MIPs对马拉硫磷具有良好的吸附性能;选择性吸附实验表明,MIPs对马拉硫磷的吸附量高于灭线磷、甲拌磷等结构类似物,说明MIPs有良好的选择吸附性能。而NIPs的吸附量均小于MIPs,表明NIPs的吸附为非特异性吸附。
参考文献:
[1] Harshit D,Charmy K,Nrupesh P.FoodChem.,2017,230:448-453.
[2] Luo J,Jiang S,Liu X.J.Phys.Chem.C,2016,117(36):18448-18456.
[3] Yao T,Li T F,Qin Y C,Wang J,Zhao Z,Gu X,She Y X.J.Instrum.Anal.(姚婷,李腾飞,秦玉昌,王静,赵祯,谷旭,佘永新.分析测试学报),2015,34(2):237-244.
[4] Peng L Q,Ye L H,Cao J,Chang Y X,Qin L,An M R,Tan Z J,Xu J J.FoodChem.,2017,226:141-148.
[5] Sun R H,Wang T,Wang X,Ji W H.J.Instrum.Anal.(孙日晗,王涛,王晓,纪文华.分析测试学报),2017,36(6):750-755.
[6] Jrl G,Teixeira N,De F V,Sales M G,Sutherland D S.FoodChem.,2017,233:457-466.
[7] Chen N N,He J,Wu C J,Li Y Y,Suo A,Wei H L,He L J,Zhang S S.J.Sep.Sci.,2017,40(6):1327-1333.

