质子转移反应质谱对肺癌患者呼气中特征性VOCs的筛选及研究
郭冰清,孙 运,褚美娟,武隆丰,蒋学慧,2,汪 曣,2*,穆新林*
(1.天津大学 精密仪器与光电子工程学院,天津 300072;2.天津大学 天津市生物医学检测技术与仪器重点实验室,天津 300072;3.北京大学人民医院,北京 100083)
肺癌是对人类健康构成威胁最大的恶性肿瘤之一,在我国的发病率呈上升趋势,目前我国城市中肺癌的发病率和死亡率居肿瘤之首,其总体 5 年生存率不足15%。目前,临床上对肺癌的早期发现主要依赖于低剂量螺旋 CT、PET、荧光纤支镜、开胸手术检查等,但这些检查手段较为复杂,费用昂贵,且给病人造成一定痛苦,较难在临床上广泛应用,因此寻求检测方便且无创的肺癌预测新方法及特征性分子标志物具有重要的科学与临床意义。
挥发性有机化合物(VOCs)是指熔点低于室温而沸点在 50~260 ℃ 之间的有机物。自1971 年 Pauling 等[1]从人呼出气体中检出VOCs以来,利用呼气分析研究人体的生理和病理机制备受关注[2]。Gordon 在 1985 年采用气相色谱仪/质谱分光仪分析了 12 名肺癌患者和健康人呼出气体成分的质谱峰值分布图,提出将呼吸气体检测应用于肺癌诊断的思想。其后 O′Neill等[3]采用不同呼吸气体分析方法改进该实验,认为多种成分组合分析优于单一化学成分分析。2007 年,Phillip等[4]利用气相色谱-质谱分析联用仪分析 193 名肺癌患者与 221 名健康人呼气中的 VOCs,并采用 logic 回归分析选取其中 16 种内源性 VOCs(主要是烷烃类及其衍生物和苯的衍生物)作为特征性标志物建立诊断模型。但GC-MS需复杂的样品预处理过程,同时富集方法、色谱柱选择、色谱升温条件等会对检测结果产生很大影响。因此近年来研究者们发展了多种直接质谱分析技术,如选择离子流动管质谱(EESI-MS)和质子转移质谱技术(PTR-MS)。EESI-MS是一种常压快速质谱分析技术,可将中性样品与带电试剂离子分开,直接完成样品的萃取和电离,另外EESI不仅能监测呼吸气体中含有的极性分子,还能够检测其中的非极性分子[5]。南昌大学刘晓妮[6]利用EESI-MS对肺癌患者、肺部良性疾病患者和健康对照组呼气进行检测,发现丁二烯、四氢生物蝶呤、N-苯乙酰谷氨酰胺等7种VOCs为肺癌特征性VOCs。2007年,Wehinger等[7]利用 PTR-QMS 对17 位肺癌患者和 170 位健康人的呼气成分进行检测,最终发现甲醛和异丙醇可作为肺癌呼气标志物,用来区分肺癌患者和健康人。但该研究选择的肺癌患者样本量太少,与健康对照组样本量严重不匹配。相比于PTR-MS,EESI-MS的定量能力欠缺;质谱图仅能直接显示各物质的相对丰度,虽有研究将液相乙腈标准品浓度换算成气相中的乙腈浓度,对呼出气体中的乙腈浓度进行半定量分析[8],但此方法仅适用于对特定物质的定量分析,难以对呼气谱图中的所有物质成分进行定量,给寻找呼气中VOCs浓度与疾病的线性关系带来困难。因此本文利用 PTR-MS对原发性早期肺癌患者和健康志愿者呼出的气体进行检测,基于检测结果发现了肺癌人群的特征呼气标志物,并分析这些标志物与肺癌的相关性,建立肺癌呼气预测模型并对呼气标志物的生成机制进行探讨。
1 实验部分
1.1 主要仪器及原理
PTR-QMS质子转移反应质谱仪(奥地利Ionicon公司产品),配有 PTR-MS Control 数据处理软件。一次性吹嘴、2 L Tedlar 采样袋均为大连德霖公司产品。
PTR-QMS 由空心阴极放电源、漂移管和质量检测器3部分组成。PTR-MS 采用软电离源,空心阴极放电源产生的H3O+作为反应离子进入漂移管,若待测气体中 VOCs 的质子亲和势(PA)大于 H3O+(PA=691 kJ/mol),则与 H3O+发生质子转移反应,反应方程式为 VOC+H3O+→(VOC)H++H2O,产物离子和反应离子在漂移管电场的作用下进入四极杆检测器,从而得到离子的质荷比及其离子计数值。
1.2 研究对象及方法

表1 志愿者的人口基本特征统计Table 1 Basic characteristics of volunteer
1.2.1研究对象回顾性分析 2016 年 8 月至 2017 年 5 月北京大学人民医院收治的 40 例肺癌患者,并收集同期健康体检者及健康状况良好的社会志愿者共 32 例。所有病例均经细胞学或组织学病理诊断确诊,据 WHO 肺癌组织分类法确定肺癌分型,按照 ULCC(国际抗癌联盟)2009 年修行的肺癌分期进行分期,要求同期肺癌患者无其他慢性疾病,无通气或换气功能障碍。两组志愿者的人口基本特征见表1,肺癌患者病理类型如下:小细胞肺癌7例,非小细胞肺癌33例(包括腺癌 20 例,鳞癌 13 例)。
1.2.2呼气样品采集以Tedlar 袋作为志愿者呼气收集装置,使用方法如下:(1)清洗:首次使用前需用纯净水反复清洗,然后在采样袋阀门口打开的情况下,将采样袋置于加热箱上方,向其中通入纯度为99.9%的氮气进行反复冲洗,直至采样袋被烘干。之后用真空泵将采样袋内气体抽干。(2)采样:采集志愿者呼气时,将一次性吹嘴通过橡胶管与采样袋阀门相连,打开阀门,采集气体样本。(3)重复清洗:每次检测完毕后,需将采样袋内残余气体用真空泵抽干,反复 5~7 次充入纯度为99.9%的氮气,至采样袋内全部VOCs的浓度均降至仪器基线,此时采样袋已完全洗净。用真空泵将采样袋内残余氮气完全抽干。清洗后的采样袋可重复使用。
于每日上午6∶30~7∶30时段采集呼气样本,要求全部志愿者在采气前禁食 12 h,呼气前一晚避免高脂饮食,禁酒,不食用大蒜、生姜等具有刺激性气味的食物。吸烟者在检测前需禁烟 12 h。志愿者采气前半小时用清水漱口,但不能刷牙。所有志愿者需签署知情同意书,填写调查表。采气时,在志愿者平静呼吸 30 min 后,打开 Tedlar 采气袋阀门,通过一次性吹嘴向采样袋内吹气,共收集 2 L 气体样本。用一次性注射器采集志愿者呼吸环境的空气样本注入采样袋中。为保证实验准确性,收集的气体样本均在24 h内完成检测。
1.3 实验条件
检测器电压:2 600 V,漂移管压强:2 mbar,质量扫描范围:m/z1~200,单个离子扫描驻留时间为200 ms,每个样本进行 5 次扫描。单个样品检测时间约4 min。
1.4 数据处理流程
数据处理使用 SPSS version 21.0 统计分析软件。计量资料的组间比较采用 Mann-Whitney秩和检验,计数资料比较采用χ2检验,Sig<0.05 具有统计学差异。将单因素分析显示差异有统计学意义的 VOCs 加入多因素 logistic 回归模型,进一步分析呼气中 VOCs 与罹患肺癌的相关性。采用二元 logistic 回归和 Fisher 判别建立肺癌呼气筛查模型并对模型的准确性进行评价。
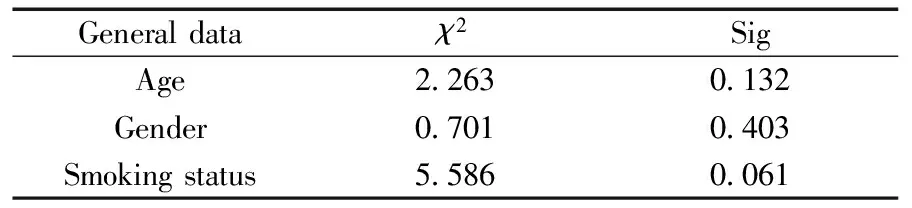
表2 肺癌患者和健康对照组一般资料检验结果Table 2 Comparison of general data between lung cancer patients and healthy controls
2 结果与讨论
2.1 肺癌患者呼出气体中特征性VOCs的筛选
2.1.1一般资料比较由表2可见,肺癌患者和健康对照组的年龄、性别、吸烟情况差异无统计学意义。
2.1.2原始数据处理及内源性VOCs的筛选图1A和B分别为随机选取的一次实验中人体呼出气体谱图和呼气环境空气谱图。

记C1为呼气中 VOCs 浓度,C2为空气中 VOCs 浓度,对所有志愿者呼气谱图筛选满足 0.6×C1≥C2的物质。最终筛选出m/z33、39、41、43、45、59、61、69 这 8 种物质作为呼气内源性 VOCs。
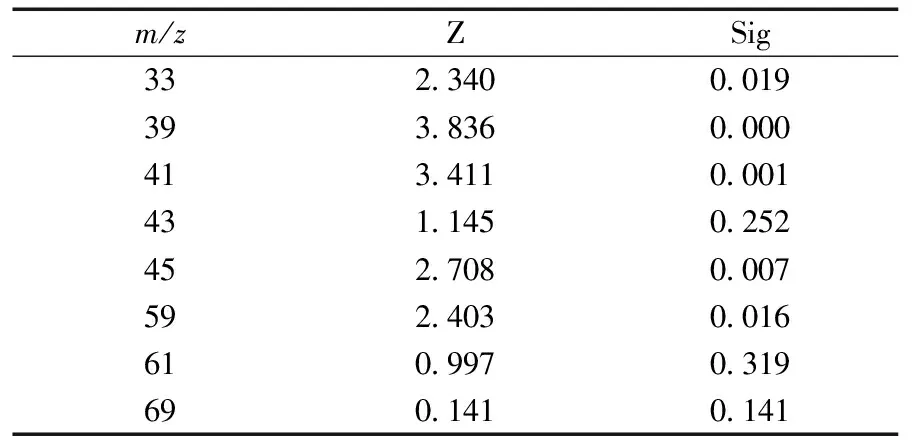
表3 肺癌患者和健康对照组的Mann-Whitney秩和检验结果Table 3 Results of Mann-Whitney test in lung cancer group and healthy group
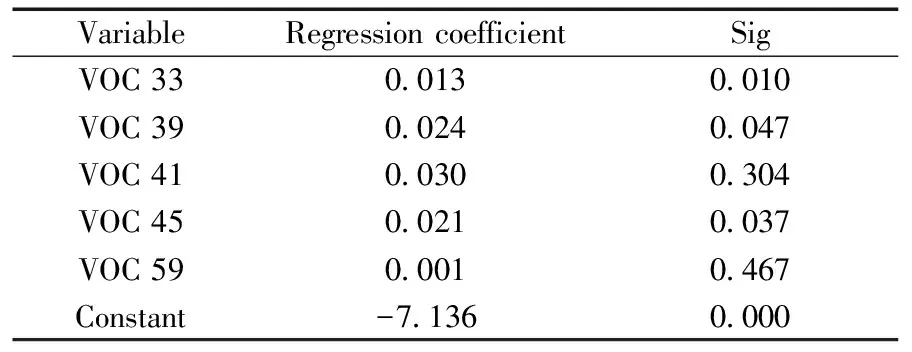
表4 多因素logistic回归分析结果Table 4 Results of logistic regression
2.1.3肺癌呼气特征性VOCs筛选及相关性研究利用 Mann-Whitney 秩和检验比较上述 8 种 VOCs 在三组志愿者呼气之间的表达,认为 Sig<0.05具有统计学差异,具体统计结果见表3。
由表 3可 知,上述 8 种 VOCs 中,m/z33、39、41、45、59 在肺癌患者和健康志愿者之间的表达有统计学差异,分别记为 VOC 33、VOC 39、VOC 41、VOC 45、VOC 59。利用多因素 logistic 回归模型对上述5个变量与肺癌的相关性作进一步分析,结果如表 4所示。VOC 33、VOC 39、VOC 45对应的Sig<0.05,VOC 41 和 VOC 59 的 Sig 值均远大于 0.05,且由表 5知,VOC 33、VOC 39、VOC 45 的浓度与志愿者的性别、年龄、吸烟情况无关。 以上结果说明仅VOC 33、VOC 39、VOC 45与罹患肺癌有关,可作为肺癌患者呼气中的标志性VOCs。
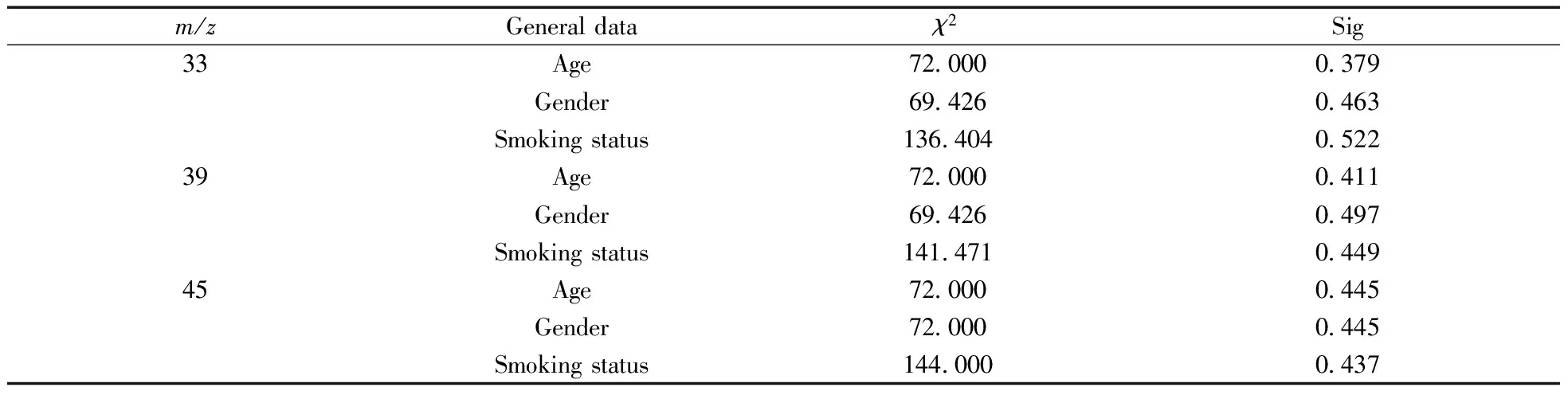
表5 VOC 33、VOC 39、VOC 45浓度与志愿者一般统计资料的关系Table 5 The relationship between VOC 33,VOC 39,VOC 45 and general statistical data of volunteers
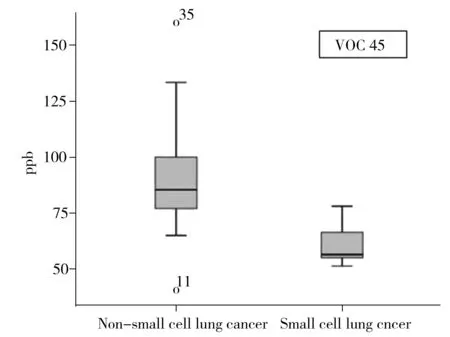
图2 乙醛在小细胞肺癌和非小细胞肺癌患者呼气中的浓度箱状图Fig.2 Box-whisker plots of acetaldehyde between small cell lung cancer patients and non-small cell lung cancer patients
同时检验不同病理类型肺癌患者呼气中VOC 33、VOC 39、VOC 45的浓度是否有差异。其中,组1为鳞癌组,组 2为腺癌组,组 3为小细胞肺癌组;Sig12为组 1 与组 2 比较的 Sig 值,Sig13为组 1 与组 3 比较的 Sig 值,Sig23为组 2 与组 3 比较的 Sig 值。 Nemenyi 秩和检验结果显示,Sig13和 Sig23均小于0.05,Sig12大于0.05,说明VOC 45在非小细胞肺癌和小细胞肺癌患者的呼气中具有统计学差异,但不可区分鳞癌和腺癌。图2表明VOC 45在非小细胞肺癌患者呼气中浓度较高。其它两种 VOCs 在3种肺癌患者中均不存在显著差异。
2.2 肺癌呼吸筛查模型的建立及评价
2.2.1二元logistic回归预测模型将自变量 VOC 33、VOC 39、VOC 45 作为协变量建立二元 logistic 回归方程。记P为罹患肺癌的概率,其预测方程如式(1)所示。由表6中OR值知VOC 33、VOC 39、VOC 45 每增加 1 ppb,罹患肺癌的概率将提高 0.104、0.030、0.023倍,Omnibus 检验结果表明,回归模型的Sig 值为 0.000,说明该模型对患癌概率的预测结果具有统计学意义。
log(P)=-6.420+0.014X1+0.030X2+0.023X3
(1)
图3为该回归模型的 ROC 曲线,曲线下面积(AUC)为0.878,灵敏度为85.5%,特异性为 63.5%。该模型灵敏度较好,特异性尚可,总体预测能力较好。

表6 回归模型系数及显著性检验Table 6 Regression model coefficient and significance test
2.2.2Fisher判别分析模型利用 VOC 33、VOC 39、VOC 45 进行 Fisher 判别分析,得到的判别函数形式如式(2)所示。
Y=-3.203+0.009X1+0.019X2+0.005X3
(2)
若Y>1,则被判别为肺癌人群;若Y<1,则被判别为健康人群。Fisher判别模型的 ROC 曲线如图4所示,敏感度为 82.5%,特异性为 62.5%。曲线下面积(AUC)为 0.822。相比于二元 logtistic 回归模型,该模型的敏感度和特异性均较低,预测能力较差。

图3 二元logistic模型的ROC曲线Fig.3 ROC curve of the regression model

图4 Fisher 判别模型的 ROC 曲线Fig.4 ROC curve of the discriminant model
2.3 呼气标志物分析
本实验通过对肺癌患者和非肺癌人群呼气中 VOCs 的检测,认为 VOC 33、VOC 39、VOC 45 的浓度在肺癌患者和健康对照组之间有统计学差异,说明这3种物质最有可能是肺癌患者呼出气体中的生物标记物。Turner等[9]在2006年利用SIFT-MS在30名志愿者中也检测到VOC 33,并利用标准物验证该物质对应为甲醇发生质子转移反应后的产物。2008年,Kushch等[10]利用PTR-MS在205名志愿者呼气中检出VOC 39,并利用不同浓度的异戊二烯标准品对该物质进行验证。实验表明,VOC 39与异戊二烯的相关性为0.92,说明VOC 39对应异戊二烯质子转移反应后的产物。2004年,Zhao等[11]利用PTR-MS对78种碳氢化合物进行了检测,最终确定VOC 45对应的是乙醛质子转移反应后的产物。
目前很多研究表明,癌细胞代谢与脂质过氧化过程密切相关。Pitkanen等[12]研究发现人体脂质过氧化过程中会产生多种烷类VOC,Wang等[13]通过直接分析肺底气体中VOC在肿瘤切除手术前后的差异,认为脂质过氧化反应会产生大量烷烃类VOC。2003年,Phillips等[14]选择了9个VOCs所谓潜在的肺癌标志物,并认为烷烃是肺部脂质过氧化的产物,且与肺癌患者体内的多态细胞色素P450混合型氧化酶有关。
甲醇是呼气中主要存在的醇类物质。肿瘤患者中介导 VOCs 代谢的肝脏细胞色素 P 450 酶系统的多家族基因的改变,可能导致烷烃成分增加,这些烷烃物质通过细胞色素混合酶系统代谢,最终可氧化成甲醇排出体外[15-16]。
异戊二烯属于不饱和烃类,是人体呼气中常见有机物,主要是在胆固醇生物合成通路中产生。同时,Fuchs等对 79 名肺癌患者呼气中的异戊二烯浓度进行检测,认为异戊二烯可能与肺癌患者体内脂质代谢的变化有关[17]。浙江大学胡燕婕曾在对肺癌细胞株代谢气体产物中检测到异戊二烯,并推测其在肺癌组织中的形成与肺泡表面活性物质的氧化损伤有关[18]。
乙醛是体内糖类代谢的中间产物,由乙醇经肝脏NAD依赖性醇脱氢酶氧化代谢形成。Esterbauer提出大部分脂氢过氧化物可通过脂链的一次或多次断裂生成醛类物质[19]。Redondo等在两种非小细胞肺癌细胞株(Skmes,CALU-1)体外培养过程的代谢气体中也发现了乙醛的成分,认为乙醛可以作为肺癌标志性VOC[20]。
3 结 论
本文提出了利用 PTR-QMS 进行肺癌呼气研究的方法,完成了32名健康志愿者和40名肺癌患者呼气中VOCs的采集和分析,结果发现呼气中VOC 33、VOC 39、VOC 45在肺癌患者和非肺癌患者之间有显著差异。以上述3个变量建立的预测模型总体预测效果较好,相比于Fisher 判别模型,二元 logistic 能更加明显的体现呼气浓度与罹患肺癌概率的函数关系,灵敏度及特异性更高,AUC值更大,说明其对肺癌有更准确的预判能力。但两种模型均无法进一步对肺癌患者的病理类型进行预判。
本实验从志愿者呼气中检出8种离子强度,在此基础上,可扩大检测样本量以获取更多、更全面的肺癌病人和健康人呼气中的VOCs信息,寻找更多与肺癌有关的气体标志物,并可进一步将PTR-MS用于肺癌分期诊断。由于PTR-MS的定性能力有限,可通过一些特殊的方法与色谱等仪器联用来确定物质成分[19-20]。相信在不久的将来,利用PTR-MS进行呼气分析将会得到更为广泛的应用。
致谢:感谢北京大学人民医院住院患者及相关医护人员对本研究的帮助和配合,感谢中国环境科学研究院提供的质谱仪器。
参考文献:
[1] Pauling L,Robinson A B,Teranishi R,Cary P.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1971,68(10):2374-2376.
[2] Gordon S M,Szidon J P,Krotoszynski B K,Gibbons R D,O′Neill H J.Clin.Chem.,1985,31(8):1278-1282.
[3] O′Neill H J,Gordon S M,O′Neill M H, Gibbons R D,Szidon J P.Clin.Chem.,1988,34(8):1613-1616.
[4] Phillips M,Altorki N,Austin J H,Cameron R B,Cataneo R N .CancerBiomarkers,2007,3(2):95-97.
[5] Zhang Y,Pan S S,Zhu Z Q,Zhang X L,Xu S G,Wei Y P,Chen H W,Ding J H.Anal.Chem.(张燕,潘素素,朱志强,张兴磊,徐四高,魏益平,陈焕文,丁建桦.分析化学),2013,41(8):1220-1225.
[6] Liu X N.DetectionofExhaledGasbasedonElectrosprayIonizationCombinedMassSpectrometryintheDiagnosisofLungCancer.Nanchang:Nanchang University(刘晓妮.基于电喷雾萃取电离联合质谱技术检测呼出气体于肺癌诊断的研究.南昌:南昌大学),2015.
[7] Wehinger A,Schmid A,Mechtcheriakov S,Ledochowski M,Grabmer C.Int.J.MassSpectrom.,2007,265(1):49-59.
[8] Kerry W.DevelopmentofChemicalIonisationReactionTime-of-flightMassSpectrometryfortheAnalysisofVolatileOrganicCompoundsinExhaledBreath.Leicester:University of Leicester,2010.
[9] Turner C,Spanel P,Smith D.Physiol.Meas.,2006,27(4):637-648.
[10] Kushch I,Arendacká B,Stolc S,Mochalski P,Filipiak W,Schwarz K.Clin.Chem.Lab.Med.,2008,46(7):1011-1015.
[11] Zhao J,Zhang R.Atmos.Environ.,2004,38(14):2177-2185.
[12] Pitkäken O M.FreeRad.Biol.Med.,1992,13(3):239-241.
[13] Wang C,Ke C,Wang X,Chi C,Guo L.Anal.Bioanal.Chem.,2014,406(19):4757-4763.
[14] Phillips M,Cataneo R N,Cummin A,Cummin A R,Gagliardi A J,Gleeson K.Chest,2003,123(6):2115-2123.
[15] Kneepkens C M F,Lepage G,Roy C C.FreeRad.Biol.Med.,1994,17(2):127-131.
[16] Sponring A,Filipiak W,Mikoviny T,Ager C,Schubert J.AnticancerRes.,2009,29(1):419-421.
[17] Fuchs D,Jamnig H,Heininger P,Klieber M,Schroecksnadel S.J.BreathRes.,2012,6(2):027101.
[18] Hu Y J.ScreeningandDiagnosticValueofExpiratoryCharacteristicVOCsinLungCancer.Hangzhou:Zhejiang University(胡燕婕.肺癌呼气特征性VOCs的筛选及诊断价值研究.杭州:浙江大学),2010.
[19] Esterbauer H,Cheeseman K H,Dianzani M U,Poli G,Slater T F.Biochem.J.,1982,208(1):129-131.
[20] Redondo M,Ruiz-Cabello F,Concha A,Cueto A,Gonzalez A.CancerRes.,1991,51(9):2463-2466.

