直接稀释/电感耦合等离子体质谱法测定人血清中微量元素
孙传强,龚子珊,郭广宏,田亚平,赵学玒,汪 曣*
(1.天津大学 精密仪器与光电子工程学院,天津 300072;2.中国人民解放军总医院 生化科,北京 100853)
微量元素虽然在人体内含量不多,但对人的生命活动起着至关重要的作用,其摄入过量或不足均会不同程度地引起人体生理的异常或疾病发生。如Cu、Fe、Zn是人体必需的微量元素,是相关蛋白(金属蛋白)和酶(金属酶)的必要组成部分[1-2],而长期暴露在高Al、Ga、As、Cd、Hg、Tl、Pb等元素的环境中会对人体造成巨大伤害[3-10]。因此,建立人体血清中微量元素准确有效的检测方法,对考察人体内微量元素的含量水平至关重要。
目前可用于人体微量元素检测的方法有原子吸收光谱法、原子发射光谱法、原子荧光光谱法、分子光谱法、X射线荧光光谱法、生化法、电化学分析法(电位溶出法)、电感耦合等离子体质谱法等[11-15],在临床医学上广泛应用的方法主要为生化法、电化学分析法、原子吸收光谱法,但生化法和电化学分析法结果的准确性差。原子吸收法是目前公认的比较优越的元素检测方法,但其线性范围窄、使用单一元素的检测方式,难以满足实际样品中多种痕量元素同时检测的需求。电感耦合等离子体质谱(ICP-MS)是一种能够实现多元素痕量检测的分析技术,在人体微量元素临床检测方面有着广阔的应用前景。
本文针对人血清样品,使用直接稀释的样品前处理方法,选择与人血清pH值、基质相近的碱性稀释剂,通过优化仪器参数及检测条件,实现了对人血清中部分有益元素、有毒有害元素共10种元素的同时检测。
1 实验部分
1.1 仪器与装置
NexION 300D电感耦合等离子体质谱仪:美国铂金埃尔默(Perkin Elmer)公司产品,配有四极杆碰撞/反应池(具有标准模式(无气体)、碰撞模式(KED)、反应模式(DRC)3种工作模式可切换)。接口锥系统包括镍制的采样锥和截取锥,以及铝制的超截取锥。仪器工作参数:ICP射频功率1 600 W;冷却气流速为18 L/min,辅助气流速为1.10 L/min,雾化气流量0.98 L/min;跳峰扫描模式,驻留时间50 ms;Cu、Zn、Cd、Hg、Tl、Pb元素测量使用标准模式,Fe、Ga、As元素使用KED模式,碰撞气为氦气,Al元素使用DRC模式,反应气为氨气。
每次在进样分析前需对仪器进行调谐校准,调谐方法如下:用质量浓度为1 μg/L的调谐液(Perkin Elemer公司)对仪器进行调谐,当信号强度Be>2 000 counts/s,In>40 000 counts/s,U>30 000 counts/s,背景噪声在质量数220处响应值≤1,氧化物产率CeO+/Ce+≤2.5%,双电荷产率Ce2+/Ce+≤3%时,认为仪器调谐通过,可以正常工作。
1.2 主要材料与试剂
超纯水(电阻率18.2 MΩ·cm)是由Milli-Q Advanced A 10系统(Millipore公司,美国)制备得到;混合元素标准储备液(Al、As、B、Ba、Be、Bi、Cd、Co、Cr、Cu、Fe、Ga、Li、Mg、Mn、Ni、Pb、Sb、Sn、Sr、Ti、Tl、V和Zn,100.0 μg/mL)由国家有色金属及电子材料分析测试中心提供;Hg、Rh、In、Bi单元素标准溶液(1 000 μg/mL)由国家钢铁研究总院提供;调谐液(Be、Ce、Fe、In、Li、Mg、Pb和U,1%HNO3介质,1 μg/L),TritonX-100由珀金埃尔默(PerkinElmer)公司提供;正四丁基氢氧化铵(体积分数为40%)、乙二胺四乙酸二钠(EDTA,高纯)购自Alfa Aesar公司;ClinChek®-Control人血清标准物质购自德国Recipe公司。
稀释剂成分:0.5% 正四丁基氢氧化铵溶液、0.3% TritonX-100和0.5% EDTA,其他成分为超纯水。将混合标准储备液用稀释剂稀释100倍,得到质量浓度为1 000 μg/L的母液,使用时逐级稀释为系列标准溶液。
1.3 实验方法
1.3.1标准曲线的建立首先对人血清分析物进行半定量分析实验。半定量分析的准确度较差,存在±30%的误差,仅用于预估标准曲线工作范围。经分析,各元素的标准溶液浓度梯度设定为Fe、Cu、Zn元素:5、10、20、50、100 μg/L;Al、Ga、As、Cd、Tl、Pb元素:0.05、0.1、1、5、10 μg/L;Hg元素:0.05、0.1、0.5、1、2 μg/L。
1.3.2样品处理健康成年人血清样本由中国人民解放军总医院提供。人血清样本保存在-18 ℃下,用时提前置于室温解冻,振荡均匀后,取一定量的人血清样品,用稀释剂稀释10倍,混匀待测。
2 结果与讨论
2.1 质谱干扰
为消除多原子离子的干扰,对碰撞/反应池条件进行了优化,包括碰撞气体流速、反应气体流速以及RPq值(即多极杆工作参数),优化后的条件如表1所示。实验发现,氨气反应模式下适合Al元素的检测,而氦气碰撞模式有利于消除ArO、ClO2、ArCl等多原子离子对Fe、Ga和As元素的干扰,其他元素用标准模式即可。
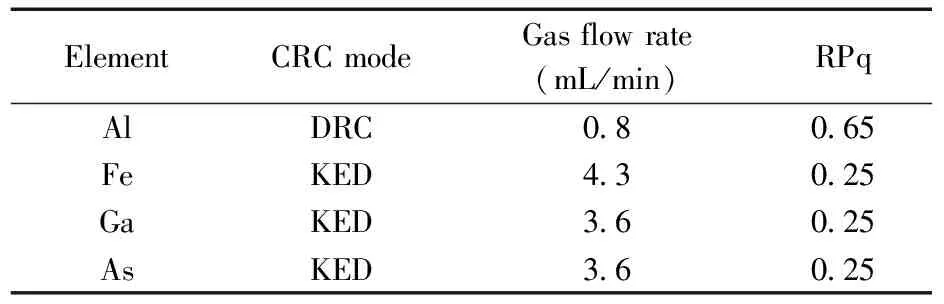
表1 碰撞反应池参数设置Table 1 The parameters of collision/reaction cell(CRC)
2.2 内标元素的选择
内标元素的选择主要基于分析元素的质量数和电离能,一般选择质量数和电离能与分析元素相近的元素作为内标。为了更好地校正非质谱干扰,本实验使用多种内标元素进行校正。Sc常用以校正低质量数的元素(质量数为6~70),但在本实验中发现,Sc作为内标的测试结果不稳定,可能与检测的样品基体复杂有关,因此选择Rh元素校正低质量数的元素(Al、Fe、Ga、Cu、Zn、As),In元素校正中间质量数的元素(Cd),Bi元素校正高质量数的元素(Hg、Tl、Pb)。
2.3 方法线性、检出限与定量下限
本研究考虑到人血清中待测元素浓度差异,配制3套低高浓度元素标准溶液,质量浓度范围如“1.3.1”所述。先后进样各套浓度标准溶液,以标准溶液各元素质量浓度(X,μg/L)为横坐标,离子计数值(Y)为纵坐标,绘制标准曲线。结果如表2所示,所有元素的线性良好,相关系数不小于0.999 6,可以满足微量元素准确定量分析的需求。

表2 线性相关系数、检出限、定量下限及回收率Table 2 Correlation coefficient,detection limits,quantification limits and recovery
通过独立测量11次空白溶液的信号强度,以其标准偏差乘以3并反演浓度求得方法的检出限(LOD),其标准偏差乘以10并反演浓度求得定量下限(LOQ),实验结果列于表2。10种待测元素的LOD为0.9 ng/L~0.346 μg/L,LOQ为0.003~1.142 μg/L,均远低于正常人血清中各元素含量。
2.4 加标回收率与精密度
实验根据分析元素在样品中的含量差异,不同元素设置不同的加标量,一般加标量为待分析元素含量的0.5~2.0倍,计算得各元素的加标回收率为87.2%~111.2%(表2)。

表3 人血清标准物质的检测结果Table 3 Results of trace elements in human serum standard from ClinChek®-Control
通过6次独立实验,计算浓度结果的相对标准偏差(RSD)求得精密度。对于Ga、As、Cd、Hg、Tl、Pb等含量较低的元素,精密度的测量是通过向实际样品中加入1 μg/L分析元素的标准物质,计算检测浓度结果的RSD求得,结果见表2。其中,日间RSD为2.0%~8.7%,相较于日内RSD(0.7%~6.9%)略差,推断是样品中残留蛋白沉淀导致待测元素浓度测量的日间变异。
2.5 人血清标准物质分析
为进一步验证方法的准确性,采用本方法对人血清标准物质ClinChek®-Control Serum Control lyophilized level Ⅰ和level Ⅱ中相应元素进行了测定,实验结果如表3所示。对比测定值和标准物质给出的参考范围可以看出,测定值均在给定的参考范围内,本方法能够对人血清样品中微量元素进行准确定量分析。
2.6 人血清实际样本检测
本研究共采集血清样本127例,被采血者为体检各器官功能正常、无疾病的健康成年人。按照不同年龄段,将样本分为21~35岁组(23例)、36~50岁组(60例)、51~65岁组(44例),并按性别将36~50岁组(60例)分为两组,其中男性19例,女性41例。在优化条件下进样分析,检测结果如表4所示。人体内部分元素含量低于定量下限,按照通用的生物学检测和调查方法,以1/2 LOQ作为该元素的估算值。

表4 不同年龄段的健康成年人血清中微量元素含量的平均值和范围,以及不同性别健康成年人血清中微量元素含量平均值Table 4 Mean value and range of elements concentrations in serum from healthy adults of three age groups,and mean value of elements concentrations in serum from healthy adults of different sex groups
a.μg/L,b.mg/L
Fe、Cu、Zn是对人体有益的痕量元素,并被我国的各级医疗保健单位作为人体元素检测的常规项目。由表4可知,Fe、Cu、Zn含量随着年龄的增长呈降低的趋势。女性血清中铜的含量略高于男性。铁是常见的受性别影响较大的元素,女性体内铁含量常低于男性,与文献报道结果相符[16]。
对于Al、As、Ga、Hg、Tl等有毒有害元素,Al的含量随着年龄的增长呈增加趋势,说明Al在人体内有一定的累积作用,而As、Ga、Hg和Tl在各年龄段的含量无明显趋势。另外,实验发现Pb、Cd元素在女性测试者体内含量明显高于男性,具体成因尚未明确。
3 结 论
本文建立了直接稀释/ICP-MS方法,用于测定人血清样品中10种微量元素,包括有益元素(Cu、Fe、Zn)和有毒有害元素(Al、Ga、As、Cd、Hg、Tl、Pb)。实验中采用的直接稀释法,较常规消解方法,大大简化了前处理过程,缩短了样品的分析时间,有效地避免了复杂样品前处理带来污染的可能[17]。同时,样品需求量少,适用于临床微量元素检测。针对不同分析元素,使用混合内标校正,测定结果更为准确。实验分析了不同年龄段、不同性别的健康成年人血清样品中的微量元素,并给出了参考均值和浓度范围,为构建人群微量元素大数据、探讨微量元素与疾病的关系提供了一种准确有效的检测方法。
参考文献:
[1] Forrer R,Gautschi K,Lutz H.Biol.TraceElem.Res.,2001,80(1):77.
[2] Zhang R J,Zhou Z F,Li M J,Li Z H,Zeng L L,Ma A D.J.Instrum.Anal.(张睿佳,周枝凤,李敏杰,李子焕,曾利兰,马安德.分析测试学报),2017,36(8):975-979.
[3] Cai B,Wang Y,Zhao X H,Gong Z S.Anal.Lett.,2016,50(3):1-13.
[4] Harrington J M,Young D J,Essader A S,Sumner S J,Levine K E.Biol.TraceElem.Res.,2014,160(1):132-142.
[6] Kim K,Steuerwald A J,Parsons P J,Fujimoto V Y,Browne R W,Bloom M S.J.Environ.Monit.,2011,13(9):2413-2419.
[7] Lu Y,Kippler M,Harari F,Grandér M,Palm B,Nordqvist H,Vahter M.Clin.Biochem.,2015,48(3):140-147.
[8] Goullé J P,Mahieu L,Castermant J,Neveu N,Bonneau L,Lainé G,Bouige D,Lacroix C.ForensicSci.Int.,2005,153(1):39-44.
[9] Cieslak W,Pap K,Bunch D R,Reineks E,Jackson R,Steinle R,Wang S.Clin.Biochem.,2013,46(3):266-270.
[10] Ivanenko N B,Ivanenko A A,Solovev N D,Zeimal A E,Navolotskii D V,Drobyshev E J.Talanta,2013,116:764-769.
[11] Giakisikli G,Quezada A A,Tanaka J,Anthemidis A N,Murakami H,Teshima N,Sakai T.Anal.Sci.,2015,31(5):383-389.
[12] Zaichick V,Zaichick S.OpenJ.Biochem.,2014,1(2):16-33.
[13] Chen Y,Li M,Fu L,Hou X D,Jiang X M.Microchem.J.,2014,114:182-186.
[14] Pemmer B,Roschger A,Wastl A,Hofstaetter J G,Wobrauschek P,Simon R,Thaler H W,Roschger P,Klaushofer K,Streli C.Bone,2013,57(1):184-193.

[16] Zacharski,Leo R,Ornstein D L,Woloshin S,Schwartz L M.Am.HeartJ.,2000,140(1):98-104.
[17] Liu W,Song J M,Yuan H M,Li X G,Li N,Duan L Q.J.Instrum.Anal.(刘伟,宋金明,袁华茂,李学刚,李宁,段丽琴.分析测试学报),2017,36(4):471-477.

