高效液相色谱法测定小儿化毒胶囊人工牛黄中胆红素含量
赵珊珊 ,罗定强 ,吴 芳 ,刘海静 ,△
(1.陕西中医药大学,陕西 咸阳 712046; 2.陕西省食品药品监督检验研究院,陕西 西安 710061)
小儿化毒胶囊由人工牛黄、珍珠、雄黄、大黄、黄连、甘草、天花粉、川贝母、赤芍、乳香(制)、没药(制)、冰片 12 味中药组方,具有清热解毒、活血消肿的功效。该药为西安碑林药业股份有限公司独家生产,质量标准收载于国家食品药品监督管理总局《国家药品标准·新药转正标准(第50册)》,处方中原使用牛黄,2013年向国家食品药品监督管理总局备案药品注册补充申请,使用人工牛黄代替牛黄投料。处方中的人工牛黄由胆酸、牛胆粉、猪去氧胆酸、胆红素、牛磺酸、胆固醇、微量元素等加工制成,具有清热解毒、化痰定惊的作用[1]。胆红素为人工牛黄的主要成分之一,可在机体中发挥抗氧化、抗凋亡、免疫调节、抗炎等作用[2-3],是人工牛黄发挥药效的重要成分。因其在空气中尤其光照下极易氧化,在提取过程中又易受影响而衰减[4],故应建立合理、有效的测定方法来控制其胆红素的含量。本研究中采用高效液相色谱(HPLC)法测定小儿化毒胶囊人工牛黄中胆红素的含量,现报道如下。
1 仪器与试药
1.1 仪器
Waters e2695型高效液相色谱仪(含Empower色谱工作站,美国沃特斯公司);BS224S型及BP211D型电子分析天平(德国赛多利斯公司);优普系列超纯水器(四川优普超纯科技有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
胆红素对照品(批号为 100077-200805,纯度以98.5%计),购自中国食品药品检定研究院;乙腈(批号为 0000170700)、甲醇(批号为 0000170699)均为色谱纯,购自北京化标源科技有限公司;冰醋酸(批号为20150804)、三氯甲烷(批号为 20170321)、甲醇(批号为20171027)均为分析纯,盐酸(批号为20140711)为优级纯,均购自国药集团化学试剂有限公司;小儿化毒胶囊(西安碑林药业股份有限公司,批号分别为10011,10021,10031,10041,10051,10061,20071,20081)。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Waters Symmetry C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇 -乙腈 -1% 冰醋酸(88 ∶1 ∶2);检测波长:452 nm;流速:1 mL/min;柱温:35 ℃;进样量:10 μL。在此色谱条件下,胆红素可达到基线分离,色谱图见图1。
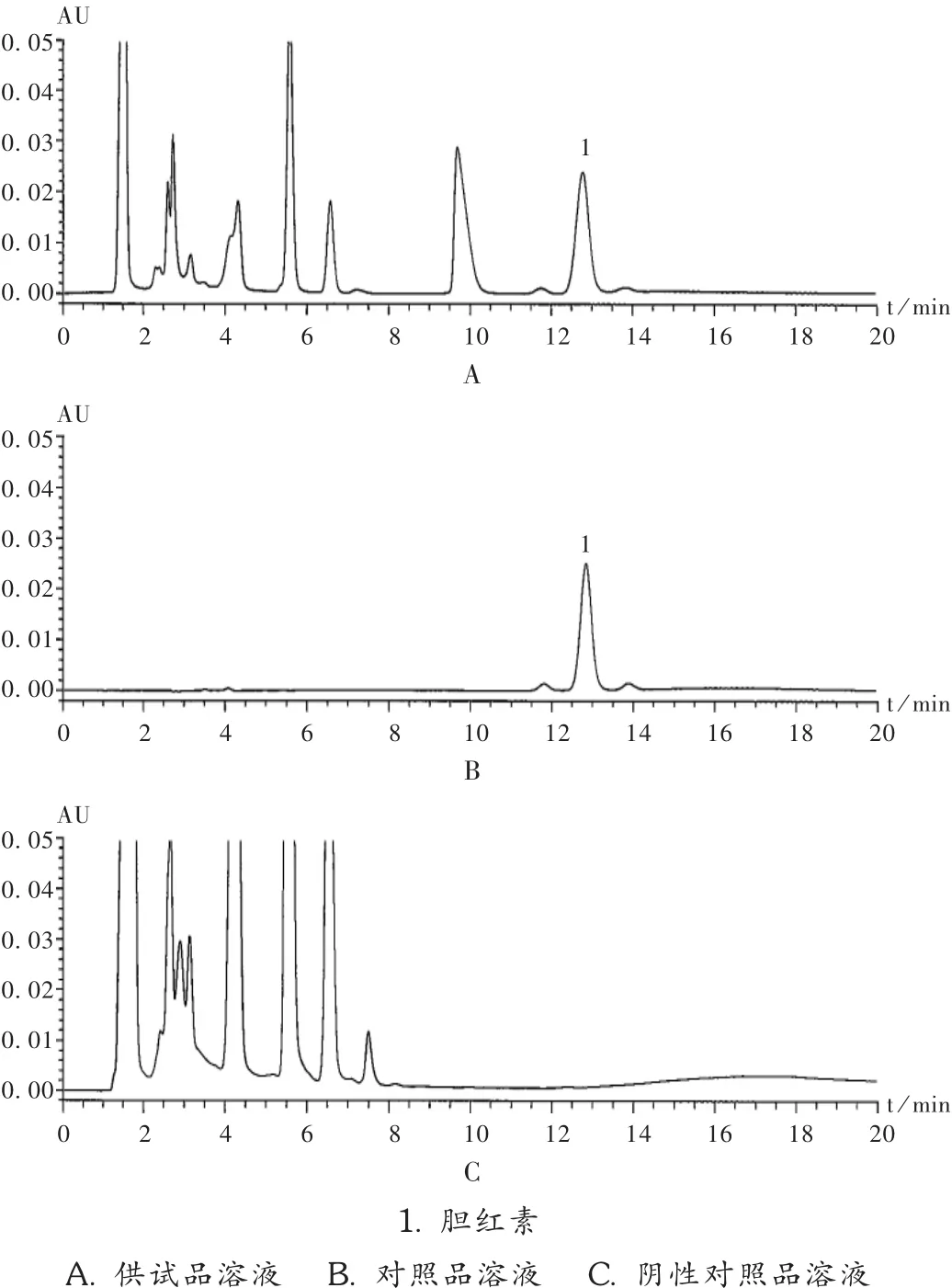
图1 高效液相色谱图
2.2 溶液制备
供试品溶液:取本品内容物3 g,精密称定,置具塞锥形瓶中,精密加入三氯甲烷-甲醇-盐酸-水(90∶10 ∶0.015 ∶0.3)25 mL,称定质量,冷水超声处理(250 W,40 kHz)50 min,再称定质量,用三氯甲烷-甲醇-盐酸-水(90 ∶10 ∶0.015 ∶0.3)补足减失的质量,摇匀,滤过,取续滤液,即得。
对照品溶液:取胆红素对照品4.88 mg,精密称定,置50 mL棕色容量瓶,加三氯甲烷适量使溶解,再稀释至刻度。精密量取5 mL,置25 mL棕色容量瓶中,加三氯甲烷 -甲醇 -盐酸 -水(90∶10∶0.015∶0.3)混合溶液至刻度,摇匀,即得。
阴性对照品溶液:取缺人工牛黄的阴性样品,按供试品溶液制备方法制备,即得。
2.3 方法学考察
线性关系考察:精密吸取质量浓度为19.23 μg/mL的胆红素对照品溶液 1.0,2.0,3.0,5.0,8.0,10.0,15.0 μL,以进样量(X,μg)为横坐标、峰面积(Y)为纵坐标,进行线性回归,得回归方程 Y=1 808.047 X-4 734.624,r=0.999 9(n=7)。结果表明,胆红素进样量在 0.019 23 ~0.288 45 μg范围内与峰面积线性关系良好。
精密度试验:精密吸取同一对照品溶液,按2.1项下色谱条件重复进样6次,每次10 μL,测定峰面积。结果的 RSD为0.16%(n=6),表明仪器精密度良好。
稳定性试验:精密吸取供试品溶液 10 μL,按2.1项下色谱条件,分别于制备0,4,8,12 h时进行色谱测定,记录峰面积。结果的 RSD为2.03%(n=4),表明供试品溶液仅在4 h内稳定性良好,故溶液测定需要临用时新制。
重复性试验:取同批次样品6份,每份3 g,精密称定,依法制备供试品溶液,进样测定。结果胆红素含量的RSD为2.30%(n=6),表明方法重复性良好。
加样回收试验:称取胆红素对照品6.15 mg,精密称定,置100 mL容量瓶中,加溶剂制成质量浓度为60.58 μg/mL 的溶液,作为贮备液;取已知含量的样品(胆红素含量为 0.084 mg /g)6 份,各 1.5 g,分别加入贮备液 1,1,1,2,2,2 mL,同法制备供试品溶液,进样测定,计算回收率。结果见表1。
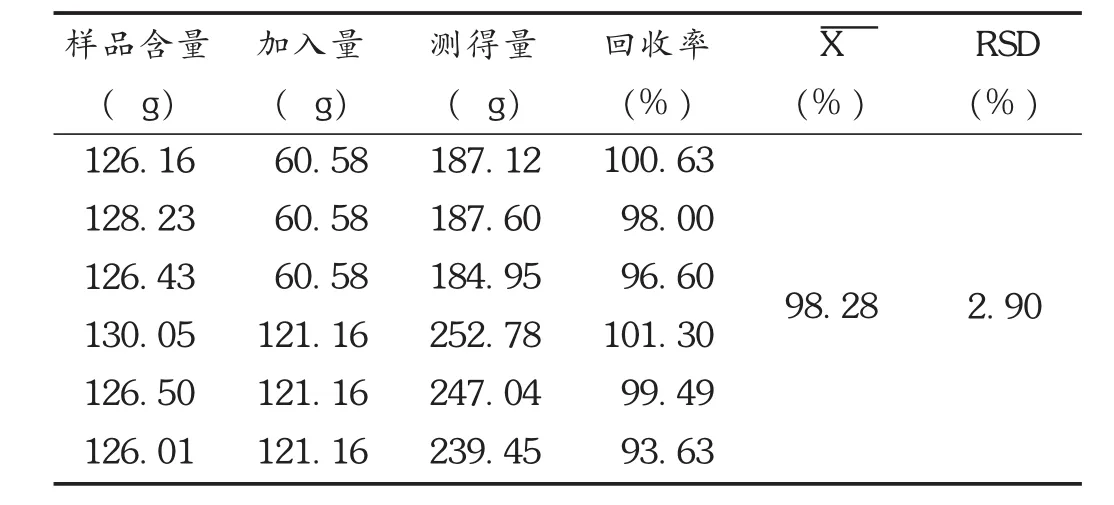
表1 胆红素加样回收试验结果(n=6)
2.4 样品含量测定
对 8 批样品(批号分别为 10011,10021,10031,10041,10051,10061,20071,20081)按已确定的试验方法及色谱条件进行测定,结果每粒样品中胆红素的含量分别为22.49,14.04,16.12,13.24,27.09,15.56,26.39,26.16μg。
3 讨论
3.1 溶液稳定性

胆红素见光易分解且不稳定,故溶液制备过程应避光,临用时新制。在进行溶液的稳定性试验时,测定了制备液每隔2 h的峰面积响应值,结果显示,胆红素峰面积响应值逐渐降低,收集峰面积响应值的 RSD在4 h内为2.0%,8 h内为3.9%,12 h内为 5.3%,测定值在 4 h时降低 3.8%,8 h时降低8.6%,12 h时降低12.3%。故溶液制备好后应在4 h内完成测定。
3.2 提取溶剂
本研究中分别用二氯甲烷、水饱和二氯甲烷、三氯甲烷、三氯甲烷 -甲醇 -盐酸 -水(90∶10∶0.015 ∶0.3)、二氯甲烷 -甲醇 -10% 草酸(100 ∶10 ∶0.1)5 种溶剂进行提取,结果三氯甲烷-甲醇-盐酸-水(90∶10 ∶0.015 ∶0.3)作为提取溶液时测定值最高。
3.3 方法优越性
2015年版《中国药典(一部)》人工牛黄项下胆红素的测定方法为紫外-可见分光光度法,以三氯甲烷作溶剂提取,提取不完全,且测定时易被空气氧化,方法专属性较差,存在一定局限性。薄层色谱扫描法用于人工培植牛黄和天然牛黄中胆红素的定量分析也有报道,该方法专属性和重复性均欠佳,不能保证测定结果准确[5-6]。另外,还有研究通过差示分光光度法测定中成药中胆红素的含量[7],以及通过间接光度法和流动注射分光光度法测定人工牛黄中胆红素的含量[8-9],此2种方法因显色及试验条件局限,均未得到广泛应用。而HPLC法因其方法简便、高效,测定结果精确可靠等优点而得到广泛认可,已成为检测牛黄及其替代品中胆红素的首选方法[10-14]。
3.4 方法合理性
人工牛黄药材由各种原料按照一定比例配置而成,本次试验中收集到的6批不同产地的人工牛黄中胆红素含量介于0.607% ~0.784%。有文献报道,以氯仿-冰醋酸(4∶1)为提取溶剂超声提取,测得人工牛黄中胆红素的含量介于 0.71% ~0.78%[15];以二甲基亚砜超声提取,测得人工牛黄中胆红素的含量为0.472%[16]。故各结果基本相符。
3.5 转移率及含量范围
2015年版《中国药典(一部)》要求人工牛黄中胆红素的含量不得低于0.63%,按此含量及处方量计算,每粒小儿化毒胶囊应含有胆红素 29.99 μg。批号为2016124的小儿化毒胶囊人工牛黄含量为0.607%,按此含量及处方量计算每粒胶囊含有胆红素28.89 μg。以其为原料制成的3批样品的含量分别为每粒26.16,26.39,27.09 μg,按每粒装量为 0.3 g 计算,转移率分别为 90.6% ,91.3% ,93.8% 。按 70% 转移率计算,每粒含量为20.2 μg。参考以上测定结果、生产工艺及批间差异,拟规定小儿化毒颗粒每粒含人工牛黄以胆红素(C33H36N4O6)计,不得少于 18 μg。
参考文献:
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:5.
[2]Zahi RF,Rabbani G,Khan RH,et al.The pharmacological features of bilirubin:the question of the century[J].Cell Mol Biol Lett,2015,20(3):418 - 447.
[3]Jangi S,Otterbein L,Robson S.The molecular basis for the immunomodulatory activities of unconjugated bilirubin[J].Int J Biochem Cell Biol,2013,45(12):2843 - 2851.
[4]黄海萍,谭桂山.人工牛黄中胆红素研究进展[J].中国药事,2005,19(2):50 - 52.
[5]韩咸泰,韩来敏.人工培植牛黄中主要成分的薄层色谱扫描法[J].药学学报,1986,21(11):864 - 867.
[6]王芳生,赵英举,李竟成,等.薄层扫描法测定人工诱生牛黄中主要成分的含量[J].兽医大学学报,1989,9(4):331 -336.
[7]倪坤仪,屠树滋,俞 兵,等.差示分光光度法测定牛黄类中成药中胆红素的含量[J].药学学报,1990,25(10):763 -768.
[8]楼朱雄,吴韶铭,袁月飞.人工牛黄中胆红素的间接光度测定[J].药物分析杂志,1995,15(3):50 - 51.
[9]吴韶铭.人工牛黄中胆红素的流动注射分光光度法测定[J].中国医药工业杂志,2000,31(9):25 - 26.
[10]徐丽婷,丁静慧,孙泰俊,等.高效液相色谱法测定人工牛黄药材及制剂中胆红素含量[J].医药导报,2004,23(1):49-50.
[11]方建国,王文清,蒋 平,等.反相高效液相色谱法测定体外培育牛黄中胆红素的含量[J].医药导报,2006,25(7):694-695.
[12]Kong WJ,Jin C,Xiao XH,et al.Determination of multicomponent contents in Calculus Bovis by ultra performance liquid chromatography-evaporative light scattering detection and its application for quality control[J].J Sep Sci,2010,33(10):1518 -1527.
[13]丘振文,钟 瑜,罗丹冬,等.高效液相色谱法测定解毒西黄丸中人工牛黄的胆红素含量[J].中药新药与临床药理,2011,22(6):666 - 668.
[14]曹 帅,夏 晶,杨新华,等.3种牛黄及安宫牛黄丸中总胆红素含量测定方法的优化[J].药物分析杂志,2014,34(2):329-334.
[15]罗珍妹,陈晓玲.高效液相色谱法测定人工牛黄中胆红素的含量[J].海峡药学, 2010,22(6):48 - 50.
[16]李 珂,齐永秀,高允生,等.HPLC法测定3种牛黄中胆红素的含量[J].今日药学,2010,20(3):17 -19.

