Ⅱ型谷氨酰胺转氨酶对缺氧骨肉瘤MG-63细胞凋亡的影响*
马 薇,张书勤,魏 柏,丰小敏
(华中科技大学同济医学院附属梨园医院肿瘤科,湖北 武汉 430077)
细胞Ⅱ型谷氨酰胺转氨酶(transgiutaminase2,TG2)在缺氧刺激下可异常表达升高,并在肿瘤细胞的增殖、分化、转移和凋亡过程中发挥重要作用[1],有促凋亡和抗凋亡的双重作用。王建新[2]采用HEK293细胞体外实验发现,TG2抗凋亡机制可能与减少Bax产生,抑制Caspase-3和Caspase-9表达,降低细胞核内细胞色素C转导入胞浆水平,以及钙超载诱导线粒体膜的去极化过程等密切相关[2]。但其在骨肉瘤细胞中能否同样发挥抗凋亡作用,以及具体的作用机制研究还较少。本研究中通过构建骨肉瘤细胞体外缺氧培养模型,探讨缺氧条件下骨肉瘤MG-63细胞凋亡与TG2表达的关系,以及TG2抗凋亡机制与细胞色素C和Caspase-3表达的关系。
1 材料与方法
1.1 细胞株、试剂和主要仪器
骨肉瘤细胞株MG-63(中国科学研究院);鼠抗人TG2,细胞色素 C,Caspase-3单克隆抗体(美国 San Cruze公司),AP碱磷酶标记抗小鼠IgG和过氧化物酶标记羊抗鼠IgG的二抗(北京中杉生物技术公司);FAC Sort流式细胞仪(美国BD公司)。
1.2 实验方法
1.2.1 细胞培养
细胞置含10%小牛血清的RPMI-1640培养液(美国Sigma公司)培养,在5%CO2、37℃及饱和湿度的培养箱中培养24 h,然后用0.25%胰酶消化、传代。取对数生长期细胞进行实验。
1.2.2 缺氧模型构建
细胞置 CO2缺氧培养箱(5%CO2、95%N2)中、37 ℃下培养24 h。
1.2.3 分组与细胞转染
取对数生长期细胞,重悬细胞浓度为5×105/孔接种至2 mL接孔板(美国Bio-Rad公司)中,待细胞长至90%以上时分为单纯缺氧组和TG2 siRNA缺氧组,共培养 12 h。siRNA转染:纯化 siRNA分子由江苏碧云天科技有限公司完成。TG2转染组的siRNA序列为(F)5′- GCGGGATCCGCCAGATCATTA - 3′,(R)5′- TA CGCCCTUGGTGGCCUTGTU-3′。对照组 siRNA序列为(F)5′- UATCGAGUACACTCAUGATCU - 3′,(R)5′- UT GATGUCUUTAGTCCCTATU-3′。按照 Dharmafect 3试剂盒步骤进行转染,进行下一步实验。
1.2.4 观察指标和检测方法
微量滴定板法测定TG活性[1]:缺氧条件细胞培养12 h后,采用5-生物素酰氨基戊胺(BP,美国R&D公司)标记。4℃、20 000 g超速离心10 min,使用细胞提取物包被96孔的微量滴定板(美国Bio-Rad公司)于4℃,含5%牛血清蛋白的磷酸盐缓冲液(PBS)中封闭1 h。然后采用辣根过氧化物酶标记链霉亲和素(北京中杉生物技术公司)于37℃孵育45 min,PBS洗涤5 min×3次。微量滴定板中加入邻苯二胺盐酸盐于室温下显色10 min,1 mol/L硫酸终止反应。显色后采用微孔板分光光度计(美国GE公司)于490 nm波长处测量吸光度(A)值。实验进行3次,取平均值。
RT-PCR法测定TG mRNA相对表达水平[2]:常规Tizol法(美国Santa Cruz公司)提取总RNA,紫外分光光度法测定其浓度和纯度,逆转录试剂盒(北京中杉生物技术公司)合成 cDNA,PCR扩增 TG2序列为(F)5′-GGGGTGAGAGAGGAAAGACC - 3′,(R)5′- TGCAGTCTAGGGAGCTGGAT -3′,167 bp;内参 β -actin序列为(F)5′-TGACGTGGACATCCGCAAAG -3′,R:5′-CTGGA AGGTGGACAGCGAGG -3′,245 bp。反应参数为 94℃2 min,94 ℃ 30 s、54 ℃ 30 s、72 ℃ 1 min,35 个循环,72℃ 10 min终止反应。取扩增产物 10 μL用 1.2%琼脂糖电泳鉴定产物,分析条带灰度值,结果以2-△△Ct法表示。
Western Blot法[3]测定三酰甘油(TG)、细胞色素 C和Caspase-3蛋白水平:常规方法抽提细胞核和细胞浆总蛋白,考马斯亮兰蛋白定量测定浓度和纯度。取适量样本蛋白置十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳,然后电转移至硝酸纤维素膜上封闭,漂洗。分别加入鼠抗人TG2、Bax及cytC单克隆抗体一抗(北京中杉金桥生物有限公司,1∶1 000稀释),4℃孵育过夜,再加入兔抗鼠多克隆抗体二抗(北京中杉金桥生物有限公司,1∶500),37℃避光孵育 1 h,丽春红显色,显微镜下观察、拍照。
Sub-G1法检测凋亡细胞[4]:胰酶消化,取 2×105个细胞,70%乙醇固定,4℃孵育过夜。PBS漂洗,溴化丙啶染色,1 h内于FAC Sort流式细胞仪上检测。
1.3 统计学处理
2 结果
结果见表1和表2。单纯缺氧组细胞凋亡率显著低于 TG2 siRNA 缺氧组[(21.3 ±4.4)%vs(42.6 ±8.7)%,t= 5.758,P = 0.031 < 0.05]。
表1 两组TG2活性、蛋白及mRNA水平比较()
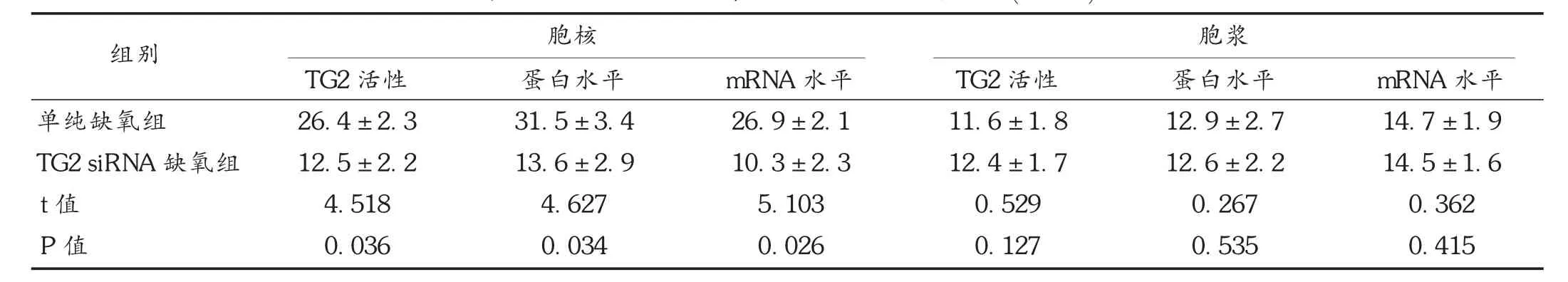
表1 两组TG2活性、蛋白及mRNA水平比较()
组别 胞核胞浆单纯缺氧组TG2 siRNA缺氧组t值P值TG2活性26.4 ± 2.3 12.5 ± 2.2 4.518 0.036蛋白水平31.5 ± 3.4 13.6 ± 2.9 4.627 0.034 mRNA水平26.9 ± 2.1 10.3 ± 2.3 5.103 0.026 TG2活性11.6 ± 1.8 12.4 ± 1.7 0.529 0.127蛋白水平12.9 ± 2.7 12.6 ± 2.2 0.267 0.535 mRNA水平14.7 ± 1.9 14.5 ± 1.6 0.362 0.415
表2 两组细胞色素C和Caspase-3蛋白水平比较()

表2 两组细胞色素C和Caspase-3蛋白水平比较()
组别 胞核 胞浆单纯缺氧组TG2 siRNA缺氧组t值P值细胞色素C 31.6 ± 2.5 13.5 ± 2.3 5.174 0.023 Caspase-3 26.7 ± 1.8 12.6 ± 1.5 4.926 0.035细胞色素C 5.6 ± 0.4 17.9 ± 2.1 6.517 0.014 Caspase-3 4.9 ± 0.6 16.6 ± 1.5 6.238 0.016
3 讨论
TG2在胞浆、胞核、线粒体、细胞膜表面及细胞外基质中均有大量表达。TG2在Ca2+依赖的催化蛋白交联活性,三磷酸鸟苷(GTP)依赖的G蛋白功能,蛋白二硫键异构酶活性和蛋白激酶功能表达方面均发挥重要作用[3]。此外,TG2在多种恶性肿瘤细胞的生物学行为中扮演重要角色。但目前针对TG2在细胞凋亡中的作用仍无统一看法。部分研究认为,TG2主要表现促凋亡功能。缺氧条件下细胞表达一系列高水平活性氧簇(ROS),进而促使大量Ca2+进入细胞内,胞浆内钙超载,诱导TG2酶学活性增强,进而启动细胞凋亡程序的发生[4]。也有研究指出,TG2高表达并不与凋亡程度一致。肺癌、结直肠癌、肝癌等数个恶性增殖肿瘤细胞系在体外诱导TG2过表达后,细胞凋亡率并未明显增加[5]。Jang等[6]的研究证实,TG2发挥促凋亡作用可能与其水平有关,当TG2明显消耗降低后可导致细胞周期停止而进入凋亡。蔺会云等[7]研究指出,TG2表达升高可能促进肾癌细胞增殖,抑制凋亡。细胞核内聚集的TG2(R580A)可以抵消胞浆内TG2的促凋亡作用。因此,假设TG2在不同条件下可发挥促凋亡和抗凋亡双重作用,其倾向哪一方及作用强弱可能与细胞类型、作用条件及TG2在细胞内的定位和构型等不同有关[8]。本研究结果显示,缺氧条件下,胞核中TG2显著增多,而胞浆中变化不明显。TG2活性增强,mRNA和蛋白表达水平明显增加,随缺氧时间延长逐渐增高。单纯缺氧组胞核中TG2活性、蛋白及mRNA水平均显著高于TG2 siRNA缺氧组,差异有统计学意义,而胞浆中两组比较,差异无统计学意义。提示缺氧条件下胞核中TG2的表达可能参与抗凋亡过程,而胞核中TG2更多地参与促凋亡过程。
骨肉瘤细胞凋亡途径主要有2条,即死亡受体配体途径和线粒体途径。其中线粒体途径是细胞内主要的凋亡机制,具体过程为细胞受胞内外各种凋亡刺激因子作用,诱导线粒体释放细胞色素C,胞浆中细胞色素C与凋亡蛋白酶活化因子-1(Apaf-1)结合形成多聚体;进而趋化Caspase-9前体形成凋亡小体,Caspase-9激活后可进一步促进下游Caspase-3活化,加速凋亡进程[9]。Caspases-3是 Caspases家族介导细胞凋亡的关键分子,是各种凋亡途径的终末效应分子。胞浆中无活性状态的Caspases-3以酶原形式存在,凋亡启动的早期阶段即可被迅速、大量激活,活化状态的Caspase-3结构组成有2个大亚基和2个小亚基,作用底物分布在胞浆和胞核中,通过多种效应分子介导的信号转导途径,最终诱导细胞凋亡[10]。胡岳等[11]研究证实,TG2在促凋亡过程中,同样可以与细胞核、细胞质及线粒体内的一些蛋白形成非共价复合物,然后与Caspase-3形成不溶性复合物,进而抑制其活性,抑制凋亡进程的进一步扩大。其遏制凋亡发生及级联扩增是不依赖TG2转化酶功能,而可能与TG2的细胞定位与分子结构构象不同有关[12]。本研究结果提示,单纯缺氧组Caspase-3活性水平无明显增加,而siRNA转染缺氧组通过直接抑制 TG2表达水平,导致 Caspase-3活性及其蛋白相对表达水平显著升高,细胞凋亡率也随之上升。由此说明,细胞缺氧状态可诱导TG2的异常高表达,介导Caspase-3活性下降而发挥抗细胞凋亡表达[13]。
本研究中发现,单纯缺氧组胞核中细胞色素C和Caspase-3蛋白水平显著高于TG2 siRNA缺氧组,胞浆中含量及细胞凋亡率显著低于TG2 siRNA缺氧组,提示缺氧条件下TG2可抑制骨肉瘤细胞色素C和Caspase-3由线粒体向胞浆内释放,起到抗凋亡作用[14]。
综上所述,缺氧条件下TG2高表达有抑制MG-63骨肉瘤细胞凋亡的作用,可能与抑制胞核中细胞色素C和Caspase-3向胞浆中转移有关,可能成为治疗骨肉瘤的新干预靶点。下一步研究可在动物模型中进行验证。
参考文献:
[1]蔡文涛,夏 虹,沈宁江,等.Ⅱ型谷氨酰胺转氨酶对骨肉瘤MG-63细胞凋亡的抑制作用及其机制[J].吉林大学学报(医学版),2014,40(4):782 - 789.
[2]王建新.TG2对缺氧条件下骨肉瘤MG-63细胞凋亡的影响[J].广东医学,2015,36(13):1996 - 2000.
[3]Hsieh YF,Liu GY,Lee YJ,et al.Transglutaminase 2 contributes to apoptosis induction in Jurkat T cells by modulating Ca2+homeostasis viacross- linking RAP1GDS1[J].PLoSOne,2013,8(12):e81516.
[4]Lee HJ,Lee CH.Transglutaminase 2 is involved in expression of osteoprotegerin in MG -63 osteosarcoma cells[J].Biomol Ther(Seoul),2013,21(3):204 - 209.
[5]Cho SY,Lee JH,Bae HD,et al.Transglutaminase 2 inhibits apoptosis induced by calcium-overload through down-regulation of Bax[J].Exp Mol Med,2010,42(9):639 - 650.
[6]Jang GY,Jeon JH,Cho SY,et al.Transglutaminase 2 suppresses apotosis by modulating caspase 3 and NF-kappaB activity in hypoxic tumor cells[J].Oncogene,2010,29(3):356 - 367.
[7]蔺会云,陆应麟.组织型谷氨酰胺转氨酶在肿瘤生物学中的作用[J].军事医学科学院院刊,2006,30(4):382 - 385.
[8]Nurminskaya MV,Belkin AM.Cellular functions of tissue transglutaminase[J].Int Rev Cell Mol Biol,2012,294(1):1 - 97.
[9]王玉峰,王岩峰,胡春吉,等.NF-κB抑制剂PDTC对人骨肉瘤MG-63细胞凋亡及Livin和Caspase-9表达的影响[J].中国矫形外科杂志,2011,19(7):589 -591.
[10]邓 超,曲国蕃.XIAP和Caspase-3在骨肉瘤中的表达及其意义[J].哈尔滨医科大学学报,2010,44(2):156 - 159.
[11]胡 岳,王 涌,邱江锋.组织型转谷氨酰胺酶在肿瘤发生、发展、侵袭和转移中的作用及其作用机制的研究进展[J].肿瘤,2013,33(9):831 - 836.
[12]Mehta K,Kumar A,Kim HI.Transglutaminase 2:a multi- tasking protein in the complex circuitry of inflammation and cancer[J].Biochem Pharmacol,2010,80(12):1921 - 1929.
[13]Kumar S,Mehta K.Tissue transglutaminase,inflammation,and cancer: how intimate is the relationship?[J].Amino Acids,2013,44(1):81 - 88.
[14]李 梅,张 余.细胞凋亡与骨肉瘤[J].中国骨科临床与基础研究杂志,2011,3(4):299 -303.

