脱细胞猪小肠黏膜下层基质中纤维连接蛋白定量检测方法研究
陈 毅, 夏磊磊, 张 扬, 高建萍, 李赛娜, 雷雄心, 李勇超, 张贵锋, 赵 博
(1. 北京博辉瑞进生物科技有限公司, 北京 100026; 2. 中国科学院 过程工程研究所 生化工程国家重点实验室, 北京 100190; 3. 河南科技学院 生命科技学院,新乡453003)
脱细胞小肠黏膜下层基质(SIS,Small intestinal submucosa)是以猪小肠黏膜下层为原料,通过脱细胞、成型和灭菌等工艺制备而成的膜状材料,广泛用于肌腱、硬脑膜、腹壁和皮肤等组织的修复或重建,具有生物相容性高、生物可降解和可吸收等优点[1-2]。临床应用结果表明SIS可有效诱导细胞黏附生长、术后并发症少且感染率低[3-5],证实了SIS是一种无免疫排斥的动物源性植入材料。
SIS作为一种脱细胞基质,其主要成分为Ⅰ、Ⅲ型胶原和少量的其他类型胶原;同时还包含少量的纤维连接蛋白(Fibronectin,FN)、层黏连蛋白和生长因子等生物活性成分[6]。FN是一种以二硫键连接的二聚体(220 ku)形式存在的糖蛋白,可由成纤维细胞、肌细胞和内皮细胞等多种细胞分泌。不同动物来源FN的分子量、三维结构及生物学性能没有显著差异[7]。FN与多种细胞包括成纤维细胞和内皮细胞等表现出黏附和迁移特性,具有细胞外黏合剂的美称[8]。FN在胚胎生成、伤口愈合和止血等过程中发挥关键性作用,其表达和降解过程异常与许多疾病诸如心血管病和肿瘤转移等密切相关[9-10],因此,脱细胞基质中FN的含量直接影响SIS的生物活性。因此,研究并建立脱细胞基质中FN的检测方法具有重要实用价值。
文献报道的FN检测方法有多种[11-14],其中最为常用的是ELISA法,该方法主要用于血浆型FN的检测。SIS中的FN属于组织型并以结合形式存在,直接采用ELISA方法则抗体难以直接与FN结合,非特异性吸附也会影响结果的准确度,导致检测结果与实际含量存在较大偏差。基于质谱的蛋白质检测方法用于低丰度蛋白的定量分析具有灵敏度高、重复性好等优点,可根据蛋白质降解产物中的多肽丰度进行无标记定量检测,但该方法直接用于SIS中FN的检测则存在序列特异性酶难以直接降解等难度,导致这些方法存在一定局限性。
针对脱细胞基质中FN检测存在的问题,本研究拟建立一种基于酶解和质谱分析的FN定量检测方法,实现首先采用胶原酶将SIS进行降解,通过胰蛋白酶将FN进行定向酶解获得FN特征多肽,再采用HPLC-MS进行含量检测,并对该方法的线性范围、精密度、稳定性进行验证。
1 材料与方法
1.1 材料与仪器
1.1.1材料
SIS(VIDASISTM)由北京博辉瑞进生物科技有限公司提供;SIS(Biodesign®)购自美国库克公司;Ⅰ型胶原酶(分析纯)购自北京欣经科生物技术有限公司;胰蛋白酶(序列纯)购自美国Promega公司;Fibronectin购自美国CALBIOCHEM公司。
1.1.2主要仪器
HC-2518R高速冷冻离心机,安徽中科中佳科学仪器有限公司;LGJ-100F真空冷冻干燥机,北京松源华兴科技发展有限公司;高效液相色谱-质谱联用系统(HPLC-MS)由美国Agilent公司1100液相色谱和美国Thermo Fisher公司LCQ DecaXP电喷雾质谱组成,数据采集与处理软件为Xcalibur 1.3;液相色谱-三重四级杆质谱联用系统由美国Thermo Fisher公司U3000液相和TSQ Quantum ACCESS MAX质谱组成,数据采集与处理软件为Xcalibur 1.3。
1.2 实验方法
1.2.1SIS降解实验
静态酶解:称取100 mg SIS,加入100 mL 缓冲液(50 mmol/L Tris-HCl,0.36 mmol/L CaCl2,pH 7.4),100℃热变性处理10 min,冷却至室温后加入1 mL胶原酶溶液(1 mg/mL HBSS缓冲液),37℃水浴震荡,10 000 r/min离心3 min,收集上清液。
分批次酶解:称取100 mg SIS,加入8 mL 缓冲液(50 mmol/L Tris-HCl,0.36 mmol/L CaCl2,pH 7.4),100℃热变性处理10 min,冷却至室温后加入200 μL胶原酶溶液(1 mg/mL HBSS缓冲液), 37℃酶解1 h,10 000 r/min离心3 min,收集上清液,沉淀加入200 μL胶原酶溶液和8 mL缓冲液,重复上述操作5次,收集所有上清液。
1.2.2胰蛋白酶酶解实验
将SIS的胶原酶降解产物冷冻干燥,使用50 mmol/L NH4HCO3溶液(pH 8.0)配置成4 mg/mL的溶液,加入20 μL浓度为1 μg/μL的Trypsin溶液(50 mmol/L NH4HCO3,pH 8.0),37℃酶解12 h,酶解产物直接进行HPLC-MS检测。
1.3 分析方法
1.3.1氨基酸组成分析
SIS及其酶解产物的氨基酸组成分析方法参照文献[15]。
1.3.2HPLC-MS分析
色谱柱为Zorbax SB C18[150×2.1 mm(I.D.),5 μm];流动相A:水(含0.1%甲酸),B:乙腈(含0.1%甲酸);梯度0~80 min,5%~50%乙腈;80~90 min,50%~90%乙腈,进样量50 μL;UV:214 nm;流速0.2 mL/min。离子阱质谱条件:离子源喷雾电压4.5 kV,毛细管温度300℃,扫描范围m/z 400~2000。精确质量数扫描和二级质谱扫描均为数据依赖型扫描,碰撞能量为35%。
三重四极杆质谱条件:离子源喷雾电压3.5 kV,毛细管温度300℃,蒸发温度:200℃,壳气:35 arb,辅助气:8 psi,扫描方式为选择离子监测,m/z 957.5。
2 结果与讨论
2.1 SIS降解方法研究
FN与胶原具有较高的结合特性,在细胞外基质中以与胶原结合的状态存在[16],传统方法难以有效检测出脱细胞基质中的FN。为能使FN从结合状态转变为游离状态并进一步被酶解,实验首先研究了FN的释放方法。图1是不同酶解方式降解过程中SIS残留量的动态变化曲线。采用静态酶解法加入胶原酶后溶液中SIS残留量逐渐降低,酶解24 h后降解率仅为60%,降解3 d后仍有10%的SIS未被降解,4 d后残留量趋于稳定,溶液中残留不能被降解的絮状物(图1)。氨基酸分析结果表明,残留物中几乎不含有羟脯氨酸,表明SIS中的胶原成分被有效降解。但是采用该方法降解SIS的过程耗时长,且存在易染菌、酶失活以及随机降解率高等问题。为了提高酶解效率,实验尝试了分批次降解的方式,即降解一定时间后进行固液分离,沉淀物重新酶解。SIS残留量在前3次降解过程中变化较明显,第1次换液时残留量为70%,第2次换液时残留量为50%,第3次换液时残留量约为30%(图1),该过程重复5次后SIS酶解较为完全。为了最大程度减少样品中蛋白损失,实验在分批次降解过程中降解次数增加至6次。
2.2 基于质谱的检测方法
2.2.1FN特征多肽筛选
FN经序列纯胰蛋白酶处理后产生大量低分子量多肽;实验对多肽进行了BLAST序列比对,只在猪源FN数据库被检出的肽段为猪源FN的特征多肽;酶解后的多肽质谱信息用SEQUEST软件进行数据库搜索,多肽过滤参数为Xcorr>1.5(单电荷),Xcorr>2.0(单电荷),同时Deltacn>0.1,则所产生的肽段被认为是阳性结果。在HPLC-MS分析的质谱图中提取特征多肽的离子流图,低浓度样品可提取到且丰度较高,同时信噪比S/N>10,即适合作为特征多肽。

图1静态酶解和分批次酶解过程中SIS残留量的动态变化
将胰蛋白酶酶解后的猪源FN用离子阱质谱(LCQ)进行全扫描分析,得到猪源FN酶解多肽的总离子流图(图2)。采用BLAST多序列比对发现猪源FN存在一定数量的特征多肽,再用Bioworks软件搜索猪源FN降解后的多肽质谱信息,筛选具有阳性结果的多肽段,根据BLAST多序列比对和Bioworks软件搜库结果选定多肽SSPVVIDASTAIDAPSNLR为猪源FN的特征多肽,其丰度和二级碎片匹配度均较高。图3和图4分别为该多肽的提取离子流图(含一级质谱图)和二级质谱图,二级碎片离子与理论值匹配度较高。因此,可选择该多肽作为特征多肽,用于猪源FN类型识别及定量检测。
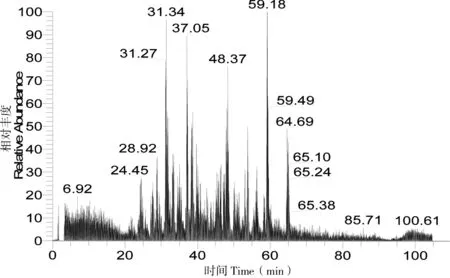
图 2 猪源FN酶解产物总离子流图
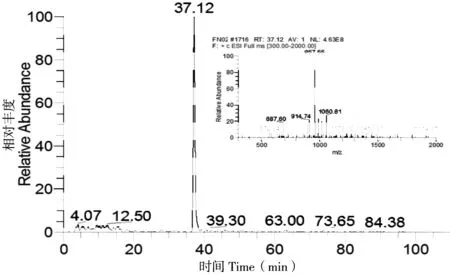
图 3 特征多肽的提取离子流图和一级质谱图
2.2.2猪源FN浓度与特征多肽信号强度关系
取不同浓度经变性酶解处理的猪源FN标准品溶液,从低浓度到高浓度依次进样50 μL,按HPLC-MS定量检测条件分析,监测目标离子m/z=957.5,获得不同浓度猪源FN特征多肽的提取离子流图(图5),按照所选特征多肽提取离子流图峰面积为纵坐标、猪源FN标准品浓度为横坐标进行线性回归(图6),回归方程为y=4109.5x-12.82(R2=0.995),在0.0024~0.048 g/L浓度范围内二者线性关系良好。

图 4 特征多肽的二级质谱图

图5 不同浓度的猪源FN特征多肽的提取离子流图
A、B、C、D和E分别为0.0024、0.0048、0.0096、0.0192及0.048 mg/mL
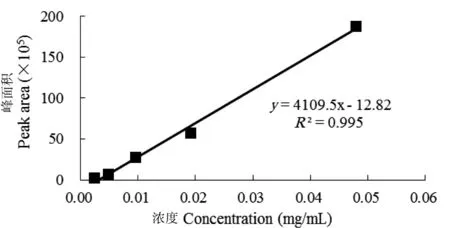
图 6 猪源FN标准品浓度与信号强度关系曲线
2.2.3SIS中FN含量检测结果
称取50 mg SIS(VIDASISTM)加入胶原酶分5次酶解,合并5次酶解的上清液,冷冻干燥,得到123 mg冻干物(含提取液里的盐类物质),取4 mg冻干后的产物复溶,利用胰蛋白酶酶解,酶解产物按照HPLC-MS定量检测方法进行分析,根据FN特征多肽的提取离子流色谱峰面积计算,样品溶液中FN的浓度为0.007 mg/mL,则SIS中FN的含量为0.43%。采用相同的测定方法,SIS(Biodesign®)中FN的含量测定结果为0.17%。
2.3 精密度与稳定性验证
2.3.1线性范围
将同一样品稀释成不同的浓度,分别为2.4、4.8、9.6、19.2、48、96和192 μg/mL,通过HPLC-MS检测其纤维连接蛋白含量,根据浓度梯度和峰面积关系,确定峰面积呈线性的浓度范围(图7)。实验结果表明本方法的线性程度较高。

图 7 FN质谱检测方法的线性范围
2.3.2精密度
精确量取FN标准品100 μL,按定量HPLC-MS条件进行分析,重复进样3次,结果(如图8)显示,FN标准品中特征多肽的峰面积相对偏差RSD为1.31%,表明本方法精密度良好。

图 8 FN质谱检测方法的精密度分析
2.3.3稳定性
将样品分别于-20℃保存,于10、20和30 d时间用FULL SCAN测定3次样品,其峰面积分别为3.82×108、3.45×108和3.16×108,保存30 d的样品峰面积略微减小,表明该方法具有较高的稳定性。
3 结论
FN作为细胞外基质重要组成部分,具有诸多生物学活性功能。采用分批次酶解和液质联用技术对SIS脱细胞基质材料中FN含量进行了定量检测。针对SIS的胶原酶酶解方案进行优化,消除了时间长,效率低等弊端,将胶原酶酶解时间由96 h降为6 h,大大地提高了酶解效率。实验中FN经Trypsin特异性酶解所得的特征多肽为SSPVVIDASTAIDAPSNLR,采用HPLC-MS对FN中这一特征多肽定量检测,准确地得到SIS中FN的含量。这种方法操作简便,且适用于组织中FN的检测。结果表明VIDASISTM和Biodesign®两种脱细胞材料中FN的含量分别为0.43%和0.17%。方法学实验证明该方法精确度较高,误差较小,并且不同浓度积分出的峰面积线性关系良好。该研究表明,液质联用技术可以准确测定脱细胞基质中FN的含量。
[1]HOEPPNER J, CRNOGORAC V, MARJANOVIC G, et al. Small intestinal submucosa as a bioscaffold for tissue regeneration in defects of the colonic wall [J]. Journal of Gastrointestinal Surgery, 2009, 13(1): 113-119.
[2]ZHAO L, ZHAO J L, WAN L, et al. The study of the feasibility of segmental bone defect repair with tissue-engineered bone membrane: a qualitative observation [J]. Strategies in Trauma and Limb Reconstruction, 2008, 3(2): 57-64.
[3]ZHANG F, LIAO L. Tissue engineered cystoplasty augmentation for treatment of neurogenic bladder using small intestinal submucosa: an exploratory study [J]. The Journal of Urology, 2014, 192(2): 544-550.
[5]VALENTE P, GOMES C, TOMADA N. Small intestinal submucosa grafting for peyronie disease: outcomes and patient satisfaction [J]. Urology, 2017, 100: 117-124.
[6]LINDBERG K, BADYLAK S F. Porcine small intestinal submucosa(SIS): a bioscaffold supporting in vitro primary human epidermal cell differentiation and synthesis of basement membrane proteins [J]. Burns, 2001, 27(3): 254-266.
[7]查锡良. 生物化学[M]. 7版. 北京: 人民卫生出版社, 2008: 465.
[8]ZOLLINGER A J, SMITH M L. Fibronectin, the extracellular glue [J]. Matrix Biology, 2017,60-61:27-37.
[9]ROZARIO T, DESIMONE D W. The extracellular matrix in development and morphogenesis: a dynamic view [J]. Developmental Biology, 2010, 341(1): 126-140.
[10]TSANG K Y, CHEUNG M C, CHAN D, et al. The developmental roles of the extracellular matrix: beyond structure to regulation [J]. Cell and Tissue Research, 2010, 339(1): 93-110.
[11]TRIPATHI R, TYAGI S, MALA Y M, et al. Comparison of rapid bedside tests for phosphorylated insulin-like growth factor-binding protein 1 and fetal fibronectin to predict preterm birth [J]. International Journal of Gynecology and Obstetrics, 2016, 135(1): 47-50.
[12]杨静静, 蒋洪敏, 唐爱国. 纤维结合蛋白在肝纤维化检测中的意义 [J]. 检验医学, 2014, 29(4): 331-336.
[13]高 玲, 颜绵生, 冯品宁, 等. 化学发光法与免疫透射比浊法检测血清纤维连接蛋白的方法评价 [J]. 热带医学杂志, 2011, 11(9): 1026-1028.
[14]周 超, 张慧婷, 陈俊英, 等. 用Micro BCA方法定量检测硅烷化表面固定的纤维连接蛋白 [J]. 功能材料, 2011, 42(11): 2038-2041,2046.
[15]高 杨, 董秀萍, 肖桂华, 等. 海参体壁酸溶性胶原提取及氨基酸组成分析 [J]. 食品与发酵工业, 2008, 34(11): 171-174.
[16]ERAT M C, SCHWARZ-LINEK U, PICKFORD A R, et al. Implications for collagen binding from the crystallographic structure of fibronectin 6FnI1-2FnII7FnI [J]. Journal of Biological Chemistry, 2010, 285(44), 33764-33770.

