细胞外液钙离子浓度的改变对大鼠比目鱼肌离体单一肌梭自发放电的影响
余 蕾, 赵雪红, 樊小力, 曹 健
(1. 西安医学院, 西安 710021; 2. 湖北文理学院 医学院机能学部, 襄阳 441053;3. 西安交通大学医学部, 西安 710016)
近年来我国载人航天事业蓬勃发展,已有多名宇航员被送入太空并开展了舱外活动。肌肉萎缩是中长期的载人航天飞行过程中宇航员经常会出现的一种情况,尤其是下肢抗重力肌的萎缩。肌肉萎缩极大地影响了宇航员在航天飞行过程中的作业能力,而其返回地面后肌肉萎缩无法立即缓解,易出现平衡障碍、无法站立等情况,严重影响其地面上的工作与生活[1-2]。大量研究表明,失重性肌肉萎缩始于肌梭的改变。模拟失重环境下,可见血钙升高并伴随肌梭传入放电的减少[3-4],而钙离子在肌梭电位的形成中起重要作用,两者之间是否存在联系目前尚未见相关报道。然而以往的研究多为在体研究,存在诸多影响因素,无法真实反映细胞外液钙离子对肌梭传入放电的影响。且以往多采用猫或蟾蜍作为研究对象,大鼠单一肌梭放电的相关研究则很少见。因此,本实验运用空气隔绝法,针对大鼠的比目鱼肌单一肌梭的自发放电活动进行了记录,观察含有不同钙离子浓度的细胞外液对肌梭自发传入放电及氯化琥珀胆碱(Succinylcholine chloride,Sch)所引起的诱发放电的影响,以进一步探索失重和/或模拟失重所导致的肌萎缩的发生机制,为失重所致肌萎缩的发生机制提供新的实验材料,为我国的航天事业服务。
1 材料与方法
1.1 实验动物与药品
实验用雄性SD大鼠(n=10)购自西安交通大学实验动物中心,每只体重在200~220 g之间。按体重配对原则随机将大鼠分为2组,即低钙改良任氏液组(CaCl2浓度为 0.9 mmol/L,以下简称低钙组)、高钙改良任氏液组(CaCl2浓度为3.6 mmol/L,以下简称高钙组)[7],每组5只,实验采用自身对照。Sch注射液(1 g/2 mL),购自上海旭东海普药业有限公司。
1.2 大鼠比目鱼肌单一肌梭标本的制备
腹腔注射戊巴比妥钠(45 mg/kg)麻醉大鼠,取一侧下肢比目鱼肌置于改良任氏液(CaCl2浓度为 1.8 mmol/L)中,水浴37℃,持续通氧。以聚光灯为光源,在双目解剖显微镜和倒置显微镜下,利用分离针分离肌梭。因肌梭与梭外肌平行排列,分离时应沿着肌肉长轴逐步剥离肌梭周围的梭外肌、血管等组织,直至分离出完整的肌梭及传入神经纤维(长度>3 mm)。
1.3 单一肌梭电活动记录
实验采用空气隔绝法记录单一肌梭传入放电。将肌梭按其初长度固定置于实验台中的R池,肌梭传入神经纤维搭入K池中,R池与K池之间存在0.3 mm的空气间隔。将改良任氏液充满实验台的各池,以琼脂盐桥分别连接A池与K池、B池和R池以构成回路,并用甘汞电极记录A池和B池之间电位差,输入记忆示波器(VC-11)观察肌梭的传入放电,同时输入计算机做序列密度直方图(图1)。R池中的改良任氏液持续通氧,实验中大鼠单一肌梭电活动的记录在屏蔽箱内完成。将制备好的肌梭标本放入屏蔽箱内通氧平衡10 min,而后给予低钙改良任氏液、高钙改良任氏液灌流,记录肌梭自发传入放电;给予50 mg/L Sch灌流,记录肌梭诱发放电情况。

图1 实验装置示意图
A:改良任氏液池;B:改良任氏液池;C: 地线;E:甘汞电极;F:肌梭; G:传入神经纤维;I:监听放大器
1.4 数据采集与统计分析

2 结果
实验观察了不同钙离子浓度的细胞外液对大鼠单一比目鱼肌肌梭传入放电的影响,结果如下。
低钙组:实验共记录12例肌梭放电。待肌梭放电稳定后观察并记录单一肌梭的传入放电。结果发现,肌梭在自然长度下有自发放电,其自发放电呈簇状出现,每簇放电之间存在一定的周期间隔。肌梭置于改良任氏液中其自发放电的平均频率为(0.08±0.02)Hz,峰值频率为(19.00±2.46)Hz,自发放电的周期间隔为(3.16±0.21)min。给予低钙改良任氏液灌流(8.89±0.92)min后,其自发放电频率增加为(0.23±0.05)Hz(P<0.01),峰值频率为(25.18±5.04)Hz,自发放电的周期间隔缩短为(1.57±0.25)min(P<0.01)(见图2和图3)。肌梭自发放电在灌流后(14.88±1.37)min恢复正常。而后给予50 mg/L Sch灌流,12例肌梭中仅3例放电增加,诱发阳性率为25%。诱发放电的平均频率为(0.13±0.03)Hz,峰值频率为(23.00±4.69)Hz,经统计学检验无显著性差异。
高钙组:实验共记录12例肌梭放电。肌梭置于改良任氏液中其肌梭自发放电的平均频率为(0.14±0.02)Hz,峰值频率为(22.67±2.87)Hz,自发放电的周期间隔为(2.61±0.27)min。给予高钙改良任氏液灌流(9.01±2.85)min后,自发放电频率减少为(0.05±0.01)Hz(P<0.01),峰值频率降为8.78±1.71Hz(P<0.01),自发放电的周期间隔延长为(5.28±1.01)min(P<0.05)(见图2和图4)。肌梭自发放电在灌流后(18.52±3.37)min恢复正常。而后给予50 mg/L Sch灌流,12例肌梭中仅4例放电增加,诱发阳性率为33.3%。诱发放电的平均频率为(0.08±0.02)Hz,峰值频率为(13.67±2.59)Hz,经统计学检验无显著性差异。
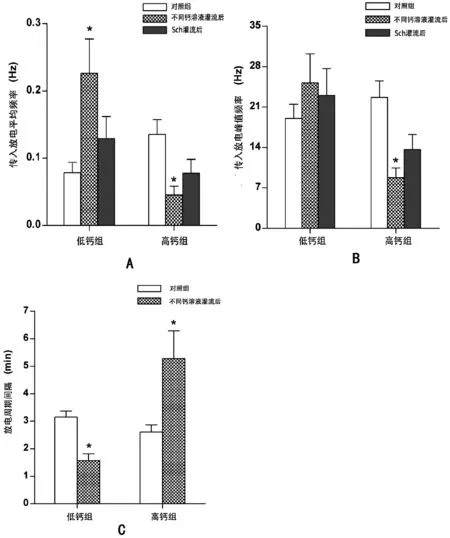
图2 不同浓度钙溶液对大鼠单一比目鱼肌肌梭传入放电的影响
A为平均频率(与对照组相比,下同),*:P<0.01;B为峰值频率,*:P<0.01; C为放电周期间隔,*:P<0.05
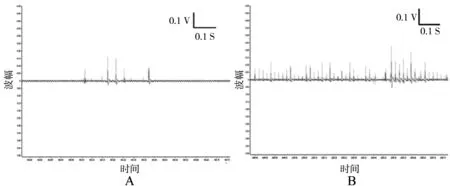
图3 低钙溶液对大鼠比目鱼肌离体单一肌梭传入放电的影响
A为对照组; B为低钙溶液处理组
3 讨论与结论
Ca2+在细胞外液、胞质、钙库之间不断移动,并在各部分维持着相对稳定的浓度,这便是钙稳态。钙稳态的维持涉及一系列复杂的机制,它是细胞能完成一系列生理功能和Ca2+信号生成与转导的基础。Ca2+可以上调“早期应答基因”c-myc和c-fos基因转录,并诱导其细胞膜受体表达增加,进而促进肌细胞有丝分裂以及细胞内蛋白质沉积,最终导致肌细胞肥大和增生。受“早期应答基因”的影响,还出现了肌细胞蛋白表型转换和幼稚型骨骼肌的生长[6]。失重或模拟失重可以导致人和动物发生明显的肌肉萎缩,其发生机制涉及神经、体液、血液循环等多系统的改变。在太空微重力的环境中,宇航员可发生明显的骨钙丢失、血钙增多,肌肉收缩能力下降[1-2]。这提示失重性肌萎缩的发生可能与细胞外液钙异常增多有关。

图4 高钙溶液对大鼠比目鱼肌离体单一肌梭传入放电的影响
A为对照组;B:为高钙溶液处理组
Ottoson和Fischer等用分离单一肌梭的方法分别对蛙和猫进行研究发现,改变细胞外液钙离子浓度,肌梭的传入放电和对牵拉的敏感性及适应性也发生相应的改变,且只有当肌梭外囊由感觉区域部分剥离时,钙离子才可引起传入冲动发生较强较快的改变,细胞外液钙离子浓度的改变对肌梭传入放电的影响与梭内肌纤维收缩无关[7-8]。该结论与本实验研究结果基本一致,在钙离子浓度为0.9mmol/L的细胞外液中肌梭自发传入冲动增加,而在钙离子浓度为3.6mmol/L的细胞外液中肌梭自发传入冲动受到抑制。这种钙离子所引起的传入冲动的改变通常在钙浓度改变后的几分钟才出现,提示肌梭的外囊起着重要的屏障作用,它可以阻止钙离子的扩散。胞外钙浓度改变引起传入冲动的变化可能与以下原因有关:钙离子可直接作用于肌梭感觉末梢膜的离子通道[7],细胞外液低钙可引起感觉末梢膜电位减小,其兴奋性升高,电压依赖性离子通道在去极化状态下易于激活,自发传入放电增多;与之相反,细胞外液高钙则可使感觉末梢膜电位超极化,其兴奋性降低,自发传入放电减少。本实验中低钙组肌梭自发传入放电频率为(0.08±0.02)Hz,高钙组肌梭自发传入放电频率为(0.14±0.02)Hz,两者差距较大,这可能与肌梭来自不同的大鼠且给药前肌梭的状态不同有关,而本实验采取自身前后对照设计,可避免个体差异对结果的影响。本实验中低钙组和高钙组在给予Sch后均未见到肌梭传入放电的增加,前者可能与肌梭长期处于低钙液中梭内肌纤维疲劳、能量消耗过多有关,而后者则与高钙对Sch有一定拮抗作用[9],且感觉末梢兴奋性降低有关。
肌梭和梭外肌平行排列,肌梭位于其初长度时可产生自发的传入放电,在重力的作用下,肌梭自发传入放电不断传向中枢,从而产生了肌紧张,地球上的人和动物才能维持站立的状态。然而载人航天飞行过程中,宇航员处于失重状态,传向中枢的肌梭自发放电减少,肌紧张减弱,肌肉萎缩。研究发现,在模拟失重条件下,肌梭的结构和功能均有明显改变,其变化早于、重于梭外肌。模拟失重情况下,细胞外液钙离子浓度增高,肌梭自发放电减少,传向中枢的神经冲动减少,肌紧张减弱,肌肉活动减少,最终导致或加重了肌肉萎缩[10-11]。据此我们推断,失重或模拟失重环境下,肌细胞外钙离子浓度升高、钙稳态失衡,是导致肌梭的结构与功能破坏,使其感受器功能丧失、传入放电减少的重要原因。
本研究结果为失重所致肌萎缩的发生机制提供新的实验材料,为大鼠肌梭生理的研究及钙离子与失重性肌萎缩的实验研究提供了有意义的资料。
[1]SMITH S M, HEER M A, SHACKELFORD L C, et al. Benefits for bone from resisitance exercise and nutrition in long-duration spaceflight: evidence from biochemistry and ensitometry[J]. J Bone Miner Res, 2012, 27(9):1896-1906.
[2]陈善广, 王春慧, 陈晓萍, 等. 长期空间飞行中人的作业能力变化特性研究[J]. 航天医学与医学工程, 2015, 28(1):1-10.
[3]张 浩, 杨 威, 樊小力. 从肌梭角度探讨失重性肌萎缩的发生机制[J]. 山西医科大学学报, 2013, 44(10):827-830.
[4]SMITH S M, WASTNEY M E, MORUKOV B V, et al. Calcium metabolism before, during, and after a 3-months spaceflight: kinetic and biochemical changes[J]. Am J Physiol Regulatory Integrative Comp Physiol, 1999, 277(1 Pt 2): R1-10.
[5]ITO F, KOMATSU Y. Transduction and encoding mechanisms in muscle spindle[J]. Nagoya J Med Sci, 1980, 42(3-4): 37-48.
[6]PERIASARMY M, GREGORY P, MARTIN B J, et al. Regulation of myosin heavy chain gene expression during skeletal-muscle hypertrophy[J]. Biochem J, 1989, 257(3): 691-698.
[7]FISCHER M, SCHFER S S. Effects of calcium on the discharge pattern of primary and secondary endings of isolated cat muscle spindle recorded under a ramp-and-hold stretch [J]. Brain Res, 2000, 875: 78-88.
[8]OTTONSON D. The action of calcium on the frog′s isolated muscle spindle[J]. Journal of Physiology, 1965, 178 :68-79.
[9]王爱国, 张 宏, 李 军. 钙剂对肌松药药效的影响[J]. 解放军医学杂志, 2001, 26(10): 775-777.
[10]赵雪红, 张文静, 周 茜, 等. 后肢制动对肌梭传入放电活动的影响[J]. 南方医科大学学报, 2015, 35(2): 252-255.
[11]赵雪红, 高 艳, 樊小力. 振动训练对制动大鼠单一肌梭电生理活动的影响[J]. 生物学杂志, 2015, 32(2): 17-19.

