金黄色葡萄球菌核酸酶A在温控双表达载体中的表达及其活性分析
付立霞, 张 磊, 李欣容, 韩先干, 高 波, 张晓君, 魏文志
(1. 江苏省人畜共患病学重点实验室 扬州大学 动物科学与技术学院, 扬州 225009; 2. 中国农业科学院 上海兽医研究所, 上海 200241)
菌蜕是近年来兴起的一种新型死菌苗,主要通过噬菌体PhiX174裂解基因E在革兰氏阴性菌中的控制表达进行制备。基因E的表达产物可在细菌表面形成直径约40~200 nm的跨膜通道,细菌胞质内容物在渗透压作用下可通过此通道流出,最终剩下的细菌空壳即为菌蜕[1]。由于避免了剧烈的化学或物理灭活过程,菌蜕可最大限度地保留细菌表面的原始结构和相关抗原决定簇,因而具有良好的免疫原性,同时兼具佐剂的功能,可诱导产生较常规疫苗更好的免疫保护效果,其更进一步的优势是可以被开发为抗原、核酸和生物活性物质的高级递送载体[2-3]。
在菌蜕制备过程中,裂解基因E的控制表达可在多种启动子操纵系统的转录控制下完成,其中又以源自λ噬菌体温敏突变体的温控表达系统λpL/pR-cI857应用最为广泛。在该系统中,受温敏阻遏蛋白cI857调控的启动子pR或/和pL可在30℃以下(通常为28℃)时抑制裂解基因E的表达,而当温度高于30℃(通常为42℃)时由于阻遏蛋白被热激灭活,进而启动基因E的表达。不过,在实际生产过程中,并非所有细菌都会被基因E所介导的裂解作用完全灭活,而且宿主菌基因组和外源质粒等遗传物质也不能被完全消除,具有潜在的基因转移风险[4-5]。
为了解决上述问题,另一种致死基因——金黄色葡萄球菌核酸酶A被引入菌蜕的制备之中[6]。SNA为金黄色葡萄球菌核酸酶的结构基因,其产物具有核酸酶活性,可在钙、镁离子存在时降解单链或双链DNA或RNA[7-8]。在实际应用中,出于经济性和操作便利性考虑,多将裂解基因E和SNA克隆至同一温控表达载体,各自置于一个pR启动子或分别置于pR和pL启动子控制之下,通过升温诱导两者的联合表达[9-11]。两者的联合表达可使残存活菌数在单纯基因E介导灭活的基础上进一步下降2个数量级,而值得注意的是,在单表达温控系统中单纯SNA的诱导表达却可使宿主菌活菌数下降近3个数量级[11-12],这意味着将SNA从单表达温控系统克隆至双表达温控系统中与基因E共表达时其作用效率会下降近一个数量级,这无疑不利于高效安全菌蜕疫苗的制备。迄今,对于导致这一差异产生的可能机制尚缺乏关注,基于此,本研究通过将SNA克隆至一双表达温控载体的左向启动子pL之后,通过升温诱导SNA表达,进而对其活性进行综合分析,据此对这一问题进行探讨,为进一步提高菌蜕制备的效率和安全提供参考。
1 材料与方法
1.1 菌株、质粒和试剂
大肠杆菌DH5α,质粒pKF396M-5和pFLX107-cSNA由本实验室保存[11-12]。分子生物学试剂:PrimeSTAR HS (Premix),PremixTaq(plus dye),T4 DNA ligase,Marker DL5000,DL10000以及限制性内切酶EcoR I和KpnI等均为宝生物工程(大连)有限公司产品。胶回收试剂盒Gel/PCR DNA,质粒和基因组提取试剂盒High-Speed Plasmid Mini Kit,DNA Mini Kit等为Geneaid产品。甲苯胺蓝DNA琼脂购于杭州滨和微生物试剂有限公司。
1.2 质粒pKF396M-5-SNA的构建
根据已发布SNA基因序列,同时参照质粒pFLX107-cSNA的相应结构序列设计合成一对分别含EcoR I和KpnI酶切位点的正反向引物用于含SNA片段的PCR扩增。其中正向引物P1:5′-CCGGAATTCATGGAACAACGCATAACCCT-3′;反向引物P2:5′-CGGGGTACCTTATTGACCTGAATCAGCGT-3′(下划线处序列分别为EcoR I和KpnI酶切位点,斜体序列为保护碱基)。反应体系为50 μL,其中引物P1 (10 μmol/L),P2 (10 μmol/L)各1 μL ,模板(pFLX107-cSNA)1 μL ,PrimerStar HS (Premix) 25 μL ,灭菌双蒸水22 μL 。PCR反应参数为:98℃变性10 s,58℃退火20 s,72℃延伸30 s,共25个循环,最后再于72℃延伸1 min。
PCR产物经1%琼脂糖电泳后切胶回收,用EcoR I和KpnI对纯化产物进行酶切,连入同样经EcoR I/KpnI酶切的pKF396M-5质粒中,通过热激转化大肠杆菌DH5α,然后涂布于含氯霉素(35 μg/mL)的LB平板,放入培养箱中于28℃过夜培养,对长出的克隆通过引物对P1/M13-47(5′-CGCCAGGGTTTTCCCAGTCACGAC-3′)进行进一步PCR鉴定,PCR反应条件为:94℃ 预变性3 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,30个循环;最后再于72℃延伸2 min。 PCR鉴定为阳性的克隆外送测序验证,最终构建成功的质粒命名为pKF396M-5-SNA(图1)。

图1 质粒pKF396M-5-SNA的物理图谱
cI857:温敏阻遏蛋白cI857;pR:lambda噬菌体右向启动子;rrnbT1T2:核糖体RNA操纵子T1T2终止子;pL:lambda噬菌体左向启动子;E:噬菌体phiX174裂解基因E;Ori:复制起始区;Cat:氯霉素乙酰转移酶基因
1.3 SNA的诱导表达
将含有质粒pKF396M-5或pKF396M-5-SNA的大肠杆菌DH5α传代活化后加入100 mL含氯霉素的LB培养基中,于28℃恒温摇床振荡培养至指数生长中期后,移入预热至42℃的恒温摇床进行诱导,同时加入MgCl2和CaCl2使终浓度分别为1 mmol/L和10 mmol/L。每隔一定时间取样一次,通过测定培养物的OD600监测细菌的生长情况,对升温诱导0 h和4 h的菌液进行平板活菌计数,计算细菌的灭活率。计算公式为:
灭活率(%)=(1-诱导后CFU/诱导前CFU) ×100%。
1.4 核酸酶活性测定
核酸酶活性的测定参照文献[19]中所述方法进行。先制备甲苯胺蓝DNA琼脂平板,然后用打孔器在平板上均匀打孔(d=3 mm)。待升温诱导后每隔30 min或1 h取样离心1次,取10 μL上清加入孔中以测定培养液上清中的核酸酶活性,同时对沉淀菌体以等量LB进行重悬煮沸,再次离心后在其他孔中加入10 μL上清以测定胞内核酸酶活性。加样后的平板均置于28℃过夜培养。上样孔周围出现蓝色消退并呈现出粉红色圆圈者为阳性反应,无变色则为阴性反应。
1.5 基因组的提取和检测
升温诱导后每隔1 h取1 mL细菌培养液,通过DNA Mini Kit试剂盒进行总基因组的提取,相关操作均按照产品说明书进行,通过0.8%琼脂糖电泳分析确认SNA基因组的降解活性。
2 结果与分析
2.1 质粒pKF396M-5-SNA的构建
以质粒pFLX107-cSNA为模板,引物对P1/P2成功扩增出预期大小约为546 bp(含限制性酶切位点和保护碱基,后同)的含SNA目的片段(图2);对构建成功的质粒通过引物P1/M13-47进行PCR鉴定,可扩增出大小约为601 bp的预期目的片段(图3),进一步测序结果表明,成功构建质粒pKF396M-5-SNA。

图2 基因SNA的PCR扩增
M:DNA Marker DL5000;1~2:SNA PCR产物;3:空白对照

图3构建质粒的PCR鉴定
Fig 3 PCR identification of the constructed plasmid
M:DNA Marker DL5000;1:鉴定PCR产物;2:空白对照
2.2 大肠杆菌 DH5α(pKF396M-5-SNA)的生长曲线
升温诱导后,转化有质粒pKF396M-5-SNA的大肠杆菌DH5αOD600在经历一段时间快速增长后趋于平稳,最终稳定于约1.1左右,而作为对照的大肠杆菌(pKF396M-5)OD600则在整个实验期间一直持续增长直至达到平台期OD600=2.0(见图4)。诱导4 h后,大肠杆菌DH5α (pKF396M-5-SNA)活菌数从诱导前的9.4×107下降至3.2×105,灭活率为99.7%,而大肠杆菌DH5α(pKF396M-5)活菌数则从诱导前的1.1×108增加至5.6×108,增加了4.1倍。
2.3 核酸酶活性
大肠杆菌DH5α(pKF396M-5-SNA)升温诱导后的胞内和胞外产物均可使甲苯胺蓝DNA琼脂呈显色反应,在点样孔周围形成肉眼可见的粉红色圆圈,不过被检出时间有所不同,而且粉红圈直径也存在差异,其中胞内核酸酶在升温诱导30 min后即可被检出,而胞外核酸酶则在升温诱导90 min后方被检出,以最后4组测量值计算的平均粉红圈直径分别为7.7 mm±0.3 mm和3.9 mm±0.2 mm。对照组则在历次核酸酶活性检测中均为阴性(图5)。

图4 大肠杆菌DH5α的生长曲线
2.4 宿主菌基因组电泳检测
升温诱导后,在金黄色葡萄球菌核酸酶A的作用下,大肠杆菌DH5α(pKF396M-5-SNA)基因组被成功降解,电泳条带呈弥散状(图6-A),而作为对照的大肠杆菌DH5α (pKF396M-5)基因组则未被降解,且在整个实验期间浓度不断增加(图6-B)
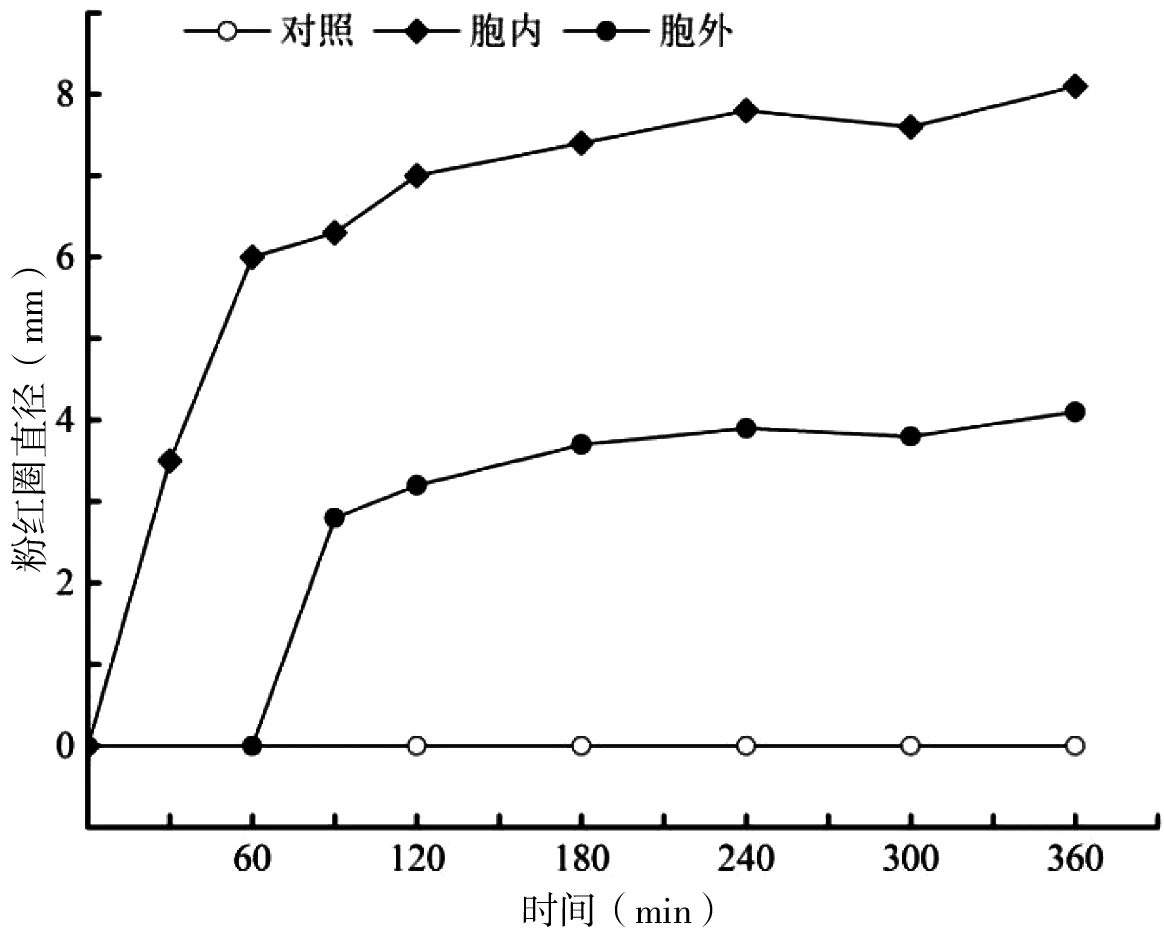
图5 大肠杆菌DH5α核酸酶活性
3 讨论
与常规疫苗相比,菌蜕完整保留了细菌原有的表面形态结构和特性,可刺激机体产生更强的免疫反应,具有更好的免疫保护效果[13-14]。借助于基因工程手段还可以构建出携带外源抗原的重组菌蜕疫苗。此外,菌蜕胞质腔还可用于药物和核酸的递送,而且菌蜕自身即兼具佐剂的功能,免疫时无需再加入佐剂,可避免因使用佐剂所带来的副作用[1-3]。正是由于具有以上的诸多优点,菌蜕在现代疫苗发展中日益受到关注。不过,单纯基因E所介导的裂解作用并不能完全灭活宿主菌,这无疑会限制菌蜕的实际应用。
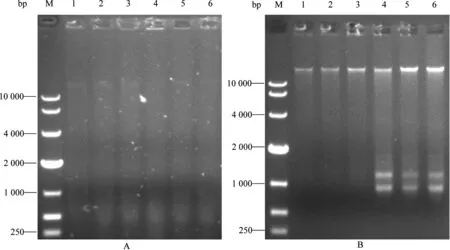
图6 大肠杆菌DH5α总基因组电泳分析
A:大肠杆菌DH5α(pKF396M-5-SNA);B:大肠杆菌DH5α(pKF396M-5)。M: DNA Marker DL10000;1~6:诱导后每隔1 h取的样品
金黄色葡萄球菌核酸酶A是由金黄色葡萄球菌产生的一种胞外核酸酶。该酶性质稳定,易于分离和鉴定,相对分子质量小,结构也较简单,分子内既无二硫键,也不含半胱氨酸,被广泛应用于蛋白质结构和功能的研究[15]。除此之外,在钙离子存在时,金黄色葡萄球菌核酸酶可降解单链或双链RNA或DNA,镁离子的存在可以加强这一作用[8],正是这一特性使其还可作为辅助致死蛋白,用于菌蜕制备过程中宿主菌的进一步灭活及残存遗传物质的去除,消除潜在的生物安全风险[9-11],但如前所述SNA在温控单表达系统中表达时和在双表达系统中与基因E共表达时对宿主菌的灭活效率存在近一个数量级的差异。
理论上,两种可能的因素会导致上述差异的产生,一是温控表达系统本身的结构差异,二是基因E和SNA的表达会彼此影响各自的作用效果。本研究中,SNA被置于温控双表达质粒pKF396M-5启动子pL之后,同一载体上的pR之后则没有外源基因片段插入,且强终止子rrnbT1T2紧邻其后,这一设计可保证SNA最终只受启动子pL控制,便于探究其在温控双表达系统中的单纯表达活性及作用效果。最终实验结果显示,在该载体中的SNA经升温诱导后亦可成功降解宿主基因组,对宿主菌的灭活率也只比前述单表达载体下的灭活率低0.1%~0.2%,这表明SNA在温控双表达载体中的单表达仍能如在单表达载体中一样有效灭活细菌,裂解基因E和SNA的共表达可能才是造成上述差异的主要原因,而这可能又与裂解基因E在宿主菌表面形成的跨膜通道有关,因跨膜通道的形成会造成SNA被过早释放至胞外,进而降低其作用效果。除此之外,在诱导过程中为了发挥SNA的最大活性,通常会向培养液中加入Ca2+和Mg2+溶液,而已有研究结果显示Mg2+的存在会抑制基因E的裂解作用[16]。
鉴于基因E的诱导表达为菌蜕制备所必须,未来可通过提高SNA的作用效率来进一步改进菌蜕疫苗的制备,如将SNA锚定于宿主菌内膜表面延缓其外释,或优化离子配方或诱导程序来降低对裂解基因E的抑制效应,如是否需要向培养液中加入Mg2+,如果加入又以何时为宜。这一切,都有待进一步研究。
[1]LANGEMANN T, KOLLER V J, MUHAMMAD A, et al. The bacterial ghost platform system: production and applications[J]. Bioengineered Bugs, 2010,1(5):326-336.
[2]RIEDMANN E M, KYD J M, CRIPPS A W, et al. Bacterial ghosts as adjuvant particles[J]. Expert Review of Vaccines, 2007, 6(2):241-253.
[3]GANESHPURKAR A, GANESHPURKAR A, PANDEY V, et al. Harnessing the potential of bacterial ghost for the effective delivery of drugs and biotherapeutics[J]. International Journal of Pharmaceutical Investigation, 2014,4(1):1-4.
[4]HAIDINGER W, SZOSTAK M P, JECHLINGER W, et al. Online monitoring ofEscherichiacolighost production[J]. Applied and Environmental Microbiology, 2003,69(1):468-474.
[5]KWON S R, NAM Y K, KIM S K, et al. Generation ofEdwardsiellatardaghosts by bacteriophage PhiX174 lysis gene E[J]. Aquaculture, 2005, 250(1-2):16-21.
[6]HAIDINGER W, MAYR U B, SZOSTAK M P, et al.Escherichiacolighost production by expression of lysis gene E and Staphylococcal nuclease[J]. Applied and Environmental Microbiology, 2003,69(10):6106-6113.
[7]Shortle D. A genetic system for analysis of staphylococcal nuclease[J]. Gene, 1983,22(2-3):181-189.
[8]ANFINSEN C B, CUATRECASAS P, TANIUCHI H. Staphylococcal nuclease, chemical properties and catalysis[J]. Enzymes, 1971,4(4):177-204.
[9]LEE D J, KWON S R, ZENKE K, et al. Generation of safety enhancedEdwardsiellatardaghost vaccine[J]. Diseases of Aquatic Organisms, 2008,81(3):249-254.
[10]KWON S R, KANG Y J, LEE D J, et al. Generation ofVibrioanguillarumghost by coexpression of PhiX 174 lysis E gene and staphylococcal nuclease A gene[J]. Molecular Biotechnology, 2009,42(2):154-159.
[11]FU L X, LU C P. A novel dual vector coexpressing PhiX174 lysis E gene and staphylococcal nuclease a gene on the basis of lambda promoter pR and pL, Respectively[J]. Molecular Biotechnology, 2013,54(2):436-444.
[12]付立霞, 冀德君, 卢徐斌,等. 金黄色葡萄球菌核酸酶A 与不同外源DNA 片段融合表达的作用比较[J]. 生物工程学报, 2016,32(12):1654-1663.
[13]JAWALE C V, LEE J H. Characterization of adaptive immune responses induced by a new genetically inactivatedSalmonellaenteritidisvaccine[J]. Comparative Immunology,Microbiology and Infectious Diseases, 2014,37(3):159-167.
[14]VILTE D A, LARZBAL M, MAYR U B, et al. A systemic vaccine based onEscherichiacoliO157:H7 bacterial ghosts (BGs) reduces the excretion ofE.coliO157:H7 in calves[J]. Veterinary Immunology and Immunopathology, 2012,146(2):169-176.
[15]CUATRECASAS P, WILCHEK M. Staphylococcal nuclease[J]. Methods in Enzymology, 1977, 46:358-362.
[16]YOUNG K D, YOUNG R. Lytic action of cloned phi X174 gene E[J]. Journal of Virology, 1982,44(3):993-1002.

