基于石墨烯及纳米复合材料的抗菌性研究进展
朱中杰,黄 青
(1. 中国科学院 上海应用物理研究所,上海201800;2. 中国科学院 合肥物质科学研究院,合肥230026)
2004年,曼彻斯特大学的两位科学家Novoselov和Geim[1]采用简单机械分离的方法得到单层石墨烯,首次获得SP2杂化轨道形成的单原子层碳结构材料,并且提出了这种二维材料具有的很强的双极电场作用。这种新型材料石墨烯拥有比硅更高的载流子迁移率,而且电子在石墨烯的运动中会产生极少的热量,有望替代硅材料来制作晶体管器件,给电子产业的发展带来新的契机。此外,单层石墨烯纳米材料还具有独特的光学、电子和机械性能,如大比表面积、高电导率以及热稳定性等,在许多领域显示了很好的应用前景。因此,2010年两人由于石墨烯材料的重大发现而获得诺贝尔物理学奖。
平面二维石墨烯材料呈现为单原子层蜂窝状排列,是目前为止最薄的二维材料,仅为0.35 nm,非常稳定,具有独特的物理性能。此外,石墨烯的衍生物氧化石墨烯材料(graphene oxide 简称GO)由于含有含氧官能团,有非常好的水溶性、溶液分散性、生物相容性,且对特定的生物分子的高亲和力。近年来,研究人员发现纳米结构的石墨烯及其衍生物氧化石墨烯材料(统称graphene materials,GMs)还有一定的细胞毒性和抗菌性能[2],并且可以应用于药物的传递、生物传感器、以及癌症治疗等,其在生物医学领域的发展也日益得到关注(图1)[3]。为此,本文主要介绍石墨烯材料的有关制备方法、抗菌性能与机制、以及该材料与其他金属或非金属材料等形成复合材料在生物灭菌方面的研究及应用进展。
1 石墨烯及其衍生物氧化石墨烯的结构、性质与制备方法
石墨烯由二维单原子层组成,呈蜂窝状排列的晶体结构(图2)[4]。二维的石墨烯材料可以形成零维的球形富勒烯结构,也可以卷曲形成二维碳纳米管结构,还可以层层叠放形成三维石墨体。石墨烯的衍生物氧化石墨烯(GO)含有丰富的官能团结构,具有较高的比表面积。一般情况下GO呈现亲水性,在水中具有很好的分散性。

图1 石墨烯及纳米复合材料在生物医学中的应用[3]
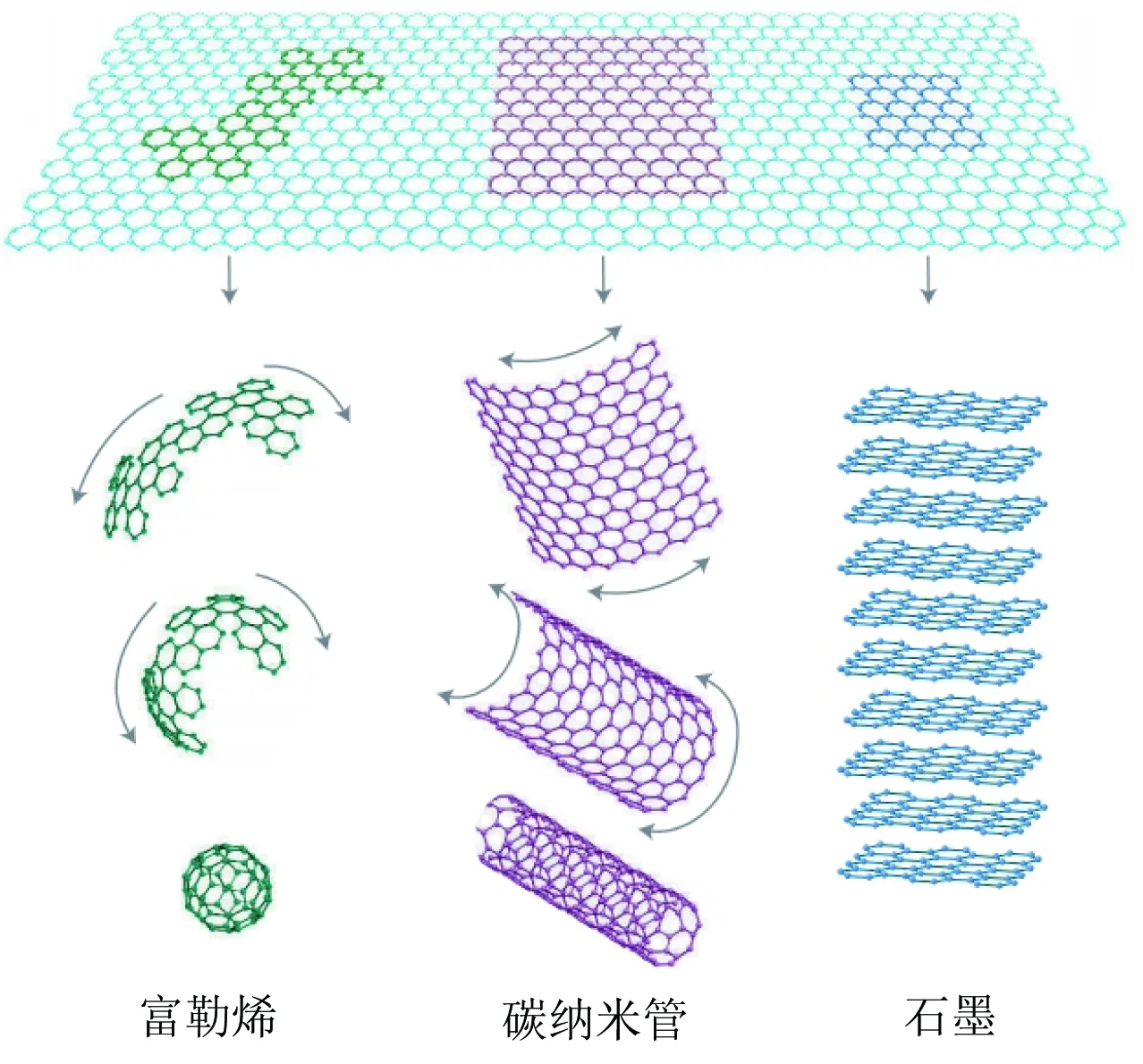
图2 石墨烯与几种碳材料[4]
石墨烯材料理化性质与它的结构和状态(大小、形状、层数、聚集程度和表面修饰等)有关,而其结构和状态是由制备方法所决定的。石墨烯的制备方法有很多,但是根据制备方法的不同得到的产物的物理化学性质就有所不同。目前,根据实验条件的不同,主要分为固相法、液相法、气相法,常用的一些方法有机械剥离法、氧化还原法、化学气相沉积法(CVD)和电化学法等。最简单也是最早期的机械剥离的方法是由Geim等[4]人用的胶带撕扯法,原因是因为石墨层之间是以范德华力结合,结合能约为2 eV/nm2,那么将石墨烯层剥离所需要的力为300 nN/μm,因此,普通胶带可以将石墨烯层剥离。操作比较简单,将胶带在石墨上撕扯下来多层石墨,胶带之间再反复撕扯,这样的操作重复多次,最后将其转移到衬底上,就可以得到单层石墨烯。目前应用最广泛,也是早期就有相关研究报道的一类比较稳定操作的方法,主要是选择将石墨烯在强氧化剂作用下将石墨粉氧化成氧化石墨烯,再用还原剂将氧化石墨烯还原得到石墨烯。先将石墨氧化成氧化石墨烯的方法有很多,最经典也是最常用的有3种,分别是:Hummers氧化法[5]、Brodie法[6]和Staudenmaier法[7]。3种氧化方法都是将强酸(如浓硫酸)小分子插入到石墨层之间,再通过强氧化剂(如高锰酸钾、高氯酸钾等)对其进行氧化。相比较于其他两种方法来,Hummers氧化法安全性高,试验中较多采用此方法。Hummers氧化法首先将石墨粉在冰水浴、强酸环境下反应,加入高锰酸钾在调控适当的温度下,反应数小时,最后再加入适量水以及双氧水,用来还原溶液中未反应完全的强氧化剂。还原氧化石墨烯目前主要采用抗坏血酸或水合肼做还原剂。其中,抗坏血酸做还原剂,通过超声剥离的方法将具有多氧官能团的氧化石墨烯剥离成单层的石墨烯。采用化学气相沉积法可以制备大面积的具有优异的电学和光学性能的石墨烯薄膜。该方法的原理是将碳氢气体吸附于具有催化活性的非金属或金属表面,加热后使碳氢气体脱氢在衬底表面形成石墨烯。早期的Obraztsov等[8]采用CVD法制备石墨烯薄膜,采用镍做衬底。除了镍做衬底还可以选择其他金属做衬底如铜膜等[9],该方法将碳高温熔解进入镍基体中,冷却后析出,碳沉积的厚度和结晶度与冷却速率和碳在高温下熔解的温度息息相关。CVD法制备的石墨烯表现出非常好的灵活性以及优异的电学光学性能,而且大面积制备有利于实现工业化生产。
除了上述几种常用的制备石墨烯的方法之外,还有其他的方法,比如通过加热碳化硅单晶表面,脱附硅原子制备石墨烯的外延生长法[10]、电化学方法[11]、溶剂剥离法、溶剂热法及有机合成法。每一种方法的反应条件不同,优缺点不同,制备出的石墨烯的物理、化学性质等不同,所以根据实验要求选取相应的方法。表1是几种典型的石墨烯制备方法的比较。
2 石墨烯及其衍生物氧化石墨烯的抗菌性研究
2010年,Huang和Fan等[12]首次将石墨烯材料应用于抑制大肠杆菌的研究;与此同时,Akhavan和Ghaderi[13]也发现和报道了石墨烯纳米材料的抑细菌(包括革兰氏阴性菌和阳性菌)效应并探讨了相关机理。此后关于石墨烯应用于生物抗菌领域的研究报告也越来越多,成为一个新的研究热点。Akhavan和Ghaderi[13]对石墨烯及其衍生物氧化石墨烯的灭菌效果进行了检测,比较了它们对金黄色葡萄球菌和大肠杆菌的抑菌性,发现均有较好的抑菌效果。大量实验证明了石墨烯的灭菌效果,深入探索石墨烯与细菌的相互作用机制成为共同的目标。另外,石墨烯材料在一定条件下还可以与其它金属、金属氧化物或非金属结合形成复合材料,由此获得更强的抗菌效果。关于石墨烯的抗菌机理,由于石墨烯材料本身受所具有的物理化学性质的影响,比如:形态、大小、厚度、表面结构等,使得其在灭菌方面的效果相差较大。表2总结了石墨烯材料本身对抗菌效果的影响因素。
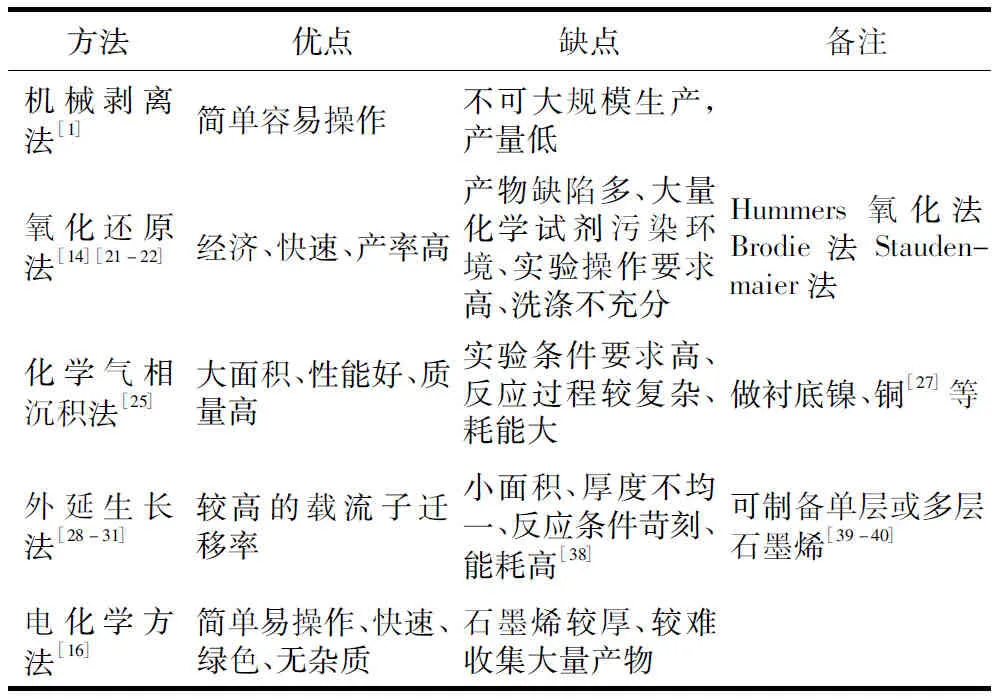
表1 几种典型的石墨烯制备方法的比较

表2 单纯石墨烯材料的抗菌因素
对于石墨烯本身因素的抗菌机理,研究人员已经提出来了几种主要的机制,如:纳米刀理论、氧化胁迫作用、包裹作用等[14-16],其细胞作用的主要靶物质或分子是细胞中的DNA/RNA和蛋白质以及细胞膜上的磷脂分子。早在2010年,Akhavan和Ghaderi[13]提出石墨烯纳米材料锋利的边缘会导致细胞膜的破坏以及细胞内RNA的缺失。此后,不断有研究学者发现这一效应[17-18]。关于石墨烯对细胞膜的作用,Zou等[19]通过大量的实验总结得到动态模拟石墨烯纳米片穿过细胞膜的过程。在这个过程中,石墨烯纳米材料起到了“纳米刀”的作用,用其锋利的边缘穿过细胞膜,通过理论模拟提出了“插入模式”。在这个“插入模型”中,除了GMs的边缘的锋利程度对细胞膜有影响之外,边缘密度对抗菌活性也非常重要。Pham等[14]将石墨烯不同的边缘密度以及不同的角度用于实验,发现尽管已经被证明在90°时对细菌有最强的杀菌效率,但是在37°时对金黄色葡萄球菌和绿脓杆菌有抑制性。除上述的灭菌机制之外,单原子层的石墨烯薄膜可以包裹住细菌的细胞膜,给细菌提供了一个单独的空间,将其与周围的环境隔开,得不到营养物质的补充以及自身排出的毒素无法与外界环境交换,最后导致细菌死亡,鉴于石墨烯独特的薄膜结构,这种机理的解释受到广泛的认同(图3)[16]。近几年对石墨烯薄膜对抗菌作用的研究不仅仅局限于“饿死”细胞,一些研究学者发现GMs捕获细菌并包裹住细胞膜后会在一定程度上诱导细菌的细胞膜发生扰动。Chen等[20]发现GO一旦与病原体接触就会交织在一起。在SEM下观察,尽管细胞膜的完整性没有得到破坏,但是出现了膜的扰动,并且进一步说明了将细菌包裹后对细菌的作用,通过膜电位实验发现膜去极化损伤了细胞膜的结构。需要指出的是,在实际实验的影响因素中较难控制单一变化条件,因此对其灭菌机制还存在许多争议。在目前已知的报道中,发现有不同的现象可以用同一种机制解释,或者同一种现象又可以有不同的机理来解释。

图3 大肠杆菌的AFM振幅和3D图像变化[15]
A~F显示在石墨烯包裹细菌时的不同状态
总之,目前所认识的抗菌作用就是抗菌物质与细菌本身的成分的相互作用,即:通过氢键、π-π堆积、静电吸附等与细菌中的生物分子发生作用,破坏或影响组成细胞膜的磷脂双分子层、蛋白质以及细胞内部的遗传物质DNA/RNA等,在此过程中,会诱发GMs的纳米刀效应、提取脂质、破坏蛋白质以及活性氧机制,最终导致细菌中生物分子损伤、细菌生长抑制、细胞膜破坏、细菌内部物质流出和细菌死亡。图4是对GMs对细菌作用的示意图,较形象地说明了目前关于石墨烯材料产生抗菌性的多种机制[21-22]。

图4 GMs的抗菌活动的机制[21-22]
3 石墨烯的金属纳米复合材料的增强抗菌性研究
金属作为抗菌剂,在很早期的生活中,我们就已经有所了解,比如银器或铜制品盛装食物,目的就是防止细菌污染。金属灭菌主要是通过损伤细菌体内的DNA和蛋白质等生物大分子,进一步破坏细胞结构,达到灭菌的目的[23]。金属可以作为灭菌剂的主要原因可以解释为金属离子进入细菌的细胞内,抑制酶的活性,或者产生过氧化氢,进而杀死细菌[24]。利用金属灭菌方法操作简单、灭菌范围广、效率高,并且最重要的是没有抗菌性,但是金属元素长期存在于环境中,对环境造成污染,威胁人类健康,且灭菌效果存在不稳定的因素,达不到长久理想的效果,所以需要寻找新的抗菌剂来消除或者是减轻这些隐患。新兴材料石墨烯及其衍生物氧化物具有抗菌性,同时传统材料金属以及金属化合物在生物抗菌方面起重要作用。 下面我们简单介绍石墨烯材料与金属及金属氧化物复合灭菌效果的研究及其进展。
在早期的介绍金属灭菌的文章中,比较典型和应用比较早的金属元素是银(Ag)的使用,经过大量的实验证明了银离子对微生物有毒害作用,而且包括大肠杆菌在内的多种细菌存在抑制作用。现在关于银离子以及纳米银的抗菌性研究也日益得到关注。Kim等[25]通过纳米银对酵母、大肠杆菌、金黄色葡萄球菌抑制比较,证明了Ag纳米颗粒可以有效地抑制微生物的生长,并且在抗菌控制系统以及医疗器械得到应用。关于与石墨烯结合形成复合抗菌材料,主要是用化学还原硝酸银进行纳米银与GO的复合。近年,Liu等[26]通过简单和绿色环保的合成方法制备了纳米银/GO复合材料,证明了GO/纳米银的复合之后比单纯的银纳米或是GO具有更好的灭菌活性。Marambio-Jones等[27]对银纳米材料的灭菌进行了总结也概述了前些年对银纳米材料的研究。GO作为石墨烯的衍生物与纳米银复合的生物抗菌效果,已有很多实验证明了石墨烯与纳米银复合后是一种理想的抗菌试剂[28-30]。Bai等[31]分别比较了RGO、AgNPs以及Ag/RGO的灭菌效果,证明了Ag/RGO优异的灭菌效果。为了减少银离子的用量, Zhang等[32]提出新型Ag/Pt复合石墨烯纳米材料,从表面上看,至少是减少了金属银的用量。比较GO 、Ag/rGO 、Pt/Ag/rGO在培养基菌落上的抑制圈,发现Pt/Ag/rGO抑制圈最大,相应地证明了其抗菌活性最好。除了金属Ag与Pt之外,Ag可以说是百搭的灭菌剂掺杂物,Ag可以与其他的金属以及金属氧化物复合,在增强抗菌效果的基础上减少银离子的加入量[33-34]。
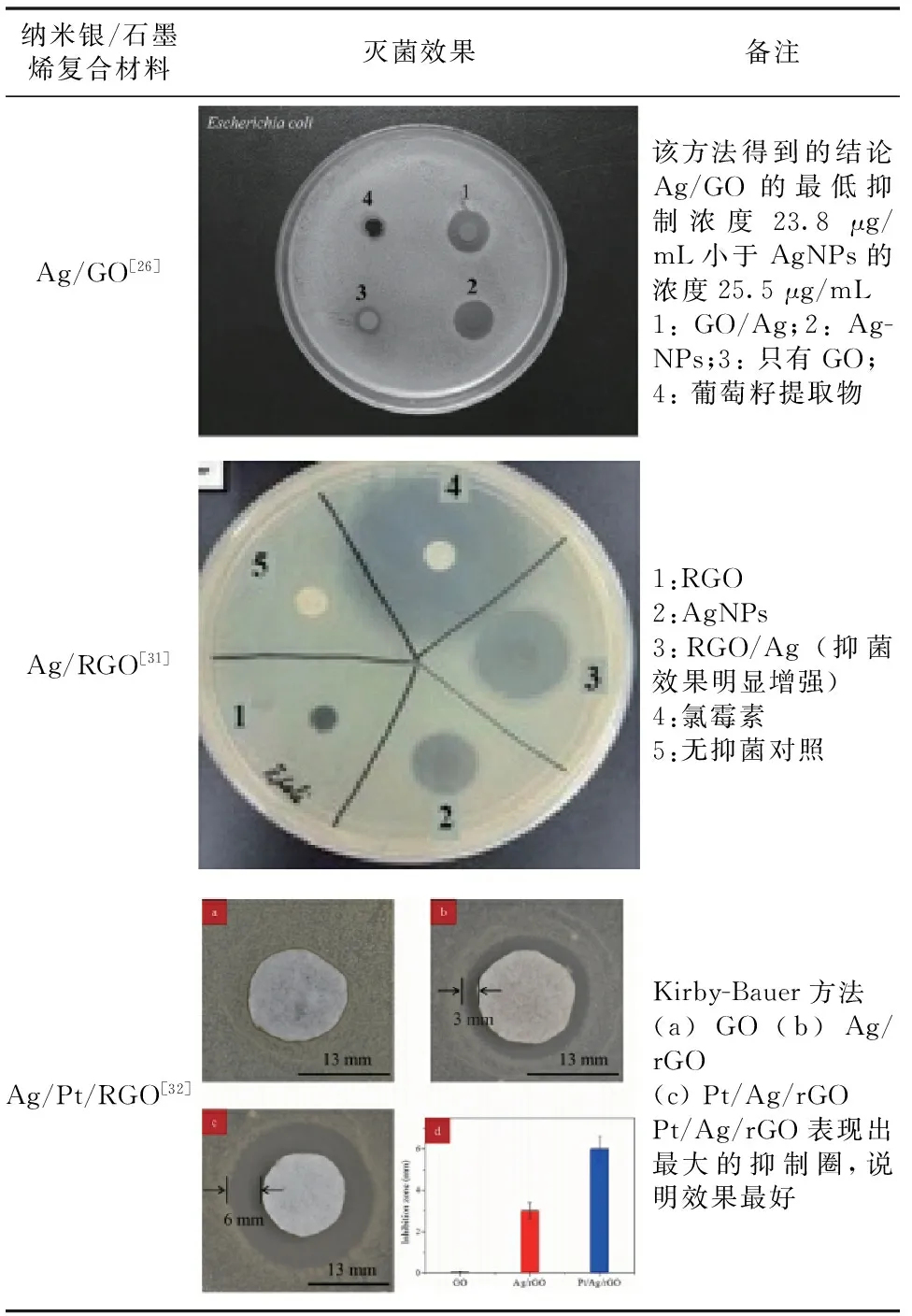
表3 大肠杆菌在纳米银/石墨烯复合物作用下的抑制
银的灭菌效果很好,但是银作为贵金属,在使用方面经济耗费大,所以除了金属银,研究学者还发现了Cu、Zn、Co、Ni、V等金属以及复合物的生物抗菌研究[35]。铜作为廉价的灭菌剂,在食物灭菌等领域受到关注。目前常用的做法是把金属铜与其他物质掺杂,或是添加某种有机物改善原有基础上的抗菌活性。如: Trapalis等[36]利用溶胶-凝胶法制备Cu-SiO2材料,证明溶胶-凝胶法制备的Cu-SiO2薄膜材料有较高的抗菌活性。Ouyang等[37]采用多聚赖氨酸改善石墨烯活性与铜纳米粒子复合,得出较好的水溶性和较长久的抗菌性。 除此之外, Jalal等[38]研究发现金属氧化物氧化锌具有抗菌活性。Kavitha等[39]发现纳米氧化锌与石墨烯复合材料表现出良好的灭菌活性,通过氧化锌/石墨烯复合材料以及氧化锌材料的灭菌效果的比较,发现氧化锌/石墨烯复合材料的灭菌效果更好,灭菌效果更明显。在这个过程中,石墨烯增强了与细菌的接触面积,增加了锌离子在溶液中的浓度。2014年,Li等[40]采取不同的金属、非金属以及金属氧化物等与石墨烯材料复合,检测它们的抗菌性,发现石墨烯与导体Cu以及与半导体Ge对大肠杆菌具有抑制性,但是石墨烯与绝缘体SiO2却对细菌没有影响。
关于石墨烯与金属或金属氧化物复合材料的增强灭菌效果的机理研究,也是目前研究热点之一。普遍认为,石墨烯与其他材料复合可以诱导细胞产生氧化应激过程[41],通过其中的氧化胁迫作用,干扰细菌的新陈代谢,导致细胞内功能紊乱,从而达到抑菌的目的。当细胞内积累过量的活性氧(ROS),如H2O2、O2-、OH-、1O2等,就会导致细胞内功能紊乱(如:蛋白质失活、脂质过氧化、线粒体功能破坏、细胞膜解体等),最终导致细菌灭活。至于ROS,其来源可以通过多种方式产生,其中一种方式是芬顿反应。很多研究学者将金属如Fe2+、Cu+等金属离子与GMs形成复合材料,参与抗菌活动中,这些离子与细胞内积累的大量过氧化氢(H2O2) 上的羟基直接作用,生成活性氧,即:芬顿反应[42]。

在芬顿反应中起主要氧化作用的是羟基(OH·)自由基。此外,ROS的产生也与石墨烯纳米材料性质有关。人们发现,在石墨烯表面生成ROS,通过增加ROS的含量,可以增强灭菌效果,这为氧化胁迫机理提供了支持。Zhao等[43]通过实验证实了石墨烯纳米材料与其氧化活性有关,石墨烯可以通过氧化还原反应直接生成活性氧(ROS)而达到灭菌目的。同样可以证实活性氧机理的实验结论还有碳纳米材料与分子氧的反应,吸附在石墨烯表面上的氧会形成超氧中间体(如O2·-,HO2·等),随后氧化细胞GSH将结合这些生成的超氧中间体释放到环境中,更多的实验从实验和理论证实石墨烯增加了ROS的产生[44]。
除此之外,石墨烯复合材料还有其他可能增强灭菌效果的机制。例如,当石墨烯与金属复合后,人们发现灭菌活性并不主要来自于活性氧,而是通过电子转移的方式达到灭菌的要求。最初证明该机制的是Li等[40],他们采取不同的金属、非金属以及金属氧化物等与石墨烯材料复合,检测它们的抗菌性。他们发现石墨烯与导体Cu以及与半导体Ge对大肠杆菌具有抑制性,但是石墨烯与绝缘体SiO2却对细菌没有影响。此外,Zubir等[45]通过GO与Fe3O4复合材料发生的芬顿反应得出石墨烯材料因其具有较大的面积,可以作为导电桥,电荷发生在较远的氧化物质上,进一步增强了氧化胁迫作用。实际过程或更复杂的实验说明,对于石墨烯复合材料增强抗菌活性,其原因很可能是综合了多种因素同时起作用(包括通过ROS的氧化胁迫作用和不依赖ROS的电子转移作用等),所以具体问题需要区别对待和分析。
4 结论与展望
石墨烯的出现,不仅仅丰富了碳家族,而且还推动了现代科学技术的发展。石墨烯材料的基础和应用研究正方兴未艾。石墨烯及其复合材料在生物医学领域也显示了广阔的应用前景。现在抗生素的大量使用,导致了多种耐药或耐多药的微生物的出现,每年有超过200万人感染耐抗生素细菌并导致大约2万人死亡,所以研制高效抑菌剂迫在眉睫,而基于石墨烯及复合材料有可能发展获得新的高效抑菌剂。另外,目前关于石墨烯及其复合材料的灭菌效果、机制还在进一步深入探索之中,其中有许多有趣的待解问题。最近,黄青等[46]提出低温等离子体改性氧化石墨烯以提高其抑菌性能的方法,并在实验中已得到证明,有望进一步推动这方面的应用和研究。本文主要综述了目前关于石墨烯及纳米复合材料在抗菌领域方面的研究及进展,通过文献调研列举和比较了关于石墨烯及其复合材料的灭菌机制的不同认识和观点,希望能为今后石墨烯灭菌效率机制研究及拓展石墨烯材料在生物医学方面应用提供一些有益的提示。
[1]NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. Electric field effect in atomically thin carbon films[J]. Science, 2004, 306(5696): 666-669.
[2]WU M C, DEOKAR A R, LIAO J H, et al. Graphene-based photothermal agent for rapid and effective killing of bacteria[J]. ACS Nano, 2013, 7(2): 1281-1290.
[3]JI H, SUN H, QU X. Antibacterial applications of graphene-based nanomaterials: recent achievements and challenges[J]. Advanced Drug Delivery Reviews, 2016, 105(Pt B): 176-189.
[4]GEIM A K, NOVOSELOV K S. The rise of graphene[J]. Nature Materials, 2007, 6(3): 183-191.
[5]HUMMERSJR W S, OFFEMAN R E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 1958, 80(6): 1339.
[6]BRODIE B C. On the atomic weight of graphite [J]. Philosophical Transactions of the Royal Society of London, 1859, 149: 249-259.
[7]STAUDENMAIER L. Verfahren zur darstellung der graphitsäure[J]. European Journal of Inorganic Chemistry, 1898, 31(2): 1481-1487.
[8]OBRAZTSOV A N, OBRAZTSOVA E A, TYURNINA A V, et al. Chemical vapor deposition of thin graphite films of nanometer thickness[J]. Carbon, 2007, 45(10): 2017-2021.
[9]LI X, CAI W, AN J, et al. Large-area synthesis of high-quality and uniform graphene films on copper foils[J]. Science, 2009, 324(5932): 1312-1314.
[10]BOROVIKOV V, ZANGWILL A. Step-edge instability during epitaxial growth of graphene from SiC (0001)[J]. Physical Review B, 2009, 80(12): 121406.
[11]LIU N, LUO F, WU H, et al. One‐step ionic‐liquid‐assisted electrochemical synthesis of ionic‐liquid‐functionalized graphene sheets directly from graphite[J]. Advanced Functional Materials, 2008, 18(10): 1518-1525.
[12]HU W, PENG C, LUO W, et al. Graphene-based antibacterial paper[J]. ACS Nano, 2010, 4(7): 4317-4323.
[13]AKHAVAN O, GHADERI E. Toxicity of graphene and graphene oxide nanowalls against bacteria[J]. ACS Nano, 2010, 4(10): 5731-5736.
[14]PHAM V T, TRUONG V K, QUINN M D, et al. Graphene induces formation of pores that kill spherical and rod-shaped bacteria[J]. ACS Nano, 2015, 9(8): 8458-8467.
[15]LIU S, HU M, ZENG T H, et al. Lateral dimension-dependent antibacterial activity of graphene oxide sheets[J]. Langmuir, 2012, 28(33): 12364-12372.
[16]AKHAVAN O, GHADERI E, ESFANDIAR A. Wrapping bacteria by graphene nanosheets for isolation from environment, reactivation by sonication, and inactivation by near-infrared irradiation[J]. The Journal of Physical Chemistry B, 2011, 115(19): 6279-6288.
[17]CHEN J, WANG X, HAN H. A new function of graphene oxide emerges: inactivating phytopathogenic bacterium Xanthomonas oryzae pv. Oryzae[J]. Journal of Nanoparticle Research, 2013, 15(5): 1658.
[18]HE J, ZHU X, QI Z, et al. Killing dental pathogens using antibacterial graphene oxide[J]. ACS Applied Materials & Interfaces, 2015, 7(9): 5605-5611.
[19]ZOU X, ZHANG L, WANG Z, et al. Mechanisms of the antimicrobial activities of graphene materials[J]. Journal of the American Chemical Society, 2016, 138(7): 2064-2077.
[20]CHEN J, PENG H, WANG X, et al. Graphene oxide exhibits broad-spectrum antimicrobial activity against bacterial phytopathogens and fungal conidia by intertwining and membrane perturbation[J]. Nanoscale, 2014, 6(3): 1879-1889.
[21]TU Y, LV M, XIU P, et al. Destructive extraction of phospholipids fromEscherichiacolimembranes by graphene nanosheets[J]. Nature Nanotechnology, 2013, 8(8): 594-601.
[22]LV W, GUO M, LIANG M H, et al. Graphene-DNA hybrids: self-assembly and electrochemical detection performance[J]. Journal of Materials Chemistry, 2010, 20(32): 6668-6673.
[23]LI M, LI D, QU L, et al. Study on Ag bio-coatings on titanium alloy by ultrasonic auxiliary micro-arc oxidation[C]//Strategic Technology (IFOST), 2011 6th International Forum on. IEEE, 2011, 1: 197-201.
[24]JUVEN B J, PIERSON M D. Antibacterial effects of hydrogen peroxide and methods for its detection and quantitation[J]. Journal of Food Protection, 1996, 59(11): 1233-1241.
[25]KIM J S, KUK E, YU K N, et al. Antimicrobial effects of silver nanoparticles[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2007, 3(1): 95-101.
[26]LIU C C, XU H, WANG L, et al. Facile one-pot green synthesis and antibacterial activities of GO/Ag nanocomposites[J]. Acta Metallurgica Sinica (English Letters), 2017, 30(1):1-9.
[27]MARAMBIO-JONES C, HOEK E M V. A review of the antibacterial effects of silver nanomaterials and potential implications for human health and the environment[J]. Journal of Nanoparticle Research, 2010, 12(5): 1531-1551.
[28]MEN B, SUN Y, TANG Y, et al. Highly dispersed Ag-functionalized graphene electrocatalyst for oxygen reduction reaction in energy-saving electrolysis of sodium carbonate[J]. Industrial & Engineering Chemistry Research, 2015, 54(30): 7415-7422.
[29]YU L, ZHANG Y, ZHANG B, et al. Enhanced antibacterial activity of silver nanoparticles/halloysite nanotubes/graphene nanocomposites with sandwich-like structure[J]. Scientific Reports, 2014, 4: 4551.
[30]XU W P, ZHANG L C, LI J P, et al. Facile synthesis of silver@ graphene oxide nanocomposites and their enhanced antibacterial properties[J]. Journal of Materials Chemistry, 2011, 21(12): 4593-4597.
[31]BAI R G, MUTHOOSAMY K, SHIPTON F N, et al. The biogenic synthesis of a reduced graphene oxide silver (RGO Ag) nanocomposite and its dual applications as an antibacterial agent and cancer biomarker sensor[J]. RSC Advances, 2016, 6(43): 36576-36587.
[32]ZHANG M, ZHAO Y, YAN L, et al. Interfacial engineering of bimetallic Ag/Pt nanoparticles on reduced graphene oxide matrix for enhanced antimicrobial activity[J]. ACS Applied Materials & Interfaces, 2016, 8(13): 8834-8840.
[33]DU W X, YANG J, SANG Y X, et al. Preparation and antibacterial properties of Ag/Fe3O4/rGO nanocomposite[J]. Chemical Journal of Chinese Universities-Chinese, 2017, 38(3): 346-354.
[34]CHEN M, YANG L, ZHANG L, et al. Effect of nano/micro-Ag compound particles on the bio-corrosion, antibacterial properties and cell biocompatibility of Ti-Ag alloys[J]. Materials Science and Engineering: C, 2017, 75: 906-917.
[35]BAGIHALLI G B, AVAJI P G, PATIL S A, et al. Synthesis, spectral characterization, in vitro antibacterial, antifungal and cytotoxic activities of Co (II), Ni (II) and Cu (II) complexes with 1, 2, 4-triazole Schiff bases[J]. European Journal of Medicinal Chemistry, 2008, 43(12): 2639-2649.
[36]TRAPALIS C C, KOKKORIS M, PERDIKAKIS G, et al. Study of antibacterial composite Cu/SiO2thin coatings[J]. Journal of Sol-Gel Science and Technology, 2003, 26(1): 1213-1218.
[37]OUYANG Y, CAI X, SHI Q S, et al. Poly-l-lysine-modified reduced graphene oxide stabilizes the copper nanoparticles with higher water-solubility and long-term additively antibacterial activity[J]. Colloids and Surfaces B: Biointerfaces, 2013, 107: 107-114.
[38]JALAL R, GOHARSHADI E K, ABRARESHI M, et al. ZnO nanofluids: green synthesis, characterization, and antibacterial activity[J]. Materials Chemistry and Physics, 2010, 121(1): 198-201.
[39]KAVITHA T, GOPALAN A I, LEE K P, et al. Glucose sensing, photocatalytic and antibacterial properties of graphene ZnO nanoparticle hybrids[J]. Carbon, 2012, 50(8): 2994-3000.
[40]LI J, WANG G, ZHU H, et al. Antibacterial activity of large-area monolayer graphene film manipulated by charge transfer[J]. Scientific reports, 2014, 4: 4359.
[41]SMITH S C, RODRIGUES D F. Carbon-based nanomaterials for removal of chemical and biological contaminants from water: a review of mechanisms and applications[J]. Carbon, 2015, 91: 122-143.
[42]GOLDSTEIN S, MEYERSTEIM D, CZAPSKI G. The fenton reagents[J]. Free Radical Biology and Medicine, 1993, 15(4): 435-445.
[43]ZHAO Y, CHEN W, YUAN C, et al. Hydrogenated graphene as metal-free catalyst for Fenton-like reaction[J]. Chinese Journal of Chemical Physics, 2012, 25(3): 335-338.
[44]YANG H H, MCCREERY R L. Elucidation of the mechanism of dioxygen reduction on metal-free carbon electrodes[J]. Journal of the Electrochemical Society, 2000, 147(9): 3420-3428.
[45]ZUBIR N A, YACOU C, MOTUZAS J, et al. The sacrificial role of graphene oxide in stabilising a Fenton-like catalyst GO-Fe3O4[J]. Chemical Communications, 2015, 51(45): 9291-9293.
[46]KE Z, MA Y, ZHU Z, et al. Non-thermal hydrogen flasma processing effectively increases the antibacterial activity of graphene oxide[J]. Applied Physics Letters, 2018, 112:013701.

