膨化方式对发芽糙米 主要生理活性物质的影响
韩 璐,卢小卓,朱力杰,王 勃,杨立娜,刘 贺,何余堂,马 涛
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工 及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
发芽糙米是将糙米置于一定温度、湿度下进行培养,使之萌发到一定长度,所得到的由幼芽和带糠层的胚乳组成的糙米制品[1]。糙米经发芽后,酶被激活,内含的化学成分发生变化,γ-氨基丁酸(GABA)、谷维素、肌醇等生理活性物质含量大大增加[2]。GABA是一种非蛋白质氨基酸,是由谷氨酸经谷氨酸脱羧酶催化生成的,是一种重要的抑制性神经递质[3]。肌醇六磷酸酯,又称植酸,是影响矿物质元素吸收的主要抗营养成分。糙米在发芽过程中植酸酶被激活,植酸被降解,减少抗营养性,并且会生成对人体健康很有益处的肌醇,提高了糙米的营养价值[4-5]。谷维素是阿魏酸与植物甾醇的结合酯类,主要存在于米糠油及其油脚中,米糠层中谷维素的含量为0.3%~0.5%,谷维素是一种强力抗氧化物,能降低胆固醇,对神经衰弱症患者也具有一定的调节作用[6]。
膨化是食品加工常用的技术方法之一,它可使物料内部的水分液化,在压力差作用下,使物料膨胀,高分子物质结构变性,形成多孔网状组织结构[7]。食品经膨化后,主要成分、外观、风味、质构等都会发生明显的变化。淀粉、粗纤维、蛋白质、脂肪等大分子物质被切断成小分子物质,例如将长链淀粉切断成水溶性淀粉、还原糖等,将一部分蛋白质分解成肽和氨基酸,增加食品风味,易于消化吸收。目前对发芽糙米的研究多集中在膨化米制品的开发工艺[8]、膨化条件的优化[9-10]、膨化对糙米理化性质的影响等方面,对生理活性物质的研究相对较少。
膨化技术中最为常用的为挤压膨化和微波膨化两种,故本实验选用了挤压和微波两种膨化方式对发芽糙米进行处理,测定膨化前后发芽糙米中生理活性物质γ-氨基丁酸、植酸、谷维素的变化规律,以期得到最大限度保存发芽糙米中生理活性物质的膨化方式。
1 材料与方法
1.1 材料与仪器
发芽糙米 本溪寨香生态农业有限公司提供,物料含水量14%(湿基);γ-氨基丁酸标准品(99%) 北京索莱宝科技有限公司;谷维素标准品 大连美仑生物技术有限公司;乙酸钠、邻苯二甲醛、磷酸二氢钾、钼酸钠、硫酸肼、氯化铁、四硼酸钠、氢氧化钠、无水乙醇 国药集团化学试剂有限公司,均为分析纯;甲醇、乙腈 均为色谱纯。
G7OF23N1P-M8(SO)型微波炉 格兰仕微炉电器有限公司;电热恒温水浴锅 北京市永光明医疗仪器有限公司;Agilent 1260 Infinity高效液相色谱仪 安捷伦科技(中国)有限公司;UV-2802型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;TDL-5-A型离心机 上海安亭科学仪器厂;AR224CN型电子分析天平 奥豪斯仪器上海有限公司;SL-250A型高速多功能粉碎机 浙江省永康市松青五金厂;CR-400型色差计 日本koivica minolta公司。
1.2 实验方法
1.2.1 挤压膨化工艺 对发芽糙米进行挤压膨化处理,挤压膨化参数为:Ⅰ区温度50 ℃,Ⅱ区温度165 ℃,Ⅲ区温度205 ℃,螺杆转速35 r/min。将膨化后的发芽糙米粉碎,过100目筛,4 ℃冷藏备用。
1.2.2 微波膨化工艺 对发芽糙米进行微波膨化处理,微波参数为:进样量100 g,微波功率800 W,微波时间150 s。将膨化后的发芽糙米粉碎,过100目筛,4 ℃冷藏备用。
1.2.3 吸水指数(WAI)和水溶指数(WSI)的测定 参考VAMSHIDHAR[11]和JONES[12]的测定方法,略有改动:准确称取2.50 g样品置于50 mL离心管中,加入 30 mL 去离子水,在30 ℃条件下振荡30 min,再以3000 r/min 的转速离心10 min,分离上清液和沉淀物。上清液倾倒于恒重的培养皿中,在105 ℃温度下蒸发至恒重。WSI 和 WAI 按下式计算:
其中:m1为样品的干重(g),m2为上清液蒸发干后残余物质量(g),m3为倾出上清液后沉淀的质量(g)。
1.2.4 色泽的测定 采用色差计测定样品的L*、a*、b*值,其中,a*值代表物质的红绿程度,a*为正值表示物质偏红色,为负值表示偏绿色。b*值代表物质的黄蓝程度,b*为正值表示物质偏黄色,为负值表示偏蓝色。按公式计算ΔE值:
其中:ΔE为色差值;L、a、b分别表示样品的L*、a*、b*值,L0、a0、b0分别表示对照品的L*、a*、b*值。
1.2.5 GABA含量的测定
1.2.5.1 标准曲线的绘制 准确称取质量浓度为20、40、60、80、100 μg/mL的GABA标准溶液1 mL,加入1 mL邻苯二甲醛衍生试剂,混匀,衍生反应2 min后过滤,以GABA相应浓度为横坐标以峰面积为纵坐标做标准曲线。
1.2.5.2 样品溶液的制备 精确称取3 g过筛后的发芽糙米粉溶于50 mL 60%乙醇中,50 ℃水浴振荡1 h,以3000 r/min的速度离心15 min,将上清液过0.45 μm膜,备用。
1.2.5.3 色谱条件 参考程威威的方法并略作修改[13]。色谱柱Eclipse Plus C18(250 mm×4.6 mm×5 μm);流动相A:0.025 mol/L pH(5.90±0.05)的乙酸钠溶液;流动相B:纯乙腈;紫外检测器:发射波长332 nm;流速为0.5 mL/min;柱温:40 ℃;进样:10 μL;梯度洗脱程序如表1所示:
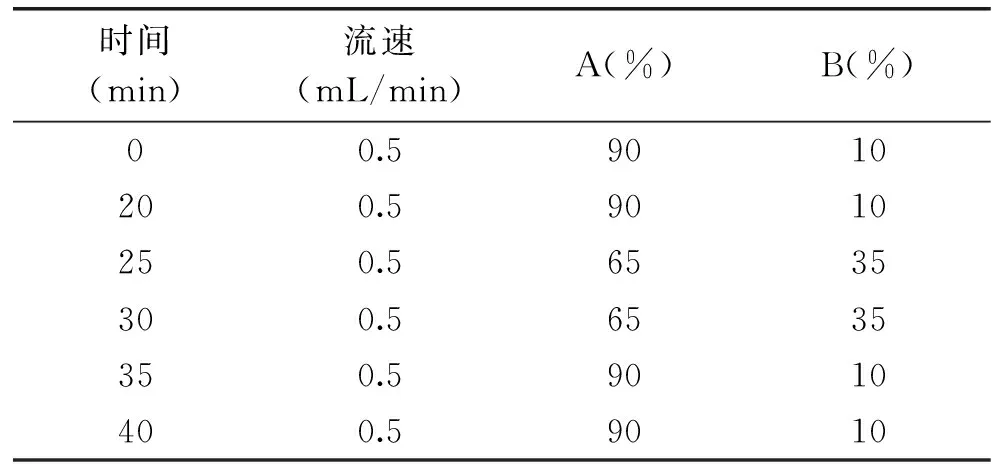
表1 测定γ-氨基丁酸的HPLC梯度洗脱程序表Table 1 Gradient elution program for separation of γ-aminobutyric acid by HPLC
1.2.6 植酸含量的测定
1.2.6.1 标准曲线的制作 分别量取0.01 mg/mL的磷酸二氢钾标准溶液0、1.0、2.0、4.0、6.0、8.0、10.0 mL于50 mL容量瓶,再分别补加蒸馏水至10 mL,依次加入2.0 mL钼酸钠与8.0 mL硫酸肼溶液,摇匀,沸水浴10 min,用冷水冷却至室温,蒸馏水定容至刻度。静置10 min,于波长650 nm处测定吸光度[14]。
1.2.6.2 测定方法 取2.50 g发芽糙米样品溶于50 mL质量分数为1.2%的盐酸溶液,室温震荡2 h,4500 r/min离心,取上清液。
准确移取10 mL上清液于坩埚内,加入少量ZnO,在电炉上炭化完全。然后将坩埚放入550~600 ℃的马弗炉中煅烧2 h,冷却至室温后,加入5 mL蒸馏水和5 mL HCl,在电炉上微沸5 min,然后过滤至100 mL容量瓶,分别用5 mL蒸馏水洗涤坩埚及滤纸5次。滤液冷却至室温后,滴加50%的NaOH溶液至滤液呈微浑浊,滴加盐酸至沉淀溶解,多滴2滴使溶液呈微酸性,用蒸馏水定容至刻度。用移液管移取上述液10 mL,总磷含量的测定方法同1.2.6.1。
准确移取离心后的上清液10 mL,加入10 mL蒸馏水与12 mL FeCl3溶液,在沸水浴中加热75 min。冷却至室温后过滤,得到澄清滤液。移取10 mL滤液,游离磷含量的测定方法同1.2.6.1。
根据总磷与游离磷的差值换算样品中植酸含量及植酸降解率。
1.2.7γ-谷维素含量的测定
1.2.7.1 标准曲线的制作 准确称取0.04 gγ-谷维素标准品于100 mL棕色容量瓶中,加入4 mL三氯甲烷,再用无水乙醇定容至刻度线。吸取0.1、0.25、0.5、1.0、1.5、2.0 mL标准液分别于50 mL棕色容量瓶中,用无水乙醇定容,以无水乙醇做空白样液,在327 nm处测定吸光度,制作标准曲线[15]。
1.2.7.2 样品中γ-谷维素含量的测定 称取0.50 g发芽糙米样品于50 mL棕色容量瓶中,加2 mL三氯甲烷溶解,再用无水乙醇定容,静置40 min后过滤,取滤液于327 nm处测定吸光度。
2 结果与分析
2.1 膨化方式对发芽糙米WAI和WSI的影响
WAI和WSI是评价膨化食品的良好指标。其中,WSI用来评价分子的降解程度,其大小与膨化后发芽糙米中淀粉释放的可溶性糖等小分子物质的量成正比[16]。由表2可以看出,微波膨化、挤压膨化均提高了发芽糙米的WAI,分别约为原料发芽糙米的1.84、2.81倍。这可能是因为发芽糙米经膨化后内部形成了较多的孔状结构,这些孔洞会通过毛细管作用来吸收并保持水分不流失,所以增加了WAI。但是,不同膨化方式对发芽糙米的WSI有不同的影响作用,其中,挤压膨化显著增加了发芽糙米的WSI(p<0.05),约为原料米的2.38倍,这可能是因为挤压膨化是在高温高压及高剪切力的条件下进行的,在此过程中,发芽糙米中的淀粉糊化裂解,纤维素降解成葡萄糖,蛋白质裂解,都会导致挤压膨化发芽糙米中的水溶性物质增多[17]。而微波膨化则降低了发芽糙米的WSI,从下表中可以看出,微波膨化后发芽糙米的WSI从(7.43%±0.26%)下降到(3.12%±0.14%),这可能是因为微波的高温条件会使发芽糙米迅速脱去水分,蛋白质的三级与四级结构遭到破坏,蛋白质分子进行伸展、重组,分子间的二硫键与氢键部分断裂,导致蛋白质变性,把可溶性物质包裹在凝胶聚合物中,增加蛋白质的疏水作用,从而降低了蛋白质的溶解性,此外,由于淀粉颗粒中大量变性蛋白质的存在,大大延长了水分扩散到颗粒中的时间,进而阻碍了淀粉流动到外部介质的进程,最终会导致水溶指数的降低[18]。

表2 不同膨化方式对发芽糙米 吸水指数和水溶指数的影响Table 2 The effects of different puffing methods on water absorption index and water solubility index of germinated brown rice
2.2 膨化方式对发芽糙米色泽的影响
不同膨化方式对发芽糙米色泽的变化如表3所示。由表3中可以看出,微波和挤压膨化后的发芽糙米的L*值都低于原料发芽糙米的L*值,分别降低了9.29%、4.41%,这说明膨化后的发芽糙米褐变程度变大[19],L*值代表明度,L*值越大,表示褐变程度越小。a*值显著高于原料发芽糙米(p<0.05),b*值的变化趋势与a*值一样,这表明原料发芽糙米、挤压膨化发芽糙米和微波膨化发芽糙米都主要以黄色为主,略带绿色。这种结果可能是因为挤压膨化作用会使淀粉分子和蛋白质发生美拉德反应,生成深色的蛋白黑素[20],还可能是因为微波和挤压膨化的高温致使褐变程度增加,导致pH下降,抑制美拉德反应的进行,未完全反应的糖自身降解生成一部分褐色物质[21]。

表3 不同膨化方式对发芽糙米色泽的影响Table 3 The effects of different puffing methods on the color of germinated brown rice
2.3 膨化对发芽糙米中GABA的影响
2.3.1 GABA的定性分析 在1.2.5.3的色谱条件下,对GABA标准品及发芽糙米样品进行进样洗脱,得到的色谱图如图1,由图可以看出,GABA的保留时间在33 min左右,发芽糙米样品中的其它成分对目标物的测定无干扰。
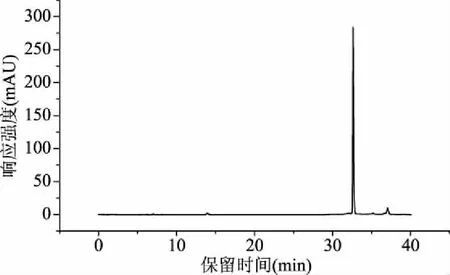
图1 GABA标准品的HPLC图谱Fig.1 The HPLC results of GABA standard
2.3.2 标准曲线的绘制 将质量浓度20、40、60、80、100 μg/mL GABA标准溶液进行色谱测定,以GABA相应浓度为横坐标X1,以峰面积为纵坐标Y1做标准曲线。绘制的标准曲线如图2,得到回归方程Y1=22.888X1+25.29,R2=0.999。
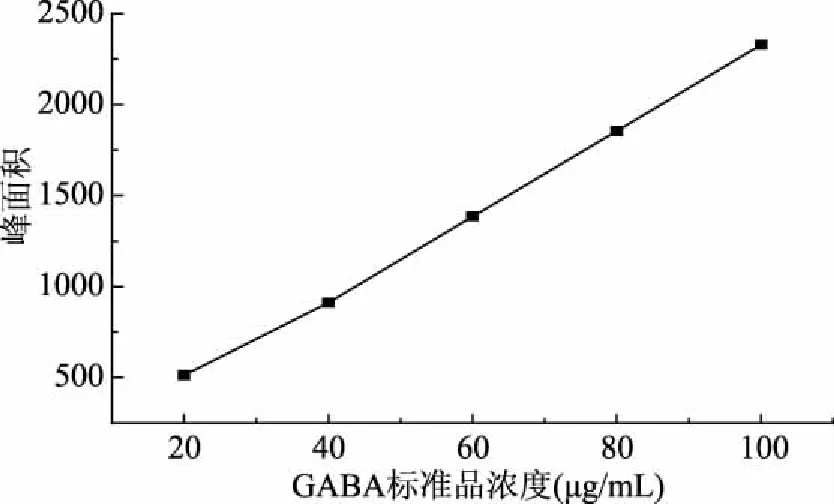
图2 GABA的标准曲线Fig.2 The standard curve of GABA
2.3.3 膨化对发芽糙米样品GABA含量的影响 不同膨化条件对发芽糙米中GABA含量的影响如图3所示,从图3中可以看出,微波膨化及挤压膨化后发芽糙米中GABA含量都显著下降,分别减少了40.42%和24.49%,这可能是因为GABA是一种非蛋白质氨基酸,它会在高温状态下与其它物质反应,高温也会破坏GABA的结构,使GABA发生降解,还会与还原糖发生美拉德反应[22]。由图可知,微波膨化比挤压膨化对GABA的损害更为严重,这可能是因为微波膨化比挤压膨化的温度升高的更快,虽然对发芽糙米进行了高温、高压和高剪切力处理,但处理时间短,而微波膨化则在高温高压的条件下对发芽糙米进行较长时间的处理,因此造成了微波膨化后的发芽糙米中GABA含量比挤压膨化处理的下降更为明显。
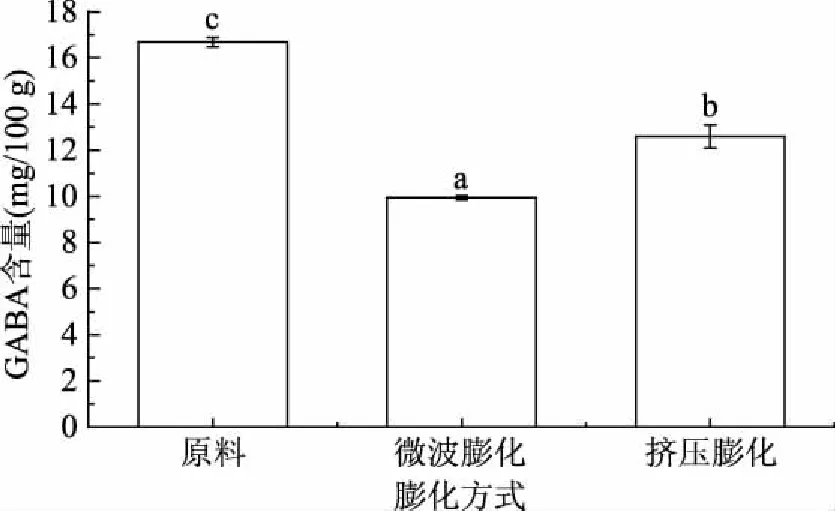
图3 不同膨化方式对发芽糙米中GABA含量的影响Fig.3 The effects of different puffing methods on GABA content in germinated brown rice
2.4 不同膨化条件对发芽糙米中植酸含量的影响
2.4.1 标准曲线的绘制 以磷含量为横坐标X2,650 nm处测得的吸光度为纵坐标Y2,绘制标准曲线如图4,得到线性回归方程Y2=4.0548X2-0.0032,R2=0.9998。

图4 磷酸二氢钾的标准曲线Fig.4 The standard curve of potassium dihydrogen phosphate
2.4.2 不同膨化条件对发芽糙米中植酸含量的影响 不同膨化条件下发芽糙米中的植酸含量如图5所示。植酸主要贮藏在发芽糙米的糊粉层中,它能与二价或三价的金属阳离子发生螯合反应,生成不溶于水的化合物,会影响人体对金属离子的吸收作用,因此,植酸常作为抗营养因子存在于植物中[23]。由图5可以看出,微波膨化和挤压膨化都降低了发芽糙米中植酸的含量,植酸降解率分别为6.98%和14.17%。这可能是因为在高温、高压、高剪切速率的条件下,发芽糙米的细胞壁破裂,细胞的组织结构发生了变化,导致植酸分子降解,降低了植酸的含量,而微波膨化温度升高的速度快,使发芽糙米中的淀粉分子发生糊化,糊化后的淀粉等物质会把植酸分子包裹起来,所以裂解的植酸就相对少于挤压膨化的植酸分子,这也就解释了图5中微波膨化后的植酸含量为什么显著低于挤压膨化后的植酸含量[24]。
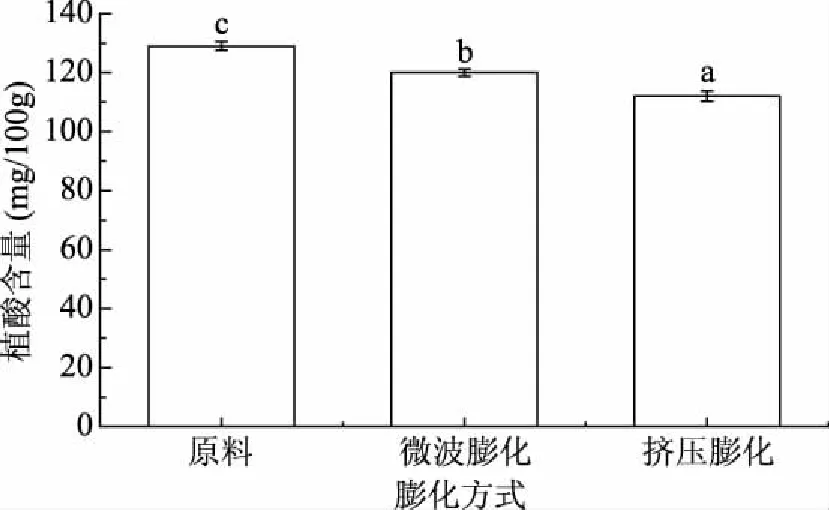
图5 不同膨化方式对发芽糙米中植酸含量的影响Fig.5 The effects of different puffing methods on phytic acid content in germinated brown rice
2.5 不同膨化条件对发芽糙米中γ-谷维素含量的影响
2.5.1 标准曲线的绘制 以γ-谷维素含量为横坐标X3,327 nm处测得的吸光度为纵坐标Y3,绘制标准曲线如图6,得到线性回归方程Y3=0.513X3+0.0091,R2=0.9997。

图6 谷维素的标准曲线Fig.6 The standard curve of oryzanol
2.5.2 不同膨化条件对发芽糙米中γ-谷维素含量的影响 谷维素存在于发芽糙米的米糠层中,不溶于水,是一种脂溶性不皂化物,阿魏酸分子与阿拉伯木聚糖以酯键形式键合,挤压膨化的高压、高剪切的条件可能使酯键断裂,造成谷维素的损失[25]。不同膨化条件下发芽糙米中的谷维素含量如图7所示,由图中可以看出,微波膨化后的发芽糙米中谷维素含量升高,是原料的1.44倍;而挤压膨化后谷维素含量大幅度下降,减少了89.2%。造成这种情况的原因可能是微波加热过程中微波能够深入到物料内部而不靠物体本身的热传导进行加热,所以温度升高的速度快,快速加热可以加速发芽糙米的纤维分子之间化学键的断裂,致使淀粉分子的结构变化,释放出大量的谷维素[26]。
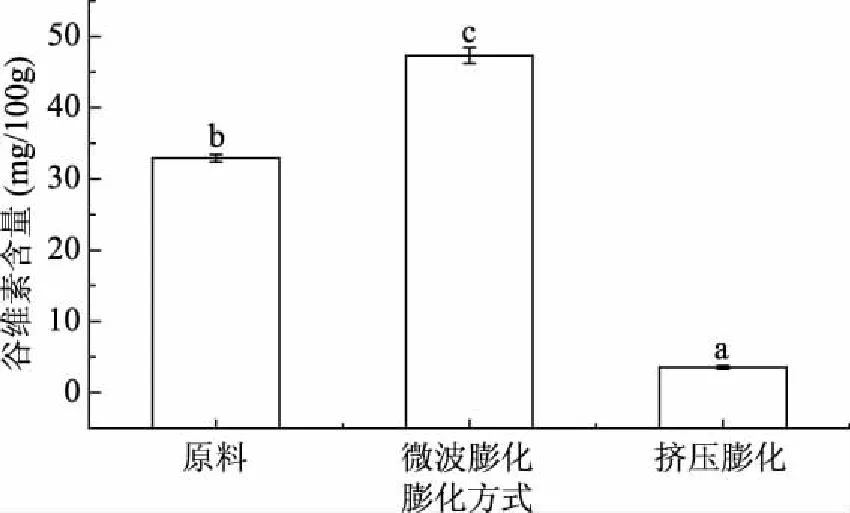
图7 不同膨化方式对发芽糙米中谷维素含量的影响Fig.7 The effects of different puffing methods on oryzanol content in germinated brown rice
3 结论
以发芽糙米为原料,研究了微波膨化和挤压膨化两种膨化方式对发芽糙米中主要生理活性物质GABA、谷维素和植酸含量的影响,实验表明,微波、挤压膨化均显著提高了发芽糙米的吸水指数(p<0.05),但对水溶指数的影响则不相同,挤压膨化增加了发芽糙米的水溶指数,而微波膨化大大降低了水溶指数。挤压膨化降低了发芽糙米中GABA、谷维素的含量,对谷维素造成极大的损失;而微波膨化则提高了谷维素的含量,对GABA的损失较少;微波与挤压膨化均对植酸的降解起到了促进作用。综上所述,微波膨化相比较于挤压膨化对发芽糙米的色泽、生理活性物质的影响相对较小。
[1]唐淑芬,刘香云.发芽糙米研究进展[J]. 粮食加工,2011,36(6):22-24.
[2]周婷.糙米发芽过程中营养成分变化规律及新产品开发[D]. 湖南:中南林业科技大学,2014.
[3]Kim J Y,Lee M Y,Ji G E,et al. Production of gamma-aminobutyric acid in black raspberry juice during fermentation by Lactobacillus brevis GABA100[J]. International Journal of Food Microbiology,2009,130(1):12-6.
[4]Shamsuddin A M,Vucenik I,Cole K E. IP6:a novel anti-cancer agent[J]. Life Sciences,1997,61(4):343-54.
[5]张正磊,周惠明.酶法降解糙米中植酸初探(一)-糙米中植酸提取或降解方式的选择[J].食品工业科技,1999,20(2):35-36.
[6]Ohtsubo K,Suzuki K,Yasui Y,et al. Bio-functional components in the processed pre-germinated brown rice by a twin-screw extruder[J]. Journal of Food Composition & Analysis,2005,18(4):303-316.
[7]李锴. 糙米挤压膨化的研究[D]. 无锡:江南大学,2009.
[8]韩永斌,刘桂玲,史晓媛,等.挤压膨化对发芽糙米理化性质的影响[J]. 中国粮油学报,2010,25(12):1-5.
[9]王丽娟,杨雪飞,黄毅,等.挤压工艺参数对膨化杂粮粉感官品质的影响[J]. 食品科学,2013,34(12):67-70.
[10]刘晓娟,龚丽,毛新,等.高温短时气流膨化薏米工艺优化[J].农业工程学报,2012,28(15):258-263.
[11]Puppala V. Texture comparison of traditional and extruded cornflakes.[J]. Cereal Foods World,1998,43(8):650-652.
[12]Jones D,Chinnaswamy R,Tan Y,et al. Physiochemical properties of ready-to-eat breakfast cereals.[J]. Cereal Foods World,2000,45(4):164-168.
[13]程威威. HPLC检测发芽糙米中GABA不同衍生方式评价及其制备关键技术初探[D].湖南:中南林业科技大学,2014.
[14]赵仁勇,毕艳兰,朱永义.糙米及其制品中植酸含量的测定方法[J]. 粮食与饲料工业,2002(1):44-45.
[15]龚院生,姚惠源,杭敏.米糠水溶性提取物中γ-谷维醇的富集和米糠保健饮料工艺研究[J]. 食品科学,2001,01(3):47-49.
[16]N A Oikonomou,M K Krokida. Water absorption index and water solubility index prediction for extruded food products[J]. International Journal of Food Properties,2012,15(1):157-168.
[17]赵颖,申莉丽,姜雯翔,等.3种膨化方式处理对萌芽糙米品质的影响[J].食品与发酵工业,2016,42(3):150-155.
[18]Ekanayake S,Nair B M,Asp N G,et al. Effect of Processing of Sword Beans(Canavaliagladiata)on Physicochemical Properties of Starch[J]. Starch-Stärke,2006,58(5):215-222.
[19]张冬媛,邓媛元,张名位,等.发芽-挤压-淀粉酶协同处理对速食糙米粉品质特性的影响[J]. 中国农业科学,2015,48(4):759-768.
[20]姜雯翔,赵黎平,顾振新,等.发芽糙米焙炒过程中品质变化研究[J]. 食品科学,2014,35(19):72-76.
[21]余小映,沈硕,韩文芳,等.米茶的焙炒工艺研究[J]. 中国粮油学报,2012,27(7):91-96.
[22]Barbé F,Ménard O,Le G Y,et al. The heat treatment and the gelation are strong determinants of the kinetics of milk proteins digestion and of the peripheral availability of amino acids[J]. Food Chemistry,2013,136(3-4):1203.
[23]吴凤凤.发芽对糙米主要营养成分、生理功效和加工特性的影响[D].无锡:江南大学,2013.
[24]卢敏.降低糙米中抗营养因子植酸含量的途径及作用机理的研究[D].长春:吉林大学,2006.
[25]蒋维维,易金娥,谭柱良.γ-谷维素的生物活性研究进展[J]. 食品与发酵工业,2015,41(6):253-258.
[26]张珺,朱香燕,何义雁,等.不同加工方法对糙米主要活性物质的影响研究[J]. 粮食科技与经济,2015,40(2):60-63.

