qPCR快速定量检测泡结球甘蓝 发酵过程中优势细菌的数量变化
汪冬冬,宋亚谊,陈 功,3,李 恒,3,申文熹,伍亚龙, 王 勇,唐 垚,章宇丹,张 伟,朱 翔,张其圣,3,*
(1.四川东坡中国泡菜产业技术研究院,四川眉山 620000;2.四川大学锦江学院,四川眉山 620860; 3.四川省食品发酵工业研究设计院,四川温江 611130)
泡菜是中国典型传统乳酸发酵制品,其发酵过程中微生物体系庞大且复杂。探明泡菜发酵过程中微生物群落结构的演变与动态变化规律,有利于了解并掌控泡菜的发酵过程,进而保证产品的质量安全性。杨瑞等发现泡菜发酵过程中乳酸菌处于优势地位并抑制发酵初期中占优势的大肠埃希氏菌等杂菌生长[1]。盛海圆等研究表明泡菜中乳杆菌属占主要优势,其次为肠球菌属、葡萄球菌属和片球菌属,其中乳杆菌中植物乳杆菌占明显优势[2]。张先琴等研究表明在泡菜细菌中乳杆菌属是优势种群,占总数的56%[3]。赵永威等研究结果显示腌制冬瓜发酵过程中优势菌有乳杆菌属、魏斯氏菌属、芽孢杆菌属、肠杆菌属和葡萄球菌属等[4]。现有报道的泡菜发酵乳酸菌包括10余个属100多个种[5],而乳杆菌属,尤其是植物乳杆菌是广泛报道的主导泡菜发酵的优势微生物[6]。泡菜发酵过程中的优势微生物的生长是一个动态变化的过程,采用传统培养方法,费时、费力,而且由于培养基的选择性以及不可培养微生物的影响,无法快速准确地反映泡菜发酵过程中的微生物群落构成及动态变化;而采用免培养方法如PCR-DGGE和高通量测序,耗时长、费用高、只能反映相对构成。
近年来,qPCR技术,即实时荧光定量PCR(Quantitative Real-time PCR)技术已经广泛应用于食品微生物的快速检测,此方法可以目的明确、快速、准确计量发酵体系中特定微生物,在发酵蔬菜和发酵橄榄中也有一些应用[7-8]。石慧等采用qPCR结合DNA染料的方法,建立了快速检测泡菜中乳酸菌活菌的EMA-qPCR法[9]。孟霞等采用18S rDNA克隆文库结合ARDRA分型分析对青菜泡菜发酵过程真菌的多样性进行研究,并采用qPCR方法对其进行验证,两种方法结果基本吻合[10]。魏娜等通过qPCR技术,定量分析不同窖龄窖泥中的古菌、总细菌和群瘤胃菌、乳杆菌和毛螺旋菌三种优势菌群[11]。周晓红等采用qPCR方法检测沙门菌、志贺菌等食源性致病菌[12]。
为快速定量监控泡菜发酵过程中优势细菌的动态变化,本实验建立了利用qPCR技术快速检测植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌的方法,以期为泡菜发酵质量的快速判定以及深入了解、控制泡菜发酵过程提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
结球甘蓝、食盐 眉山某超市;2xSG Fast qPCR Master Mix 上海生工生物;Bacterial DNA Isolation Kit、Taq PCR Master Mix 成都福际生物;PCR引物 成都擎科梓熙生物技术有限公司;DNase/RNase-Free Deionized Water 北京天根生化;BHI培养基、MRS培养基、PCA培养基、无水乙醇 眉山和通化工;目标菌株由四川东坡中国泡菜产业技术研究院提供(见表1)。

表1 目标菌及其qPCR扩增引物Table 1 Dominant bacteria and qPCR amplification primers
高速离心机 Thermo Scientific;单人单面净化工作台 苏净净化有限公司;T960PCR仪 杭州晶格有限公司;DYY-8C电泳仪 北京六一有限公司;JY04S-3E凝胶成像仪 君意东方有限公司;实时荧光PCR仪 Bio-Rad;立式压力蒸汽灭菌器 上海三申有限公司;JD200-3电子天平 龙腾电子有限公司;DHP-9270B电热恒温培养箱 上海琅玕有限公司;HH-4恒温水浴锅 江苏澳华仪器有限公司;电子万用炉 北京永光明有限公司;QL-901旋涡混合器 江苏其林贝尔有限公司;Mini-6K低速离心机 杭州奥盛有限公司。
1.2 实验方法
1.2.1 泡菜制作及取样 将泡菜坛和新鲜结球甘蓝清洗干净,结球甘蓝切好备用,称取700 g切好的结球甘蓝放入泡菜坛中,加入备好的纯净水1400 mL,加入42 g食盐,25 ℃恒温发酵;同时泡制两坛泡菜。分别于0、1、2、3、5、7、10 d取泡菜发酵液进行分析,每次取样5 mL,置于-20 ℃密封保存。取样时先将泡菜轻轻摇匀,取周边4 个点和中间2 个样进行混合。
1.2.2 样品总DNA提取 采用试剂盒(Bacterial DNA Isolation Kit)方法提取泡菜发酵液样品的DNA,-20 ℃密封保存。具体操作步骤如下:在1.5 mL离心管中加入1.5 mL样品,12000 r/min室温离心1 min,吸尽上清液,向离心管中加入0.16 mL Buffer EB,重悬菌体;再加入40 μL溶菌酶(50 mg/mL),漩涡混匀,37 ℃放置30 min;7200 r/min离心3 min,除去上清液。向沉淀中加入380 μL Buffer ML1,旋涡震荡使菌体彻底悬浮;加入20 μL Foregene Protease,旋涡混匀;将离心管于65 ℃水浴30 min,并每隔10 min漩涡混匀一次;加入380 μL Buffer ML2,颠倒混匀,65 ℃水浴10 min;12000 r/min离心10 min。吸取750 μL上清至新离心管,加入150 μL无水乙醇,剧烈震荡至充分混匀。将混合液移至离心柱,12000 r/min离心1 min,弃掉收集管中废液。向离心柱中加入500 μL Buffer PW,12000 r/min离心1 min,弃掉收集管中废液。向离心柱中加入700 μL Buffer WB,12000 r/min离心1 min,弃掉收集管中废液,并重复操作一次。12000 r/min空管离心2 min,将离心柱移至新的1.5 mL离心管中,向膜中央悬滴100 μL已65 ℃预热的Buffer EB,室温放置5 min,12000 r/min离心1 min。将离心管中洗脱液移回至离心柱,12000 r/min离心1 min,收集洗脱液。
1.2.3 标准质粒制备 分别将菌株12CR5在MRS培养基中,3Z8D25和1S5D25在PCA培养基中、0R3在BHI培养基中活化后,采用试剂盒方法提取纯化DNA。再进行细菌16S rDNA序列PCR扩增,扩增引物为27F(AGAGTTTGATCCTGGCTCAG)和1492R(GGTTACCTTGTTACGACTT),扩增体系(50 μL):2×PCR Mix 25 μL、模板DNA 1.5 μL、引物27F(10 μmol/L)和1492R(10 μmol/L)各2 μL,加双重蒸馏水补充至50 μL;扩增程序:95 ℃预变性10 min;93 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,共35次循环;72 ℃延伸10 min。用2.0%的琼脂糖凝胶对PCR产物(大小约1500 bp)进行电泳检测,将PCR扩增产物送至生工生物工程(上海)股份有限公司进行标准质粒制备,质粒拷贝浓度C/(copy/mL)计算公式[17]:
C=[DNA amount(g/mL)×6.02×1023(copy/mole)]/[DNA length(bp)×660(g/mole/bp)]
1.2.4 qPCR扩增 植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌qPCR扩增体系见表2,扩增程序见表3:

表2 qPCR反应体系Table 2 qPCR reaction system
1.2.5 标准曲线的建立 将标准质粒依次10倍稀释得1012~106copies/mL的梯度浓度,将其作为DNA模板进行qPCR扩增,反应体系及扩增程序见1.2.4中表2和表3。每种标准质粒做两组平行样,每组模板梯度加入一个空白对照,取其平均值,以标准质粒初始拷贝浓度对数值为横坐标,相应的CT值为纵坐标,绘制标准曲线,并计算其扩增效率E。
计算公式[18]:E(%)=(10-1/slope-1)×100
1.2.6 熔解曲线制作 1.2.4扩增程序中40个循环结束后,从65 ℃每5 s升高0.5 ℃直至95 ℃,此中每阶段采集荧光信号,最后以温度为横坐标,荧光值变化速度为纵坐标绘制熔解曲线。
1.3 数据统计分析
采用Excle绘制标准曲线,计算测定结果,Originpro 8.6作图。
2 结果与分析
2.1 标准曲线的构建
标准质粒线性回归方程、相关系数、扩增效率见表4,110%≥扩增效率(E)≥90%,R2≥0.98,均符合qPCR检测基本要求[18-19]。同时样品中植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌的CT值均在相应标准曲线测定质粒浓度范围内,表明其测定结果准确可靠。

表4 植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌qPCR标准曲线相关表Table 4 Standard curve for quantification of Lactobacillus plantarum,Bacillus,Staphylococcus and Escherichia coli
2.2 回收率分析
目标菌回收率和标准质粒、样品、加标样品浓度如表5所示。各目标菌标准质粒回收率均在80%~100%范围内,表明1.2.2中DNA提取纯化方法具有较高准确性,可用于对泡菜液样品进行处理。
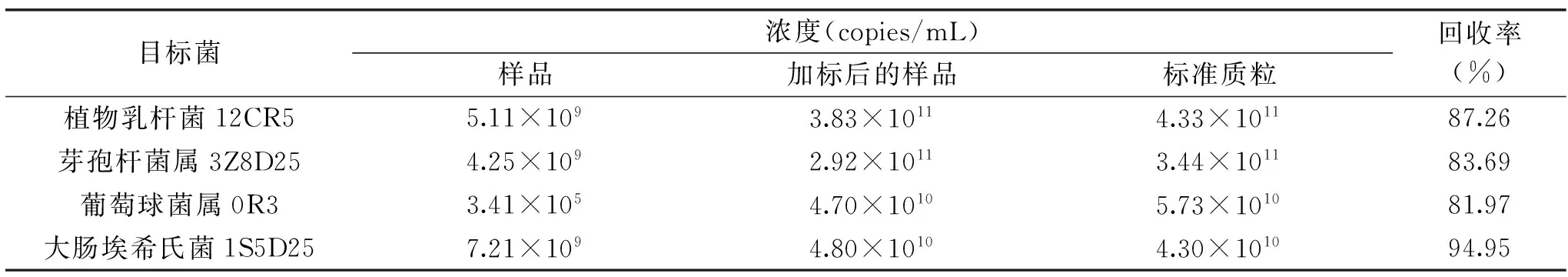
表5 植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌qPCR的加标回收率检测Table 5 Standard Recovery of qPCR of the Lactobacillus plantarum,Bacillus,Staphylococcus and Escherichia coli
2.3 熔解曲线分析
熔解曲线见图1,植物乳杆菌在82.5 ℃、芽孢杆菌属在88.5 ℃、葡萄球菌属在87 ℃、大肠埃希氏菌在87 ℃出现仅有的单峰,说明扩增过程中没有引物二聚体和非特异产物生成,扩增效果特异性强。
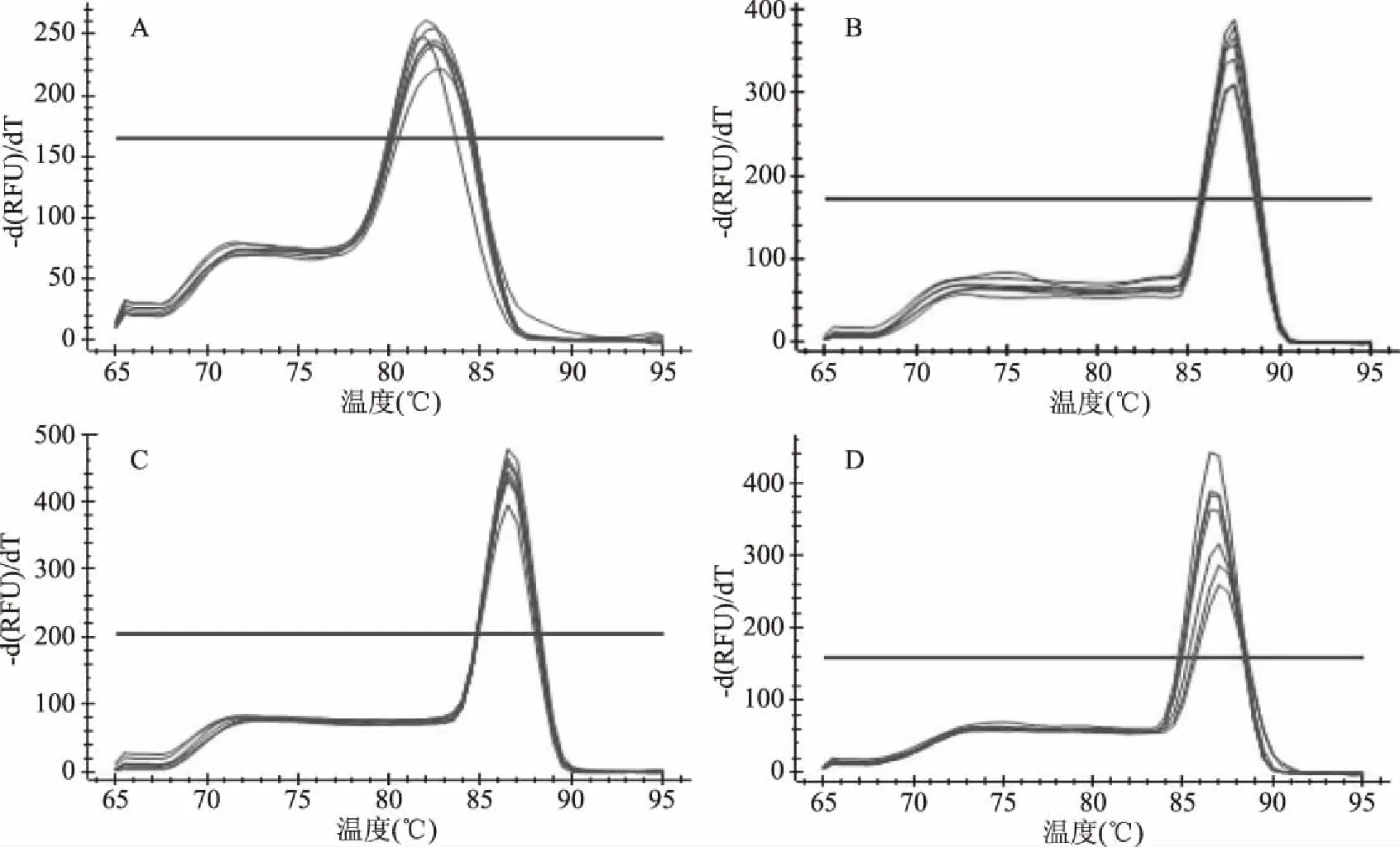
图1 植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌qPCR熔解曲线Fig.1 Melting curves of qPCR of Lactobacillus plantarum,Bacillus,Staphylococcus and Escherichia coli 注:A:植物乳杆菌;B:芽孢杆菌属;C:葡萄球菌属;D:大肠埃希氏菌,图2同。
2.4 泡结球甘蓝发酵过程中优势细菌的qPCR分析
综上所述,此次实验建立的qPCR检测方法准确可靠,可用于对泡菜液样品植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌的定量检测。采用此方法检测泡菜发酵过程中植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌的变化规律,结果如图2所示。
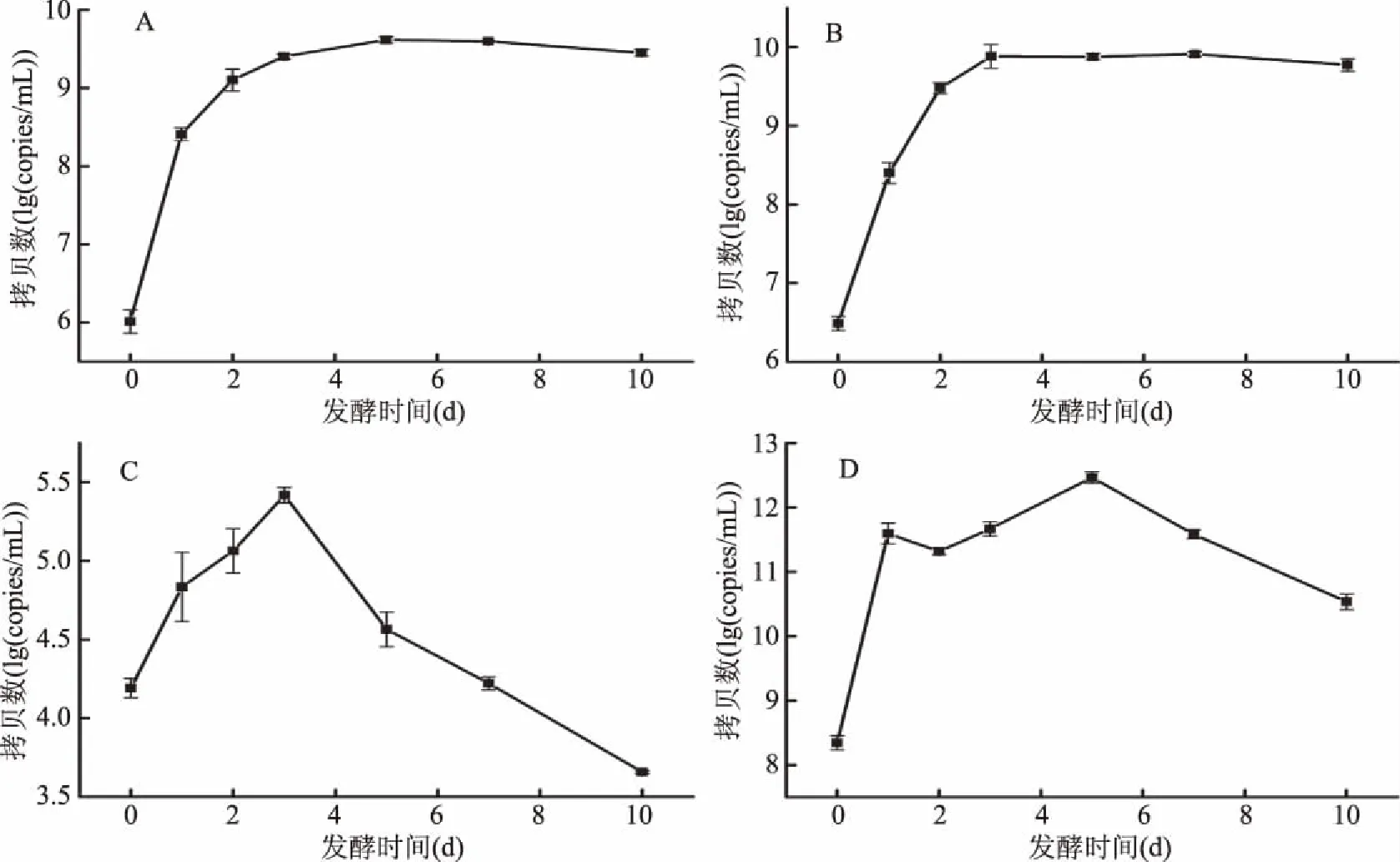
图2 泡菜液中植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌基因拷贝数变化Fig.2 Gene copy number change of Lactobacillus plantarum,Bacillus,Staphylococcus and Escherichia coli during the fermentation process of pickled cabbage
如图2所示,泡菜在自然发酵过程中,植物乳杆菌和芽孢杆菌属基因拷贝数在前期呈上升趋势,分别在5 d达到峰值(4.14±0.38)×109copies/mL和在3 d达到峰值(7.64±2.42)×109,随后其基因拷贝数一直稳定在这个数量级;葡萄球菌属和大肠埃希氏菌基因拷贝数变化趋势基本一致,均为前期上升达到峰值后稳步下降;葡萄球菌属在3 d达到峰值(2.62±0.21)×105copies/mL;大肠埃希氏菌在5 d达到峰值(2.93±0.84)×1012copies/mL。
3 结论与讨论
本研究建立了泡菜中植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌的qPCR快速定量检测方法,并将其应用到泡菜样品的检测中,标准曲线相关系数R2≥0.98,扩增效率90%≤E≤110%,样品加标回收率在80%~100%的范围内,符合qPCR基本检测要求;熔解曲线仅出现单峰,扩增特异性强,无非特异性产物生成。采用此方法对泡白菜自然发酵过程中植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌进行定量检测,实验结果显示泡菜液中植物乳杆菌和芽孢杆菌属基因拷贝数在前期呈上升趋势,分别在5 d达到峰值(4.14±0.38)×109copies/mL和在3 d达到峰值(7.64±2.42)×109,随后其基因拷贝数一直稳定在这个数量级;葡萄球菌属和大肠埃希氏菌基因拷贝数变化趋势基本一致,均为前期上升达到峰值后稳步下降;葡萄球菌属在3 d达到峰值(2.62±0.21)×105copies/mL;大肠埃希氏菌在5 d达到峰值(2.93±0.84)×1012copies/mL。在泡菜发酵前期大肠埃希氏菌处于优势地位,随着发酵的进行植物乳杆菌和芽孢杆菌属数量渐渐增长,是发酵中后期的优势菌;葡萄球菌在泡菜发酵各过程中含量相对较低。
在不同细菌细胞中16S rDNA基因片段拷贝数一般为1~15个[22],取其中间值7.5个/细胞,可大致计算出本研究样品中细菌数量。关于自然发酵泡菜中微生物动态变化现已有大量实验报道,多利用平板计数法进行微生物数量检测,本实验所得结果与文献中通过传统方法检测的泡菜自然发酵结果[23-34]相对比,植物乳杆菌、芽孢杆菌属、葡萄球菌属和大肠埃希氏菌在自然发酵泡菜中动态变化趋势相符合,但峰值出现时间滞后,且所得计数结果比传统活菌计数高。可能是因为qPCR是通过检测DNA拷贝浓度来计数细菌数量,没有区分活菌或死菌,而传统平板计数法只针对活菌进行计数;泡菜发酵过程中,微生物死亡后还未被分解的DNA,在qPCR检测中与荧光染料相结合产生荧光信号从而被定量,因此导致实验结果与传统方法结果相比较存在一定的差异。故下一步研究内容将围绕如何优化此方法缩小上述差异开展。
传统微生物培养方法,如平板计数法人为操作误差大,灵敏度低,用时长、培养基选择性和不可培养微生物局限的影响,自然环境中可培养微生物仅占环境中微生物总数的0.1%~1%[35];PCR-DGGE和高通量测序等免培养方法耗时长、费用高、只能进行相对定量。利用qPCR技术对泡菜发酵过程中微生物进行分子层面的定量检测,则克服了这些弊端,可以更快速准确地定量检测泡菜中微生物,对其发酵过程进行更好的跟踪监控,为泡菜发酵质量的快速判定以及深入了解、控制泡菜发酵过程奠定基础。
[1]杨瑞,张伟,陈炼红,等. 发酵条件对泡菜发酵过程中微生物菌系的影响[J]. 食品与发酵工业,2005,31(3):90-92.
[2]盛海圆,郭艳萍,常艳,等. 传统泡菜中乳酸菌多样性的分析[J]. 中国微生态学杂志,2010,22(7):580-582.
[3]张先琴,张小平,敖晓琳,等. PCR-DGGE分析四川地区家庭制作泡菜中微生物多样性[J]. 食品科学,2013,34(12):129-134.
[4]赵永威,吴祖芳,沈锡权,等. 冬瓜腌制过程中微生物多样性的分析[J]. 中国食品学报,2014,14(6):208-213.
[5]周光燕,张小平,钟凯,等. 乳酸菌对泡菜发酵过程中亚硝酸盐含量变化及泡菜品质的影响研究[J]. 西南农业学报,2006,19(2):290-293.
[6]荆雪娇,李艳琴,燕平梅,等. 传统发酵蔬菜微生物群落结构分析[J]. 食品与发酵科技,2016,52(1):28-32.
[7]Park E-J,Chang H-W,Kim K-H,et al. Application of quantitative real-time PCR for enumeration of total bacterial,archaeal,and yeast populations in kimchi[J]. The Journal of Microbiology,2009,47(6):682-685.
[8]Tofalo R,Schirone M,Perpetuini G,et al. Development and application of a real-time PCR-based assay to enumerate total yeasts and Pichia anomala,Pichia guillermondii and Pichia kluyveri in fermented table olives[J]. Food Control 2012,23(2),356-362.
[9]石慧,程国灵,翟百强,等. 泡菜中乳酸菌活菌的EMA结合定量PCR检测方法的建立[J]. 农业生物技术学报,2013,21(3):373-378.
[10]孟霞,裴乐乐,张安,等. 泡菜发酵过程中真菌群落结构研究及优势真菌菌群变化分析[J]. 中国调味品,2017(3):49-54.
[11]魏娜,朱晓宇,陶勇,等. 浓香型白酒窖泥中优势菌群的定量PCR分析[J]. 应用与环境生物学报,2015,21(4):635-639.
[12]周晓红,徐佩华,孙明华,等. 实时荧光定量PCR技术在食源性致病菌快速检测中的应用[J]. 上海预防医学,2014(6):313-317.
[13]Reveron I,Rodriguez H,Campos G,et al. Tannic acid-dependent modulation of selectedLactobacillusplantarumtraits linked to gastrointestinal survival[J]. PloS one,2013,8(6):e66473.
[14]Hansen B M,Leser T D,Hendriksen N B. Polymerase chain reaction assay for the detection of Bacillus cereus group cells[J]. FEMS Microbiology Letters,2001,202(2):209-213.
[15]Arboleya S,Binetti A,Salazar N,et al. Establishment and development of intestinal microbiota in preterm neonates[J]. FEMS Microbiology Ecology,2012,79(3):763-772.
[16]吕英俊. 环境水体中肠道病原菌的定量PCR检测及病原污染特性分析[D]. 西安:西安建筑科技大学,2008.
[17]Whelan J A,Russell N B,Whelan M A. A method for the absolute quantification of cDNA using real-time PCR[J]. Journal of Immunological Methods,2003,278(1-2):261-269.
[18]Kim Jo H,Kim Ji H,Wang P,et al. An improved quantitative real-time PCR assay for the enumeration of heterosigma akashiwo(raphidophyceae)cysts using a DNA debris removal method and a cyst-based standard curve[J]. Plos One,2016,11(1):e0145712.
[19]王兰,李萌,郭玮,等. 磁珠分离结合定量PCR法检测单克隆抗体产品中CHO细胞DNA残留量[J]. 中国生物制品学杂志,2014,27(4):555-558.
[20]Janssens K,De N W,Vander S G,et al. Recent trends in quantitative aspects of microscopic X-ray fluorescence analysis[J]. TrAC Trends in Analytical Chemistry,2010,29(6):464-478.
[21]Lee H U,Jung D U,Lee J H,et al. Detection of glyphosate by quantitative analysis of fluorescence and single DNA using DNA-labeled fluorescent magnetic core-shell nanoparticles[J]. Sensors and Actuators B:Chemical,2013,177:879-886.
[22]沈国华,卢英,何丁喜,等. 纯菌接种发酵技术在腌渍蔬菜加工上的应用研究(二)纯菌接种发酵技术最佳发酵模式的确定与应用[J]. 中国调味品,2002(6):24-27.
[23]张其圣,陈功,申文熹,等. 中国泡菜乳酸菌群落结构动态变化研究进展[J]. 食品与发酵科技,2016(6):1-8.
[24]熊涛,关倩倩,谢明勇. 直投式与传统发酵泡菜工艺中病原菌的变化规律[J]. 食品科学,2012,33(13):140-143.
[25]熊涛,肖阳生,李军波,等. 温度对四川泡菜中菌系及其代谢产物分布的影响[J]. 食品与发酵工业,2016,42(2):77-81.
[26]张学峰,兰恒超,颜正财,等. 致病菌在四川泡菜发酵过程中生长规律的研究[J]. 中国酿造,2013,32(4):130-132.
[27]刘亚,张鉴明. 泡菜制作过程中亚硝酸盐和微生物的变化[J]. 中国调味品,2009,34(3):99-101.
[28]关倩倩. 我国传统发酵泡菜菌系结构及其消长规律研究[D]. 南昌:南昌大学,2012.
[29]李文婷,车振明,雷激,等. 不同发酵方式泡菜理化指标及微生物数量变化的研究[J]. 中国调味品,2011,36(9):45-50.
[30]尹利端,韩北忠,黄晶晶,等. 萝卜泡菜发酵过程中食盐对微生物变化的影响[J]. 中国酿造,2005,24(3):19-21.
[31]刘春燕,夏姣,徐林,等. 红皮萝卜泡菜自然发酵过程中乳酸菌的动态变化[J]. 食品工业科技,2015,36(18):176-181.
[32]杨瑞,张伟,陈炼红,等. 发酵条件对泡菜发酵过程中微生物菌系的影响[J]. 食品与发酵工业,2005,31(3):90-92.
[33]Sun D L,Jiang X,Wu Q L,et al. Intragenomic heterogeneity of 16S rRNA genes causes overestimation of prokaryotic diversity.[J]. Applied & Environmental Microbiology,2013,79(19):5962-5969.
[34]顾卿,许艳丽,魏巍,等. 土壤细菌群落密度实时荧光定量PCR检测体系的建立[J]. 土壤与作物,2012,1(2):117-120.
[35]曹鹏,贺纪正. 微生物生态学理论框架[J]. 生态学报,2015,35(22):7263-7273.

