响应面法优化三种天然产物 对黄嘌呤氧化酶的抑制作用
赵守涣,杨 慧,史冠莹,王晓敏,赵洪源,王赵改
(河南省农业科学院农副产品加工研究中心,河南郑州 450002)
黄嘌呤氧化酶(xanthine oxidase,XO)是催化黄嘌呤和次黄嘌呤代谢产生尿酸的关键酶[1],体内尿酸的产生随XO活性升高而增多,进而导致高尿酸血症,统计表明5%~12%高尿酸血症会发展成痛风[2-3]。促进尿酸排泄和抑制尿酸生成是治疗痛风的两种手段,其中可通过抑制XO的活性减少尿酸生成,因此,黄嘌呤氧化酶是研发治疗痛风药物的主要方向和靶点[4]。目前多从天然产物中筛选黄嘌呤氧化酶抑制剂[5-6]降低常用药引起的毒副作用[7-8],为开发抗痛风保健食品筛选优良的原材料。已筛选出的多种具有较强抑制活性的单体化合物有伞形酮、槲皮素、白藜三醇等[9]。
张岑等[10]研究发现槲皮素抑制了对黄嘌呤的催化活性,减少了尿酸的形成。没食子酸是一种广泛存在于大黄、山茱萸等植物中的多酚类化合物,孙永丽[11]利用HPLC法筛选黄嘌呤氧化酶抑制剂,发现槲皮素、没食子酸、没食子酸甲酯、没食子酸乙酯和没食子酸芍药苷等具有较强的抑制活性。葛根素是由豆科植物野葛的根部提取,属黄酮类物质,具有抗炎、调节血糖、抗氧化、降血脂和抑制黄嘌呤氧化酶的作用[12]。本实验研究三种黄酮类天然产物对黄嘌呤氧化酶的抑制作用,并在此基础上进行单因素实验和响应面实验,确定槲皮素、葛根素和没食子酸三种天然产物的最佳配比,提高天然产物抑制剂的效率,节约资源,为开发功能性食品提供参考。
1 材料和方法
1.1 材料与仪器
黄嘌呤氧化酶 X1875-5UN,美国Sigma公司;黄嘌呤 纯度≥95%,美国Sigma公司;槲皮素 纯度≥95%,美国Sigma公司;没食子酸 纯度≥99%,天津市光复精细化工厂;葛根素 纯度≥98%,Macklin公司;氢氧化钠和磷酸二氢钾 均为分析纯,国药集团化学试剂有限公司。
SB-5200 DTD 超声波清洗机 宁波新芝生物科技股份有限公司;ME204E 型电子天平 梅特勒-托利多仪器(上海)有限公司;NUII-10T型实验室(超)纯水机 南京优普环保设备有限公司;GENESYS 10S型UV-VIS紫外分光光度计 美国Thermo公司;BL-250 A型高速多功能粉碎机 浙江省永康市青松五金厂;HHS型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;H1650R/H1850R台式高速离心机 湖南湘仪实验仪器开发有限公司。
1.2 实验方法
1.2.1 主要试剂配制 磷酸缓冲溶液(50 mmol/L,pH7.5)的配制:将205 mL 0.2 mol/L的氢氧化钠溶液与250 mL 0.2 mol/L的磷酸二氢钾溶液混合,定容至1000 mL,4 ℃保存备用;黄嘌呤溶液的配制:称取30 mg黄嘌呤加入2 mL氨水,超声溶解,加磷酸钾缓冲液定容配溶液制成1 mmol/L的溶液,用时稀释10倍,即为0.1 mmol/L的黄嘌呤应用液。黄嘌呤氧化酶溶液配制:取500 U黄嘌呤氧化酶于10 mL容量瓶溶解并定容,配制成50 U/mL,现配现用。
1.2.2 抑制剂对黄嘌呤氧化酶抑制能力的测定 参考史珅等[13]的方法,略作修改,具体如下:以黄嘌呤为反应底物,根据反应生成的尿酸在290 nm有明显的特征吸收峰,根据尿酸的生成量,反应黄嘌呤氧化酶的活性。实验各组物质加入量如表1所示。
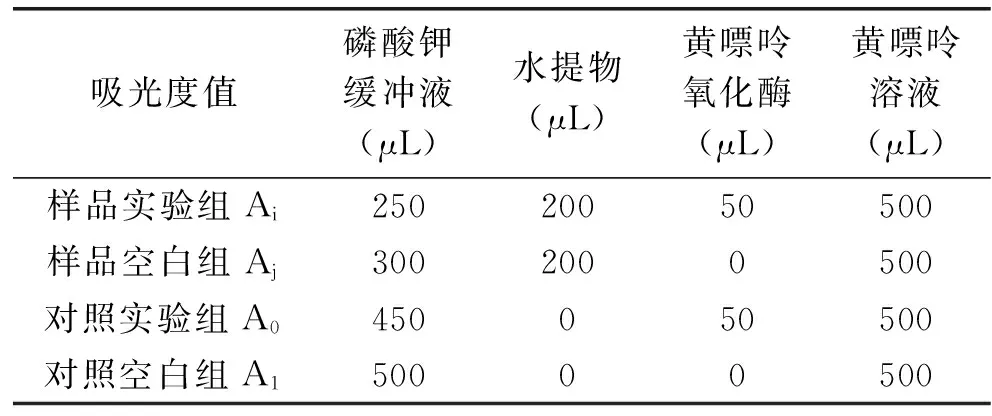
表1 黄嘌呤氧化酶酶活测定Table 1 Determination of the activity of xanthine oxidase
向5 mL试管中依次加入pH为7.5,50 mmol/L的磷酸缓冲液、不同浓度的待测物、黄嘌呤氧化酶(50 U/mL)和黄嘌呤溶液(0.1 mmol/L)后25 ℃反应30 min,于290 nm处测定各组OD值。没食子酸、葛根素和槲皮素母液浓度均为1 mg/L,梯度稀释进行测定。按照下式(1)计算不同浓度水提物对黄嘌呤氧化酶的抑制率。通过待测物浓度与酶活抑制率的关系曲线图,利用SPSS软件计算三种待测物对黄嘌呤氧化酶酶活抑制的IC50。
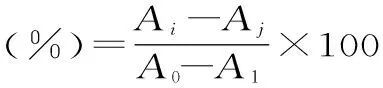
式(1)
式中,Ai为样品实验组的抑制率;Aj为样品空白组的抑制率;A0为对照实验组的抑制率;A1为对照空白组的抑制率。
1.2.3 抑制剂对黄嘌呤氧化酶抑制类型判断 在酶促反应体系中,加入一定剂量的抑制剂,测定不同浓度的酶溶液对反应速率的影响,以酶浓度为横坐标,反应速率为纵坐标作图,得出相关性曲线,确定抑制剂对酶的抑制是否可逆,即反应类型。参考Yang X等[14]的方法,略作修改,具体如下:分别测定了槲皮素浓度为0、5、10和20 μg/mL时,没食子酸浓度为0、25、50和100 μg/mL时,葛根素浓度为0、50、100和200 μg/mL时酶溶液下的反应速率,绘制曲线,判断反应类型。
1.2.4 单因素实验 根据1.2.2的实验结果,固定没食子酸浓度333 μg/mL、葛根素浓度1000 μg/mL,探讨槲皮素浓度(0.00、33.75、67.50、125.00、250.00、500.00 μg/mL)对黄嘌呤氧化酶抑制作用的影响;固定槲皮素浓度125 μg/mL、葛根素浓度1000 μg/mL,探讨没食子酸浓度(0.00、83.25、166.50、333.00、666.00、1332.00 μg/mL)对黄嘌呤氧化酶抑制作用的影响;固定槲皮素浓度125 μg/mL、没食子酸浓度333 μg/mL,探讨葛根素浓度(0.00、250.00、500.00、1000.00、2000.00、4000.00 μg/mL)对黄嘌呤氧化酶抑制作用的影响。
1.2.5 响应面实验设计 在单因素实验的基础上,选取三种水提物的浓度为自变量,以对黄嘌呤氧化酶的抑制率为响应值,根据Box-Behnken中心组合设计原理,采用三因素三水平响应面分析法进行实验设计,实验因素和水平见表2。

表2 响应面实验因素水平表Table 2 Factors and levels in response sueface design
1.2.6 数据处理 采用Origin 8.5软件作图,Design-Expert 8.0.6软件进行方差分析。
2 结果与分析
2.1 三种天然产物对黄嘌呤氧化酶抑制的IC50值
IC50是评价待测物对黄嘌呤氧化酶抑制力的重要指标,可作为筛选抑制剂的手段。由表3可知,槲皮素、没食子酸和葛根素对黄嘌呤氧化酶抑制的IC50值分别为44.86、183.61和555.20 μg/mL,抑制效果:槲皮素>没食子酸>葛根素。申启荣[15]从中草药活性单体,研究发现槲皮素对黄嘌呤氧化酶的抑制作用优于葛根素,其中槲皮素的IC50值为11.09 μg/mL,葛根素浓度为60 μg/mL时抑制率约为20%。马文涛[16]测定了30种黄酮单体对黄嘌呤氧化酶的抑制作用,研究发现槲皮素具有较好的抑制作用,且效果优于葛根素,与本文结果一致。
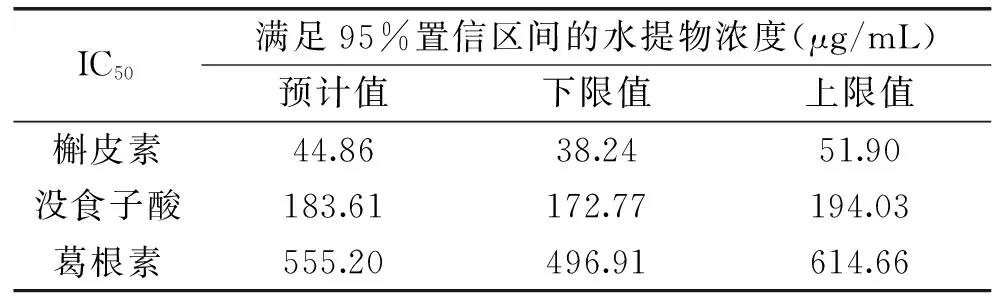
表3 满足95%置信区间的三种天然产物对酶抑制的IC50Table 3 The IC50 of the three natural products that meet the 95% confidence interval for inhibition of enzyme activity
2.2 抑制剂对黄嘌呤氧化酶的抑制作用类型分析
由图1可知,这些直线都经过原点,且随抑制剂浓度的增加,直线的斜率不断降低,说明三种天然产物对黄嘌呤氧化酶的抑制作用是可逆的。三种抑制剂以非共价键与酶分子可逆性结合造成酶活性的抑制,当反应体系中抑制剂浓度降低时,结合所成的复合物又复解离。
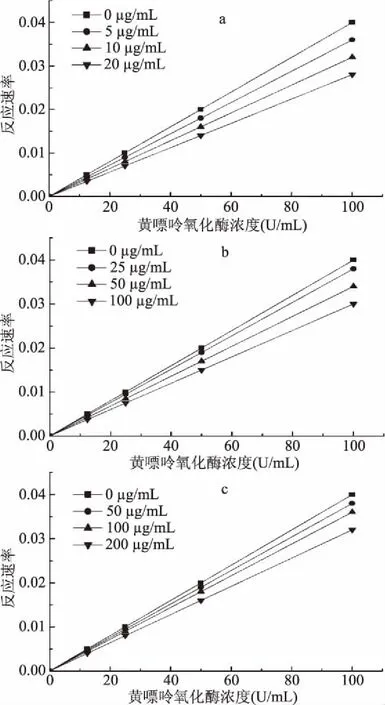
图1 三种天然产物对黄嘌呤氧化酶的抑制作用Fig.1 Effect of inhibitory rate on xanthine oxidase 注:(a)槲皮素;(b)没食子酸;(c)葛根素。
2.3 三种天然产物的单因素实验
2.3.1 槲皮素对黄嘌呤氧化酶抑制率影响的单因素分析 从图2可以看出,随着槲皮素浓度的不断增大,其对黄嘌呤氧化酶的抑制作用先增强随后趋于平缓。当槲皮素浓度在33.75 μg/mL以下时,此时酶促反应处于一级反应阶段,抑制率与抑制剂浓度处于直线上升的阶段;当槲皮素浓度在33.75~125.00 μg/mL范围内上升时,此时酶促反应处于混合反应阶段;当槲皮素浓度从125.00 μg/mL继续上升时,此时酶促反应处于零级反应阶段,三种天然产物几乎抑制了全部的酶活性,抑制率不再随着抑制剂浓度的增大而上升,趋于平缓。在一定浓度范围内,三种天然产物得以互补,协同增效,不仅减少了天然产物的用量,而且具有更好的抗性效果[17]。选择33.75~125.00 μg/mL为槲皮素最适浓度
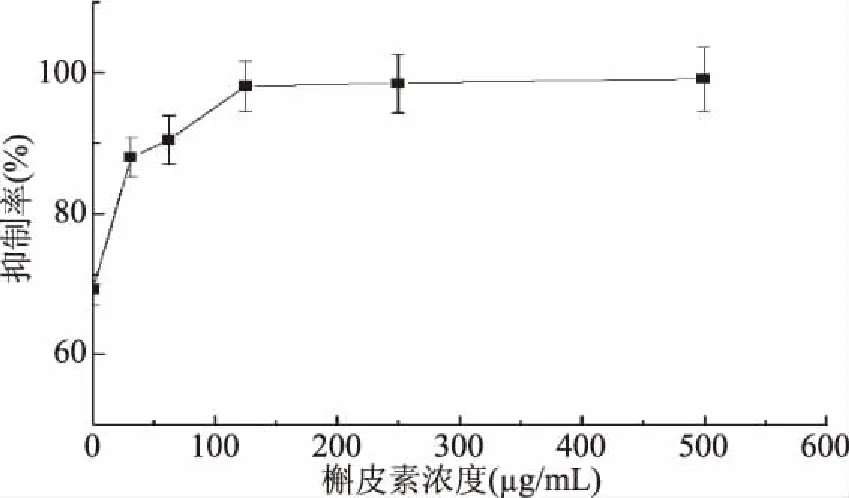
图2 不同浓度的槲皮素溶液对黄嘌呤氧化酶抑制率影响Fig.2 Effects of different concentrations of quercetin on xanthine oxidase inhibitory rate
2.3.2 没食子酸对黄嘌呤氧化酶抑制率影响的单因素分析 从图3可以看出,随着没食子酸浓度的不断增大,其对黄嘌呤氧化酶的抑制作用不断增强。当没食子酸浓度在83.25 μg/mL以下时,抑制率与抑制剂浓度处于直线上升的阶段;当没食子酸浓度在83.25~1332.00 μg/mL范围内上升时,此时酶促反应处于混合反应阶段,由于只有少数酶具有活性,抑制率与抑制剂浓度呈现缓慢上升的关系。选择选择83.25~333.00 μg/mL为没食子酸最适浓度。
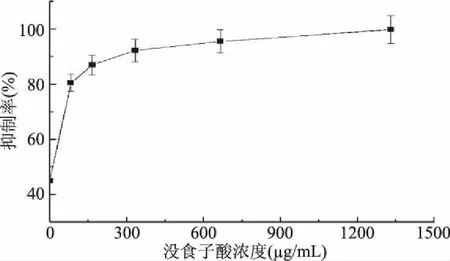
图3 不同浓度的没食子酸对黄嘌呤氧化酶抑制率影响Fig.3 Effects of different concentrations of gallic acid on xanthine oxidase inhibitory rate
2.3.3 葛根素对黄嘌呤氧化酶抑制率影响的单因素分析 从图4可以看出,随着葛根素浓度的不断增大,其对黄嘌呤氧化酶的抑制作用先增强随后趋于平缓。当葛根素浓度在500.00 μg/mL以下时,此时酶促反应处于一级反应阶段,抑制率与抑制剂浓度处于直线上升的阶段。当葛根素浓度大于1000.00 μg/mL时,大部分酶活被三种天然产物抑制,只有少数酶具有活性,抑制率缓慢上升。选择250.00~1000.00 μg/mL为葛根素最适浓度。
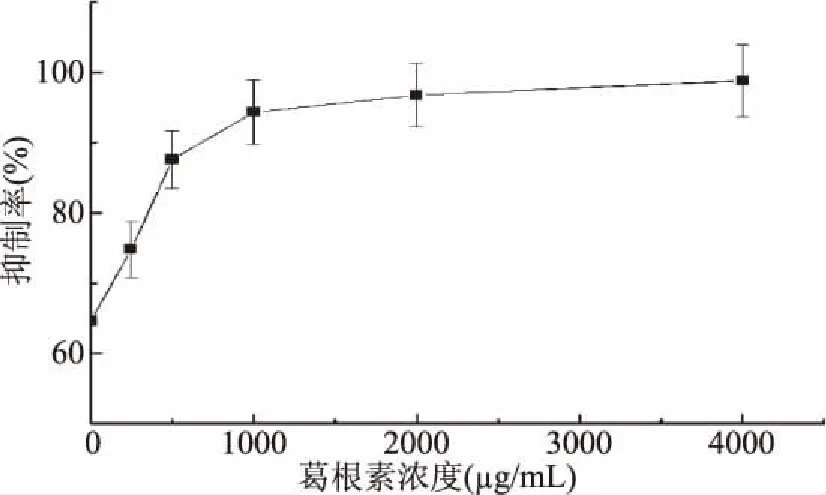
图4 不同浓度的葛根素对黄嘌呤氧化酶抑制率影响Fig.4 Effects of different concentrations of puerarin on xanthine oxidase rate
2.4 三种天然产物对黄嘌呤氧化酶酶活抑制率的响应面分析
2.4.1 响应面实验方案及结果 根据单因素实验结果,由Design-Expert 8.0.6统计分析软件设计出的结果方案及实验结果如表4所示,以对黄嘌呤氧化酶的抑制率为响应值,以槲皮素(A)、没食子酸(B)和葛根素(C)为自变量,建立三因素三水平中心组合实验设计共包括17个实验方案,其中12个析因实验点,5个中心实验点,用以计算实验误差。
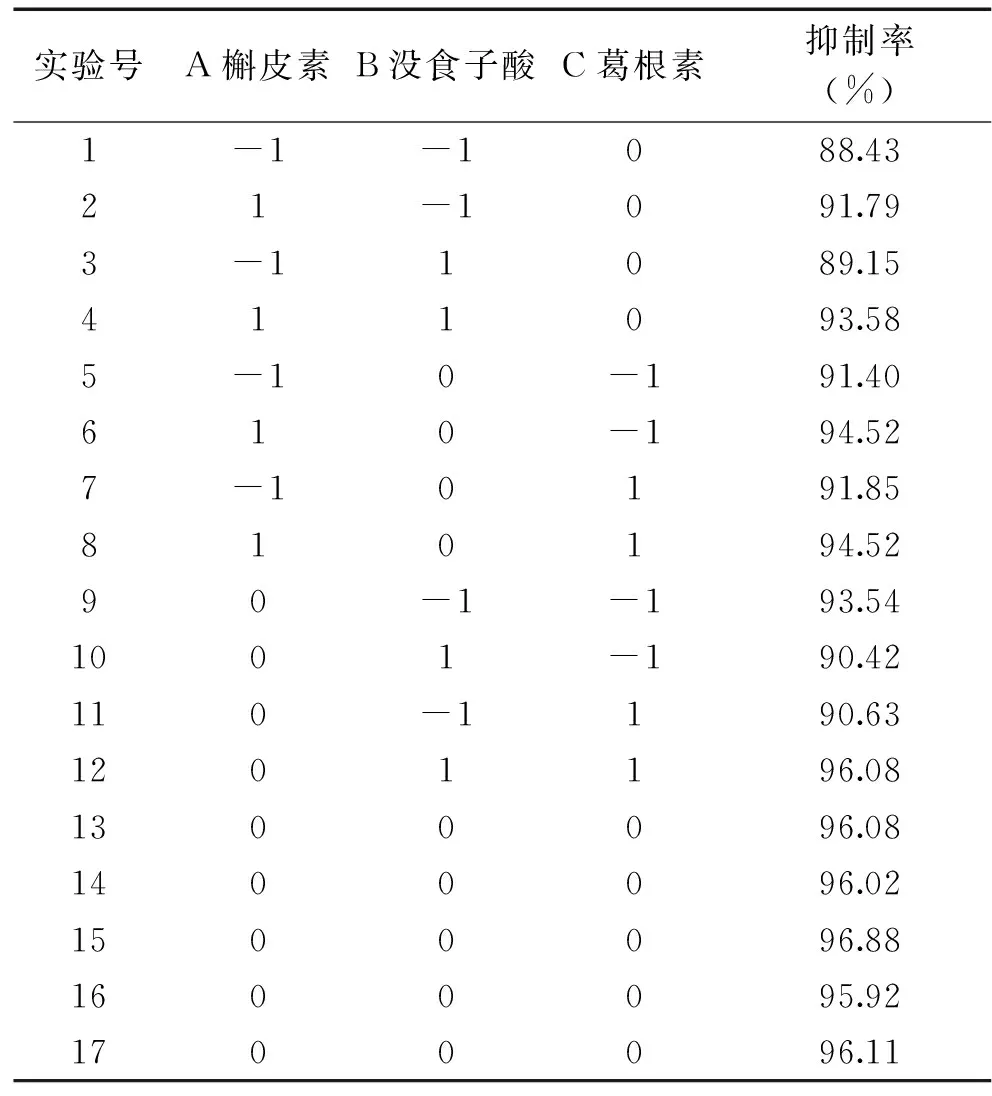
表4 响应面实验设计与结果Table 4 RSM design and inhibitory rate
2.4.2 回归方程拟合及方差分析 本实验利用Design-Expert 8.0.6软件对表的实验结果进行回归分析,响应值用Y表示,得到了二次多项式的回归方程:
Y=96.57+1.82A+0.61B+0.52C+0.27AB+0.14AC+2.14BC-2.59A2-3.24B2-0.66C2
该回归模型的方差分析见表5,该模型的F=124.33,p<0.0001,说明该模型与实际拟合良好,实验方法可靠。同时失拟项不显著(p>0.05),模型的决定系数R2为0.9938,校正后的决定系数为0.9858,说明所得方程与实际拟合中非正常误差所占比例小,可以用于槲皮素、没食子酸和葛根素复配溶液抑制黄嘌呤氧化酶的分析及预测。且由表中可以看出一次项A、B、C的p值均小于0.01,表明槲皮素、没食子酸和葛根素对黄嘌呤氧化酶的抑制具有极显著影响;交互项BC的p值小于0.01,
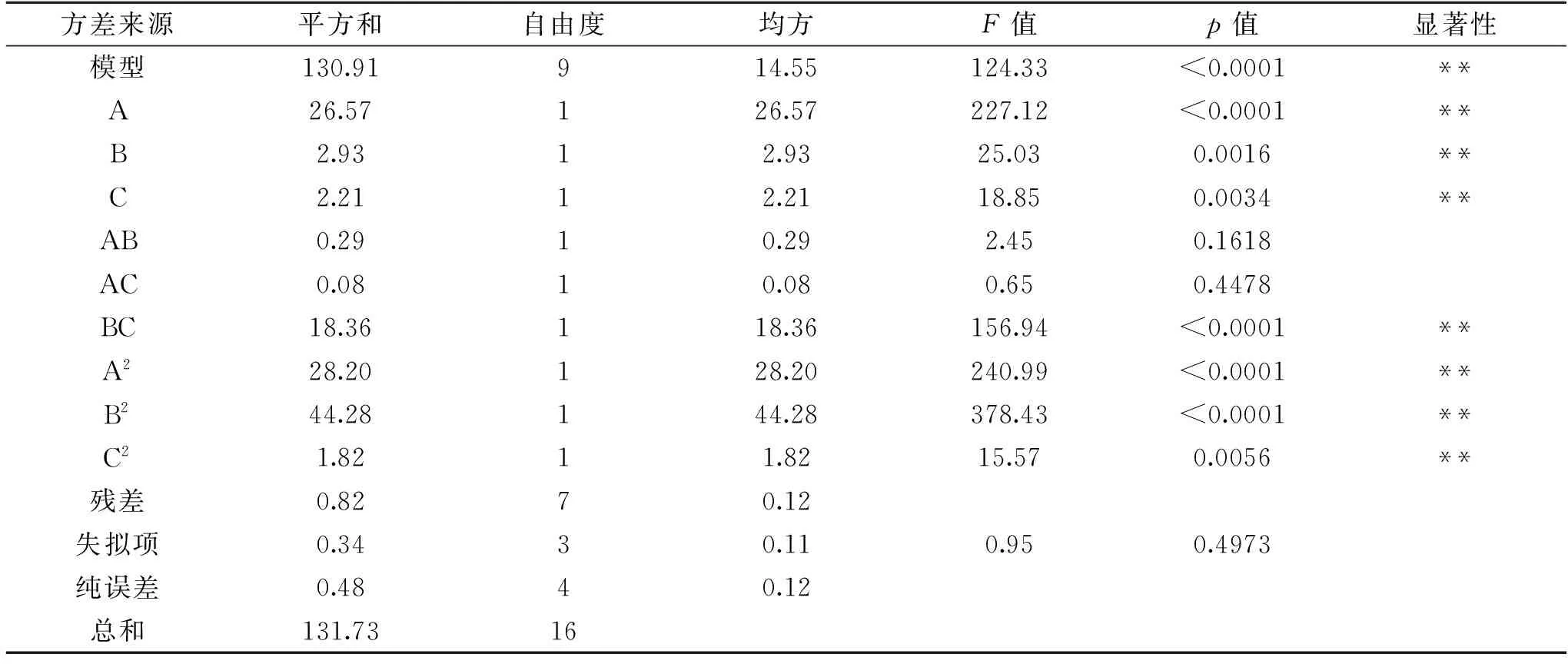
表5 回归模型及方差分析 Table 5 Analysis of variance of regression equation
AB、AC的p值均大于0.05,说明没食子酸与葛根素的交互作用对黄嘌呤氧化酶的抑制具有极显著影响,槲皮素与没食子酸及槲皮素与葛根素的交互作用不显著。影响槲皮素、没食子酸和葛根素抑制黄嘌呤氧化酶的3个因素的主次因素依次为:槲皮素>没食子酸>葛根素。
2.4.3 响应面图分析 响应面法是优化存在多因素影响实验条件的方法,通过固定数量的实验次数可以连续的对实验因素进行分析,得到直观的3D曲面图进而评价各因素间的交互作用[18]。如图5所示为当固定槲皮素(A)、没食子酸(B)、葛根素(C)中任意两个因素为零水平时,其余两个因素间的交互作用及对对黄嘌呤氧化酶抑制率影响。抑制率随其中任意两个变量的增加均呈上升趋势,达到一定值时,曲面稍微下降或趋于平缓。结果如图5(a~f)所示,其中图5(e)和(f)为固定槲皮素浓度为零水平,没食子酸和葛根素浓度对抑制率的影响和两者之间的交互作用。且曲面陡峭,说明没食子酸和葛根素之间交互作用显著,与方差分析结果相符。没食子酸浓度较低时,抑制率随葛根素浓度的增加而变大,随后趋于平缓。综上所述,没食子酸上升的幅度较葛根素稍陡峭,说明没食子酸浓度对抑制率影响稍大。通过软件最后结果分析,得到的抑制黄嘌呤氧化酶的最佳复配浓度为:槲皮素83.36 μg/mL;没食子酸166.50 μg/mL;葛根素647.50 μg/mL,此时对黄嘌呤氧化酶的预测抑制率为96.97%。

图5 两因素的交互作用对黄嘌呤氧化酶抑制率的响应面图Fig.5 Response surface plots of variable parameters on the inhibitory rate of xanthine oxidase
2.4.4 验证实验 为方便实际操作将实验条件定为:槲皮素83.25 μg/mL,没食子酸166.50 μg/mL,葛根素650.00 μg/mL,该条件下的5次实验平均抑制率为96.92%±0.17%。与模型计算出的抑制率极为接近,说明该响应面模型可靠,此法可有效优化抗痛风复配工艺。
3 结论
槲皮素、没食子酸和葛根素溶液对黄嘌呤氧化酶抑制的IC50分别为44.86、183.61和555.20 μg/mL,抑制效果为:槲皮素>没食子酸>葛根素,且均为可逆反应。响应面所建立的回归模型具有可靠性,优化的抑制黄嘌呤氧化酶的最佳复配浓度为:槲皮素83.25 μg/mL,没食子酸166.50 μg/mL,葛根素650.00 μg/mL,对黄嘌呤氧化酶抑制率为96.92%±0.17%,与模型预测抑制率96.97%极为接近。天然产物经复配产生相互促进的作用,提高对酶的抑制力,为筛选高效的酶抑制剂提供一种行之有效的方法。
[1]Enroth C,Eger B T,Okamoto K,et al. Crystal structures of bovine milk xanthine dehydrogenase and xanthine oxidase:structure-based mechanism of conversion[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(20):10723.
[2]刘佳,李玲. 高尿酸血症的发病机制与药物治疗研究进展[J]. 国际药学研究杂志,2010,37(1):24-28.
[3]Smith E U R,Diaz-TornE C,Perez-Ruiz F,et al. Epidemiology of gout:An update[J]. Best Practice & Research Clinical Rheumatology,2010,24(6):811-811.
[4]刘永贵,赵丽嘉,崔艳丽,等. 抗高尿酸血症药物研究进展[J]. 现代药物与临床,2015,30(3):345-350.
[5]许洪波,周瑞,谢培,等. 27种中草药的黄嘌呤氧化酶抑制活性筛选[J]. 时珍国医国药,2017,28(3):547-548.
[6]杨道茂,欧阳明安. 9种中药提取物黄嘌呤氧化酶抑制活性研究[J]. 天然产物研究与开发,2014,26(578):597-600.
[7]Khanna D. American College of Rheumatology guidelines for management of gout[J]. Uric Acid Research,2013,37(2):45-47.
[8]中华医学会内分泌学分会. 高尿酸血症和痛风治疗的中国专家共识[J]. 中华内分泌代谢杂志,2013,29(11):913-920.
[9]Zhao H,Wang X,Li W,et al. A new minor homoiso flavonoid from Caesalpinia sappan[J]. Natural Product Research,2014,28(2):102.
[10]张岑,张国文. 光谱学结合分子模拟技术研究槲皮素对黄嘌呤氧化酶的抑制作用[J]. 光谱学与光谱分析,2016,36(10):349-350.
[11]孙永丽. 体外筛选具黄嘌呤氧化酶抑制活性的天然产物[D]. 济南:济南大学,2015.
[12]尹乐斌,夏秋良,赵良忠,等. 葛根药理作用研究进展[J].现代农业科技,2016,15(4):68-69.
[13]史珅,常伟,尚小玉,等. 几种天然产物对黄嘌呤氧化酶的抑制作用[J]. 中国食品学报,2014,14(7):138-143.
[14]Yang X,Kong F. Evaluation of theinvitroα-glucosidase inhibitory activity of green tea polyphenols and different tea types[J]. Journal of the Science of Food & Agriculture,2015,96(3):777-782.
[15]申启荣. 中药黄嘌呤氧化酶抑制剂的筛选及抑制动力学研究[D]. 南昌:南昌大学,2015.
[16]马文涛. 黄嘌呤氧化酶、脂氧化酶和环氧化酶抑制剂的筛选及其体外抗肿瘤活性研究[D]. 武汉:湖北中医药大学,2016.
[17]王婷婷,牛黎莉,张珍,等. 四种变性淀粉与黄原胶和魔芋胶复配体系粘度特性研究[J]. 食品工业科技,2015,(23):63-67.
[18]Wang X,Wu Y,Chen G,et al. Optimization of ultrasound assisted extraction of phenolic compounds from Sparganii rhizoma,with response surface methodology[J]. Ultrasonics Sonochemistry,2013,20(3):846-854.
全国中文核心期刊 轻工行业优秀期刊

