不同食用油对番茄红素抗氧化活性的影响
, , ,,
(中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心,北京 100083)
番茄红素(lycopene)是类胡萝卜素的一种,在番茄、胡萝卜、木瓜和西瓜等果蔬中大量存在。可溶于丙酮、正己烷、氯仿等有机溶剂,不溶于水,对光、热、氧敏感[1-3]。作为成熟番茄中一种最主要的色素,由于没有β-紫罗酮环结构,在过去只是被当作一种没有生物活性的植物色素[4-5],很长时间都没有得到重用。
活性氧被认为是引起癌症、心脑血管疾病以及其他慢性病的重要因素[6-7]。在生物体中,活性氧的水平由一个复杂的氧化防御系统网调控,这个防御系统可以使生物分子受到的氧化损伤最小化[8]。人体正常状态下活性氧的产生和清除处于一个平衡状态,但当机体出现病变时,防御系统会瓦解,活性氧引起的氧化胁迫会导致人体内糖类、脂质、DNA和蛋白质等大分子的损伤,破坏其正常功能,并引起一系列如癌症、衰老以及心血管等疾病的发生[9-11]。
近年来,越来越多的实验和研究表明,番茄红素作为存在于人体血清和其他组织中主要的类胡萝卜素,其抗氧化活性要优于其他类胡萝卜素色素,猝灭单线态氧速率常数是维生素E的100倍,是β-胡萝卜素的2倍多[12-16]。因为能够保护细胞内脂质、蛋白质和DNA免受自由基氧化损伤[17],番茄红素已经被很多国家开发成为保健食品,我国市场上也有多种品牌的番茄红素软胶囊。各种番茄红素软胶囊的主要成分都是番茄红素和其载体介质食用油,而使用的食用油品种并不统一,包括大豆油、玉米油、小麦胚芽油、菜籽油和亚麻籽油等,其中大豆油使用最多,几乎占据了80%的市场。关于番茄红素的研究日益增多,主要集中在番茄红素的提取和保健功能方面,包括抗氧化、保护神经系等,尚未有针对不同食用油对番茄红素保健功能影响方面的实验。研究不同食用油对番茄红素保健功能的影响,可以更好的指导生产和消费,因此本文研究了不同食用油对番茄红素抗氧化活性的影响。
本文将番茄红素分别加载于亚麻籽油、大豆油、葵花籽油、玉米油、花生油介质中,测定该类复合物对羟基自由基、DPPH、ABTS和超氧阴离子自由基的清除作用及在β-胡萝卜素亚油酸自氧化体系中的抗氧化能力,从而研究这几种油对番茄红素抗氧化活性的影响。
1 材料与方法
1.1 材料与仪器
番茄红素油树脂5.33%(其他成分为提取油脂-红花油),晨光生物科技集团股份有限公司;亚麻籽油、花生油、大豆油、葵花籽油、玉米油均购于北京物美超市;丙酮(99.5%)、氯化铜(99.0%);碳酸氢钠(99.5%)、过硫酸钾(99.5%)、甲醇(99.5%)、吐温-20(97%、99.5%)国药集团化学试剂有限公司;邻菲罗啉(99%)、DPPH(99%)、ABTS(98%)、邻苯三酚(99%)、β-胡萝卜素(99%)上海阿拉丁生化科技股份有限公司;氯仿(99%)、亚油酸(60.0%~74.0%)、双氧水(H2O2,30%)、碳酸钠(99.8%)、无水乙醇(99.7%)、盐酸(36.0%~38.0%)北京化学试剂有限公司;Tris-HCl缓冲液(99.9%)索莱宝生物科技有限公司。
IKA C-MAGHS7型磁力搅拌器梅特勒-托利多公司;T6型紫外可见分光光度计北京普析通用仪器有限责任公司;RE-52A真空旋转蒸发器上海亚荣生化仪器厂;KQ-500DE型超声波清洗器昆山市超声仪器有限公司。
1.2 实验方法
1.2.1复合物的制备配制番茄红素为4.3%的复合物,分别称取不同种类的食用油(玉米油、葵花籽油、花生油、大豆油、亚麻籽油)9.48 g于50 mL离心管中,再加入番茄红素油树脂37.52 g,漩涡振荡至混合均匀。用锡箔纸包裹后,置于-4 ℃冰箱中备用。
1.2.2羟自由基清除能力的测定参照涂宝军等[18]的测定方法并稍加修改。取番茄红素与食用油的复合物0.25 g,用丙酮溶解,配制成100 μg/mL的溶液,再用丙酮稀释配成5、10、20、30、40、50 μg/mL的待测液。
反应液的配制:向10 mL容量瓶中依次注入1.5 mmol/L邻菲罗啉和2.0 mmol/L的氯化铜各0.5 mL、双氧水(30%)666.7 μL、0.05 mmol/L pH9.6碳酸盐缓冲液8 mL,待测样品0.5 mL,并快速混合均匀,以同体积的丙酮作为空白对照。反应液静置5 min后,在502 nm处用分光光度计测定上述样品的吸光度并记录,每个样品平行测定3次,取峰值的平均值进行定量,计算清除率。

式(1)
式中:A0-空白对照品在502 nm处的吸光度;A样-样品反应后在502 nm处的吸光度;A本底-样品在502 nm下的吸光度。
1.2.3DPPH自由基清除能力的测定参照涂宝军等[18]的测定方法并稍加修改。取番茄红素与食用油的复合物0.25 g,用丙酮溶剂进行溶解,配制成100 μg/mL的溶液,再通过稀释配成5、10、20、30、40、50 μg/mL的待测液。
DPPH溶液的配制:称取6.5 mg的DPPH,用无水乙醇配制成65 μmol/L的溶液。
反应液的配制:向10 mL容量瓶中加入8 mL,65 μmol/L的DPPH无水乙醇溶液,2 mL的待测样品,快速混合均匀,用丙酮作为空白对照。静置5 min后,在514 nm处用分光光度计测定吸光度并记录,每个样品平行测定3次,取峰值的平均值进行定量,计算清除率。

式(2)
式中:A0-空白对照品在514 nm处的吸光度;A样-样品反应在502 nm处的吸光度;A本底-样品在514 nm下的吸光度。
1.2.4ABTS自由基清除能力的测定参照邓丽君等[19]的测定方法并稍加修改。
ABTS应用液的配制:称取0.0192 g的ABTS和0.0033 g的过硫酸钾溶解于10 mL蒸馏水中,配制成3.5 mmol的ABTS溶液,于室温、避光处放置16~24 h,得到ABTS溶液,用甲醇稀释至734 nm处的吸光值为0.683的应用液。
在反应容器中,依次加入待测样品0.2 mL,ABTS自由基应用液1.3 mL,振荡摇匀,于室温下避光静置6 min后,测定溶液在734 nm处的吸光度A1。为排除样品试剂本身颜色的影响将ABTS自由基应用液换成甲醇溶液,以95%的甲醇溶液为对照,于室温下测定溶液在734 nm处的吸光度A2。以甲醇溶液代替待测样品,同样以95%的甲醇溶液为对照,测定溶液在734 nm处的吸光度A0。
每组测定3次,求取平均值,按下述公式计算样品的清除率。并绘制清除率与样品吸光度曲线。
式(3)
式中:A0-含ABTS应用液不含待测样品的反应体系的吸光值;A1-样品反应后的吸光值;A2-含待测样品不含ABTS应用液反应体系的吸光值[20]。
1.2.5超氧阴离子自由基清除能力的测定参照刘国安等[8]的测定方法并加以修改。
取0.5 mL不同浓度样品,加入4.43 mL pH=8.0的Tris-HCl(50 mmol/L)缓冲液后,加入70 μL邻苯三酚溶液(10 mmol/L),立刻计时并迅速摇匀,在反应启动后每隔30 s检测相应325 nm处的吸光值,至4.5 min为止。对照管用盐酸代替邻苯三酚溶液。
式(4)
式中:A0-未加样品的吸光值;A1-加入样品的吸光值;A2-未加邻苯三酚的吸光值。
1.2.6β-胡萝卜素—亚油酸自氧化体系参照Gachkar等[21]的测定方法并加以修改。
β-胡萝卜素氯仿溶液配制:准确称取15 mgβ-胡萝卜素,用氯仿定容至10 mL容量瓶中,配制为浓度为1.5 mg/mL的β-胡萝卜素氯仿溶液。
乳化液的配制:称取40 mg亚油酸和400 mg吐温-20,放入圆底烧瓶中,再加入0.4 mL的β-胡萝卜素氯仿溶液,在40 ℃下真空旋转蒸发5 min,然后向残余物中加入100 mL蒸馏水不断搅拌,在40 kHz超声波中超声10 min。
其中空白乳化溶液的配制除不添加β-胡萝卜素外,步骤同上。
检测:准确量取5 mL的乳化液,加入0.2 mL的不同待测样品后,马上于470 nm下测定吸光度值(t=0 min)。然后在60 ℃下水浴120 min,每30 min测定一次吸光度值。
抗氧化能力用 IC50值及动力学反应速率综合来衡量。其中,根据公式(5)计算各样品的抗氧化活性值,通过非线性拟合计算得到各物质的 IC50值;依照公式(6)计算反应动力学曲线的响应值(β-胡萝卜素残留率)。

式(5)
式中:DRc=ln(ac/bc)/120,表示对照溶液的降解速率;DRs=ln(as/bs)/120表示样品溶液的降解速率;ac为0 min时的对照溶液吸光度值;bc为120 min时的对照溶液吸光度值;as为0 min时的样品溶液吸光度值;bs为120 min时的样品溶液吸光度值。
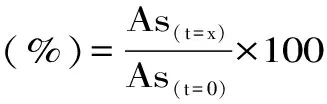
式(6)
式中:As(t=x)和As(t=0)分别代表样品在t=x min及t=0 min时的吸光度值。
1.2.7数据处理采用Origin 8.5软件作图,SPSS 20软件进行显著性差异分析。
2 结果与分析
2.1 羟基自由基清除能力的测定
羟基自由基是化学性质最活泼的一种活性氧。按1.2.2的实验方法,得到番茄红素油树脂和几种食用油复合物自由基清除率的结果如图1,除了质量浓度为10 μg/mL的花生油和大豆油,其他各种油的羟基自由基清除率之间存在极显著性差异(p<0.01);同种油不同质量浓度样品之间也存在极显著性差异(p<0.01)。在一定范围内,随着番茄红素提取物质量浓度的增加,羟基自由基的清除率逐步提高。其中亚麻籽油复合物对羟基自由基的清除效果明显好于其它的食用油,花生油和大豆油复合物对羟基自由基也有较强的清除能力,在30 μg/mL时清除率显著增加。此实验表明不同食用油与番茄红素复合对羟基自由基的清除能力有显著差异。

图1 不同样品对羟基自由基的清除效果Fig.1 Effect of different samples on hydroxyl radicals scavenging rate注:不同字母表示不同样品间有极显著性差异(p<0.01),相同字母表示两者间没有显著性差异(p>0.05),图4同。
2.2 DPPH自由基清除能力的测定
按1.2.3的实验方法,得到番茄红素油树脂和几种食用油复合物DPPH自由基清除率的结果如图2,不同食用油和番茄红素复合物对DPPH的清除效果有显著性差异(p<0.05),尤其在质量浓度大于20 μg/mL后,差异性更显著(p<0.05)。质量浓度在0~40 μg/mL范围内,对DPPH自由基的清除能力均随浓度的增大而增大,其中亚麻籽油和番茄红素复合物的清除能力最强,在40 μg/mL时清除率达到最大值,随后清除率开始下降,这可能是因为复合物为脂溶性,含量过高不能与反应液良好的混合,降低了对DPPH自由基的清除效果。此外,花生油的DPPH自由基清除率仅次于亚麻籽油而优于其它几种植物油,其清除率随着浓度增大呈上升趋势,在50 μg/mL时,其清除效果要比亚麻籽油的最佳效果(即质量浓度为40 μg/mL时的清除效果)好,但是两者间没有显著差异。大豆油和玉米油的DPPH自由基清除能力没有显著差异。

图2 不同样品对DPPH自由基的清除效果Fig.2 Effect of different samples on DPPH radicals scavenging rate注:不同字母表示不同样品间有显著性差异(p<0.05),相同字母表示两者间没有显著性差异(p>0.05),图3同。
2.3 ABTS自由基清除能力的测定
ABTS法作为物质抗氧化能力的评定方法之一,使用广泛[22]。按1.2.4的实验方法,得到番茄红素油树脂和几种食用油复合物ABTS自由基清除能力的结果如图3所示,不同的油和番茄红素的复合物对ABTS的清除效果有显著性差异(p<0.05)。亚麻籽油和番茄红素的复合物对ABTS自由基清除能力最强,但当质量浓度大于30 μg/mL后,亚麻籽油的自由基清除能力开始下降,再次说明番茄红素摄入适量,效果更好。此外,随着浓度的增加葵花籽油的自由基清除能力的增长速度最快,在50 μg/mL时,与亚麻籽油差异最小。对于花生油,在质量浓度小于30 μg/mL时,清除率随质量浓度增加而显著增加,大于30 μg/mL后,增幅变缓。

图3 不同样品对ABTS的清除效果Fig.3 Effect of different samples on ABTS radicals scavenging rate
2.4 超氧阴离子自由基清除能力的测定
超氧阴离子自由基和羟基自由基同属于活性氧自由基,性质十分活泼,能够诱发机体细胞内脂质、蛋白质和DNA发生氧化损伤[23]。按1.2.5的实验方法,不同的复合物对超氧阴离子自由基的清除效果有极显著性差异(p<0.01)。番茄红素油树脂和几种食用油复合物超氧阴离子自由基清除能力的结果如图4所示,对超氧阴离子自由基的清除率随着质量浓度的增大而增大,清除能力顺序为:亚麻籽油>花生油>葵花籽油>大豆油>玉米油。亚麻籽油复合物在40 μg/mL时,清除效果极显著增加(p<0.01),其它复合物均在30 μg/mL时极显著增加(p<0.01),因此,在成本最小、效果最好的前提下,亚麻籽油复合物选择40 μg/mL,而其它复合物选择30 μg/mL。

图4 不同样品对超氧阴离子自由基的清除效果Fig.4 Effect of different samples on superoxide anion radicals scavenging rate
2.5 β-胡萝卜素—亚油酸自氧化体系
β-胡萝卜素—亚油酸自氧化体系是一种常用的抗氧化活性评价方法,原理是亚油酸在高温下产生的过氧化氢使β-胡萝卜素褪色[24],而通过添加抗氧化剂及含有抗氧化物质的天然提取物,则可以使β-胡萝卜素的褪色反应被抑制[21]。为了保证实验结果良好的重复性,β-胡萝卜素-亚油酸系统中的变量越少越好,因此本实验中唯一的变量是食用油的不同。
2.5.1IC50值法β-胡萝卜素-亚油酸自氧化体系中不同复合物的抗氧化能力达到50%时的浓度值(IC50)见图5。从图5中可知,不同混合物表现出不同的抗氧化活性。基本为亚麻籽油>花生油>大豆油>葵花籽油>玉米油。

图5 β-胡萝卜素-亚油酸体系中不同样品抗氧化能力达到50%的浓度值Fig.5 IC50 values of test samples in β-carotene and linoleic acid system
2.5.2动力学反应速率各样品中不同反应时间的β-胡萝卜素残留率如图6所示,随着时间延长,各反应样品中β-胡萝卜素残留率逐渐下降,这与加热因素导致亚油酸上的活性亚甲基脱氢,引发烷基游离基产生并进一步产生过氧游离基,从而引发亚油酸的自氧化反应,并大量产生游离基,这些游离基能与β-胡萝卜素反应使之快速褪色有关。同时,亚麻籽油复合物抗氧化能力最强,大豆油和葵花籽油复合物的抗氧化能力较弱,玉米油复合物随时间延长抗氧化能力逐渐下降,最终β-胡萝卜素残留率高于花生油。

图6 各样品在40 μg/mL浓度时β-胡萝卜素残留率随时间变化的动力学曲线Fig.6 The dependence of residual rate on time of incubation at a concentration of 40 mg/mL of investigated samples in β-carotene bleaching test
3 结论
综上所述,与其它食用油相比,亚麻籽油与番茄红素复合后具有更强的抗氧化能力。这可能是因为亚麻籽油是目前n-3含量最高的已知油脂之一,α-亚麻酸和亚油酸含量高达60%以上,还含有维生素E等,与番茄红素有抗氧化协同作用。同时花生油中不饱和脂肪酸的含量也较高,所以在很多方面花生油复合物的抗氧化性仅次于亚麻籽油复合物。大豆油复合物对羟基自由基、DPPH自由基和ABTS也有较好的清除效果,这也许是大豆油成为人们首选的原因之一。玉米油与葵花籽油复合物的抗氧化能力大多不及其它食用油,但在某些质量浓度时也有较好的抗氧化性。因此,消费者不能一概而论,应该注意抗氧化能力也受番茄红素质量浓度的影响。
[1]梅晓岩,孟宪军,梁婧婧. 番茄红素抗氧化活性的研究[J].安徽农业科学,2006,34(11):2315-2317.
[2]刘雪凌,姜玲,陈旭华. 浸提法提取番茄红素的工艺研究[J]. 食品科技,2012,37(9):234-236.
[3]李佳,闫唯,刘钰华,等. 番茄红素保健功能及其应用研究进展[J]. 农业与技术,2016,36(15):5-6.
[4]Peto R,Doll R,Buckley J D,et al. Can dietary beta-carotene materially reduce human cancer rates?[J]. Nature,1981,290(5803):201-208.
[5]陈孝云,朱俊向,吴昊,等. 不同提取方式番茄红素的抗氧化活性研究[J]. 中国调味品,2015,40(4):102-106.
[6]Stohs S J. The role of free radicals in toxicity and disease[J]. Journal of Basic & Clinical Physiology & Pharmacology,1995,6(3-4):205.
[7]Wiseman H,Halliwell B. Damage to DNA by reactive oxygen and nitrogen species:Role in inflammatory disease and progression to cancer[J]. Biochemical Journal,1996,313(Pt 1):17-29.
[8]刘国安,薛莹,马伟,等. 番茄红素的抗氧化活性研究[J]. 西北师范大学学报自然科学版,2016,52(2):89-94.
[9]张梦如,杨玉梅,成蕴秀,等. 植物活性氧的产生及其作用和危害[J]. 西北植物学报,2014,34(9):1916-1926.
[10]易健,舒徐. 活性氧对细胞凋亡和增殖的调控作用[J]. 基础医学与临床,2013,33(10):1341-1344.
[11]孙玉洁,金鹏,单体敏,等. 甜菜碱处理对枇杷果实采后冷害和活性氧代谢的影响[J]. 食品科学,2014,35(14):210-215.
[12]Shi J,Le M M. Lycopene in tomatoes:chemical and physical properties affected by food processing.[J]. Critical Reviews in Food Science and Nutrition,2000,20(1):293-334.
[13]陈锦瑶,张立实. 番茄红素的生物学作用及应用研究进展[J]. 卫生研究,2013,42(2):336-342.
[14]肖白曼,潘洪志,陈文华,等. 番茄红素对小鼠前胃癌细胞DNA氧化损伤的影响[J]. 职业与健康,2012,28(21):2576-2578.
[15]张带荣. 番茄红素防治前列腺癌的研究进展[J]. 中国临床药理学杂志,2014,30(10):962-965.
[16]屈明玥,高志丹,南新中,等. 番茄红素在多种慢性疾病防治领域应用的研究进展[J]. 解放军预防医学杂志,2014,32(5):463-465.
[17]Rajoria A,Kumar J,Chauhan A K. Anti-oxidative and anti-carcinogenic role of lycopene in human health-a review[J]. Journal of Dairying Foods & Home Sciences,2010,29(3/4):157-165.
[18]涂宝军,李勇,陈尚龙,等. 超临界CO2萃取番茄红素工艺及其抗氧化性能研究[J]. 食品工业,2014,35(6):138-143.
[19]邓丽君,赵天风,张莉青,等. PSB-B类胡萝卜素的抗氧化活性研究[J]. 陕西农业科学,2016,62(1):61-63.
[20]郑善元,陈填烽,郑文杰,等. 单丛茶水提物清除DPPH和ABTS自由基的光谱学研究[J]. 光谱学与光谱分析,2010,30(9):2417-2423.
[21]Gachkar L,Yadegari D,Rezaei M B,et al. Chemical and biological characteristics ofCuminumcyminumandRosmarinusofficinalisessential oils[J]. Food Chemistry,2007,102(3):898-904.
[22]王会,周燕. 筛选和表征抗氧化剂的方法——ABTS法[J]. 广州化工,2012,40(22):41-43.
[23]Bidchol A M,Wilfred A,Abhijna P,et al. Free Radical scavenging activity of aqueous and ethanolic extract ofBrassicaoleracea,L. var. italica[J]. Food and Bioprocess Technology,2011,4(7):1137-1143.
[24]Roginsky V,Lissi E A. Review of methods to determine chain-breaking antioxidant activity in food[J]. Food Chemistry,2005,92(2):235-254.

