DEAE-52纤维素静态法分离纯化桦褐孔菌多糖的工艺优化
, ,,, ,*
(1.曲阜师范大学生命科学学院,山东济宁 273100; 2.中国农业大学食品与营养工程学院,北京 100083)
桦褐孔菌(Inonotusobliquus),又称白桦茸(Chaga),是一种大型药用真菌,主要寄生在桦树上。桦褐孔菌中含有多糖、三萜类化合物、木质素、黑色素、叶酸衍生物等多种生物活性成分[1]。从16世纪开始,俄罗斯、波兰、芬兰和其他东欧国家的居民就开始食用桦褐孔菌,用于防治多种疑难杂症,如肝癌、胃癌、各类消化器官的癌症、糖尿病、心脏病[2]。目前国内外研究表明桦褐孔菌多糖具有抗肿瘤[3-4]、抗氧化[5-6]、抗血脂[7-8]、调节免疫力[9-10]、降血糖[11]等广泛的药理作用。但多糖不是一种纯粹的化学物质,而是聚合程度不同的物质混合物。多糖在单糖组成、相对分子质量分布、结构等方面具有不均一性,因此对多糖的分级纯化是探讨其化学结构和生物活性的基础[12]。
目前常用超滤膜分离法[13]、凝胶色谱法[14]、分布沉淀分离法[15]、阴离子交换色谱法[16]和大孔树脂柱色谱法[17]等方法分离纯化多糖。其中,超滤膜分离法具有能耗低、分离效率高、不损害活性等优点,但膜在分离过程中易被污染,造成膜渗透通量下降,从而给多糖的分离增加难度[18]。凝胶色谱法是利用凝胶的分子筛作用,根据不同分子大小和形状的多糖在层析柱中移动速度不同而达到分离纯化的目的,凝胶色谱分离纯化效果好,但上样量小,不适合作为分离纯化的第一步骤进行大量分离,主要用来进行少量样品的纯化。分步沉淀法是利用“相似相溶 ”原理,用不同浓度的低级醇或酮将不同相对分子质量的多糖沉淀出来,适用于溶解度相差较大的多糖的分离,有一定的局限性[19]。阴离子交换色谱以离子交换树脂作为固定相,通过其表面带电荷的基团与样品离子和流动相离子的可逆交换、离子-偶极作用或吸附来实现色谱分离,可用来分离各种酸性、中性多糖和黏多糖,应用广泛。其中最常用的阴离子交换柱层析填料是DEAE-52纤维素,它既可纯化多糖,还可分离各种多糖,已被广泛应用于食品、医药、环保等领域有效成分的分离与纯化[20-21]。且本实验室前期用DEAE-52纤维素柱层析和Sephadex G-100柱层析分离纯化桦褐孔菌子实体常温水提粗多糖(Normal temperature water-extracted polysaccharides,NIOP),通过去离子水、0.2 mol/L NaCl和0.5 mol/L NaCl洗脱,获得了NIOP1(去离子水洗脱多糖)和NIOP2(0.2 mol/L NaCl洗脱多糖)两种生物活性较好的分子量分布均一的多糖组分,但是DEAE-52纤维素柱层析分离纯化多糖步骤繁琐,工作量大,不易于短时间内获得大量单一多糖组分[22]。因此本实验通过研究DEAE-52纤维素对NIOP静态吸附和解吸的影响,进而实现DEAE-52纤维素对NIOP静态分离纯化的目的。此方法操作方便,耗时少,为后期研究多糖的结构及其活性研究提供了一定的基础。
1 材料与方法
1.1 材料与仪器
桦褐孔菌子实体大兴安岭品味食品有限公司;DEAE-52纤维素Pharmacia公司;Sephadex G-100Waters公司;苯酚、硫酸等其余试剂均为国产分析纯。
TGL-16C型离心机上海安亭科学仪器厂;TU-1810型紫外分光光度计上海棱光科技有限公司;RE52CS型旋转蒸发仪上海亚荣生化仪器厂;TF-FD型冷冻干燥机北京博医康实验仪器有限公司;BT-200B型数显恒流泵、BS-100A型自动部分收集器中国上海沪西分析仪器厂;HCY-DA型全温度摇床太仓市豪诚实验仪器制造有限公司;1260 Infinity凝胶渗透色谱仪(Waters 2410示差折光检测器)美国Agilent公司。
1.2 实验方法
1.2.1桦褐孔菌子实体多糖的制备准确称取一定量的桦褐孔菌子实体粉末,放入圆底烧瓶中,按照料液比为1∶30 g/mL加入蒸馏水,混合均匀,在室温下浸提48 h,4000 r/min离心10 min,收集上清液。向上清液中加入4倍体积无水乙醇,在4 ℃下醇沉过夜。醇沉后,8000 r/min离心10 min,收集沉淀,50 ℃干燥后得NIOP。
1.2.2多糖含量测定以葡萄糖为标准,通过苯酚-硫酸法测定多糖含量[23]。将葡萄糖标准液(2.0 mL,100 μg/mL)与1.0 mL苯酚溶液(6%)和5 mL硫酸混合。冷却至室温后,用紫外分光光度计在490 nm下测定吸光度(Abs)。以葡萄糖浓度为横坐标,吸光度Abs为纵坐标绘制标准曲线,得回归方程为y=10.56x+0.01,R2=0.9992,式中y为吸光值,x为葡萄糖浓度(mg/mL)。准确吸取2.0 mL样品溶液,按上述步骤在490 nm波长处测定吸光度,从标准曲线上查得,并计算相应含量。
1.2.3DEAE-52的预处理将DEAE-52离子交换剂干粉浸泡于蒸馏水中约5 h,抽滤,在0.5 mol/L的HCl溶液中浸泡2 h后用去离子水洗至pH中性,抽干,加0.5 mol/L的NaOH溶液浸泡2 h,用去离子水将其洗至中性,并将其在抽滤漏斗中抽干。即得到了处理好的DEAE-52[24]。
1.2.4DEAE-52静态吸附准确称取15 g处理后的DEAE-52纤维素,放入锥形瓶中,向其中加入20 mL的NIOP溶液。固定反应条件为吸附转速120 r/min、样品浓度为40 mg/mL、吸附时间为90 min,研究不同吸附温度(20、30、40、50 ℃)处理后的DEAE-52纤维素对多糖的吸附量影响;固定反应条件为吸附温度30 ℃、样品浓度为40 mg/mL、吸附时间为90 min,考察不同吸附转速(50、100、120、150、200、250 r/min)处理后的DEAE-52纤维素对多糖的吸附量影响;固定反应条件为吸附转速120 r/min、吸附温度30 ℃、吸附时间为90 min,考察不同NIOP溶液浓度(20、30、35、40、50、60、70 mg/mL)处理后的DEAE-52纤维素对多糖的吸附量影响;固定反应条件为吸附转速120 r/min、样品浓度为40 mg/mL、吸附温度30 ℃,考察不同吸附时间(15、30、45、60、75、90、120、150 min)处理后的DEAE-52纤维素对多糖的吸附量影响。吸附量按下式公式计算。
式中,Q-为吸附量(mg/g);C1-初始浓度(mg/mL);C2-吸附后浓度(mg/mL);V-溶液体积(mL);W-DEAE-52纤维素质量(g)。
1.2.5DEAE-52静态解吸准确称取预处理好的DEAE-52纤维素加入锥形瓶内,向其中加入浓度为40 mg/mL NIOP溶液(比例为:15 g纤维素加入20 mL NIOP粗多糖液),在30 ℃和120 r/min的转速下振荡90 min。即得饱和吸附纤维,测定多糖吸附量,滤干备用。将吸附多糖后的饱和吸附纤维加入去离子水在30 ℃和120 r/min的转速下振荡90 min,研究不同体积倍数(8、9、10、11、12、13、14、15、16)的去离子水对洗脱多糖浓度的影响。向经去离子水处理后的饱和吸附纤维加入的0.2 mol/L NaCl溶液,在上述温度和转速下振荡60 min,研究不同体积倍数(8、9、10、11、12、13、14、15、16)的0.2 mol/L NaCl溶液对洗脱多糖浓度的影响。向吸附多糖后的饱和吸附纤维加入12倍体积的去离子水后,将三角瓶放在在30 ℃和120 r/min后,研究不同洗脱时间(10、20、30、40、50、60、70、80、90、120 min)对洗脱多糖浓度的影响。向经去离子水处理后的饱和吸附纤维,加入11倍体积的0.2 mol/L的NaCl,按上述处理方法,研究不同洗脱时间对洗脱多糖浓度的影响。洗脱率按下式公式计算。
式中,R-为洗脱率(%);P0-为上样液起始浓度(mg/mL);P1-为吸附后上样液浓度(mg/mL);P2-为洗脱后浓度(mg/mL);V1-为吸附液体积(mL);V2-为洗脱液用量。
1.2.6Sephadex G-100葡聚糖凝胶柱层析分离纯化多糖将经预处理后的Sephadex G-100葡聚糖凝胶采用湿法装柱,分别取NIOP1、NIOP2溶液上Sephadex G-100葡聚糖凝胶柱(2.6 cm×70 cm),以蒸馏水洗脱,流速20 mL/h,每6 min收集一管,每管约2 mL。使用苯酚硫酸法测定每管多糖浓度。以管数为横坐标,吸光度为纵坐标绘制洗脱曲线。
1.2.7凝胶渗透色谱测定多糖纯度[25]色谱条件:色谱柱,Waters UllrallydrogelTM Linear(规格为7.8 mm×300 mm);流动相,0.1 mol/L NaNO3溶液;流速,0.9 mL/min;柱温,45 ℃。
1.2.8数据处理实验中每个处理重复三次,采用Student’s test进行数据分析,采用origin 8.0软件作图。
2 结果与分析
2.1 DEAE-52静态吸附实验
2.1.1吸附温度对DEAE-52纤维素静态多糖吸附量的影响由图1可知,温度影响DEAE-52纤维素对吸附NIOP量随温度的升高呈现增大后减小的趋势,在20~30 ℃时,DEAE-52纤维素对NIOP的吸附量随着吸附温度的升高而增大,但30 ℃之后,随着温度的升高,DEAE-52纤维素对NIOP的吸附量变小。这是由于吸附和解析均需活化能,且吸附的活化能小于解析的活化能,因此在低温范围内,吸附量随温度的升高而增大,高温范围内,吸附量随温度升高却减小,这与文献报道一致[26]。因此选择在30 ℃下吸附。
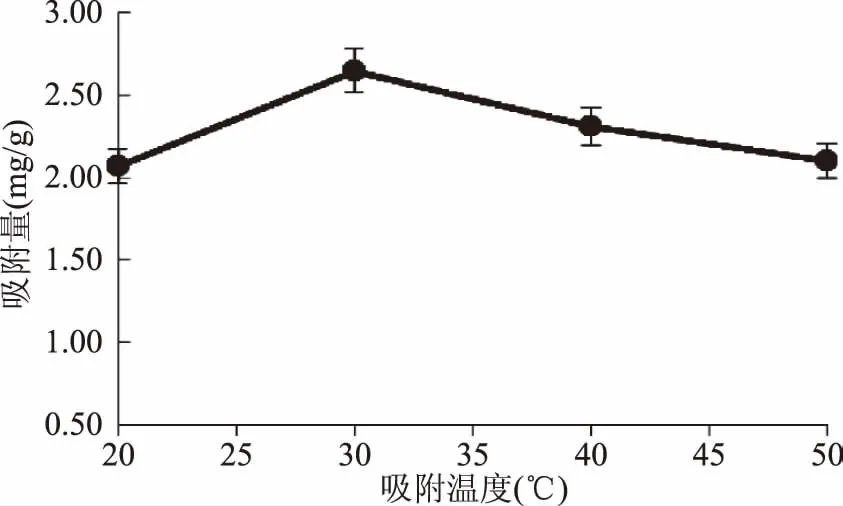
图1 吸附温度对DEAE多糖吸附量的影响Fig.1 Effect of adsorption temperature on the adsorbance of DEAE-52
2.1.2吸附转速对DEAE-52纤维素静态多糖吸附量的影响DEAE-52纤维素对NIOP的吸附量随着吸附转速的增大呈现先增大后减小趋势。从图2可知,DEAE-52在120 r/min时吸附量最大。当转速高于120 r/min时,多糖的吸附量逐渐减小。这可能是因为转速增加了多糖液与DEAE-52纤维素接触面积,吸附量增多,但是当转速过高时吸附的多糖可能被解吸到溶液中,导致吸附量减小[27]。因此选择的吸附转速为120 r/min时,此时吸附效果最好。
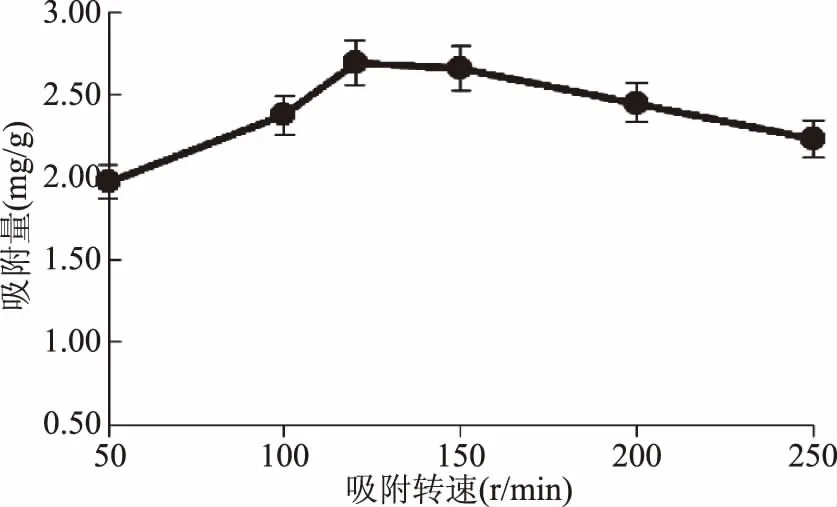
图2 旋转转速对DEAE-52多糖吸附量的影响Fig.2 Effect of rotate speed on the adsorbance of DEAE-52
2.1.3NIOP溶液浓度对DEAE-52纤维素静态多糖吸附量的影响由图3可知,DEAE-52纤维素对多糖的吸附量随着样品浓度的增大而提高。其中,当NIOP溶液浓度达到40 mg/mL(多糖含量为6.3 mg/mL)时,DEAE-52纤维素对多糖的吸附量为2.87 mg/g,但当样品浓度再增大时,多糖的吸附量增加不明显。这可能因为DEAE-52纤维素对多糖的吸附逐渐达到了饱和状态,对多糖的吸附量随着NIOP溶液浓度的增大而增加不明显,因此选择40 mg/mL为NIOP溶液最适浓度。
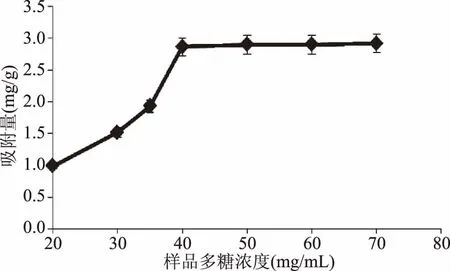
图3 样品液多糖浓度对DEAE-52多糖吸附量的影响Fig.3 Effect of sample concentration of polysaccharides on the adsorbance of DEAE-52
2.1.4吸附时间对DEAE-52静态多糖吸附量的影响由图4可知,DEAE-52纤维素对多糖的吸附量随着吸附时间的增长而提高。当吸附时间为90 min时,DEAE-52纤维素对多糖的吸收量为2.51 mg/g,但当吸附时间再增长时,多糖的吸附量增加不明显。为了能高效的分离多糖,选择吸附时间为90 min最为合适。
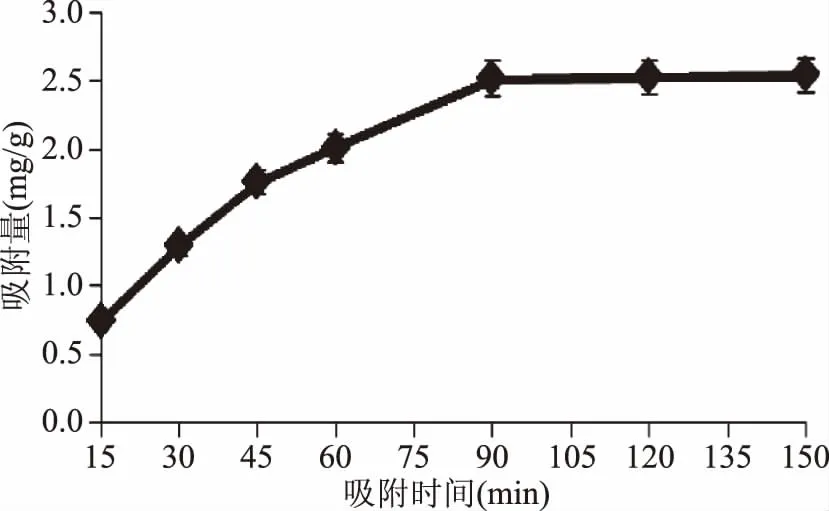
图4 吸附时间对DEAE-52多糖吸附量的影响Fig.4 Effect of adsorption time on the adsorbance of DEAE-52
2.2 DEAE静态解吸实验
2.2.1洗脱体积倍数对饱和吸附纤维NIOP洗脱多糖浓度的影响不同溶液洗脱体积倍数对饱和吸附纤维NIOP洗脱多糖浓度的影响结果见图5和图6。如图所示,随着洗脱体积倍数的增加,洗出的多糖的浓度呈现先增加后减少的趋势。其中NIOP1的最适洗脱体积为12倍体积,此时洗脱的多糖浓度为0.56 mg/mL(多糖质量为11.17 mg),洗脱率为28.20%。而NIOP2的最适洗脱体积为11倍体积,此时洗脱的多糖的浓度为0.38 mg/mL(多糖质量为7.55 mg),洗脱率为19.06%。在采用DEAE-52纤维素柱层析分离纯化多糖时,NIOP1的洗脱率约为28%,NIOP2的洗脱率约为20%,洗脱率相差不大[22]。
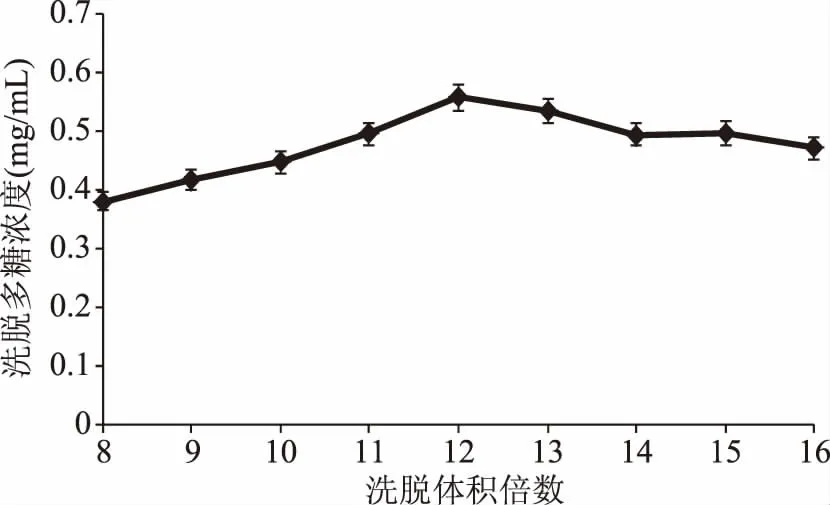
图5 去离子水洗脱体积对DEAE-52解吸附多糖浓度的影响Fig.5 Effect of elution volume of deionized water on the release quantity of polysaccharide concentration of DEAE-52
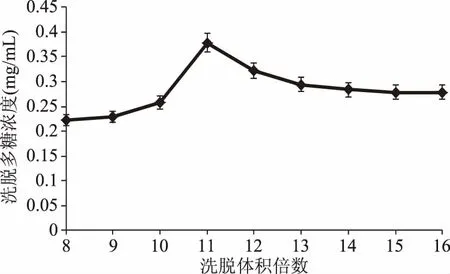
图6 0.2 mol/L NaCl 溶液洗脱体积对DEAE-52解吸附多糖浓度的影响Fig.6 Effect of elution volume of 0.2 mol/L NaCl solution on the release quantity of polysaccharide concentration of DEAE-52
2.2.2洗脱时间对饱和吸附纤维NIOP洗脱多糖浓度的影响洗脱时间对DEAE-52纤维素树脂洗脱多糖浓度的影响结果见图7和图8。如图所示,随着洗脱时间的不断增加,洗出的多糖浓度不断增加,但洗脱时间达到一定数值后,随时间的增加,洗脱的多糖浓度增加不明显。为节约成本和时间,选择的NIOP1和NIOP2的最适洗脱时间分别为90 min和60 min,此时洗脱的多糖浓度分别为0.55 mg/mL(多糖质量为11.07 mg)、0.36 mg/mL(多糖质量为7.18 mg),洗脱率分别为24.6%、15.6%。与之前DEAE-52纤维素柱层析分离多糖相比[22],洗脱率稍微有所下降,这是因为随着时间的不断增加,仍能有少量多糖被洗出。
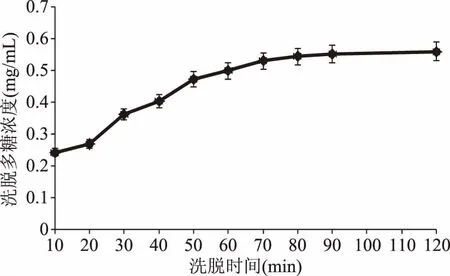
图7 去离子水的洗脱时间对DEAE-52解吸附多糖浓度的影响Fig.7 Effect of elution time of deionized water on the release quantity of polysaccharide concentration of DEAE-52
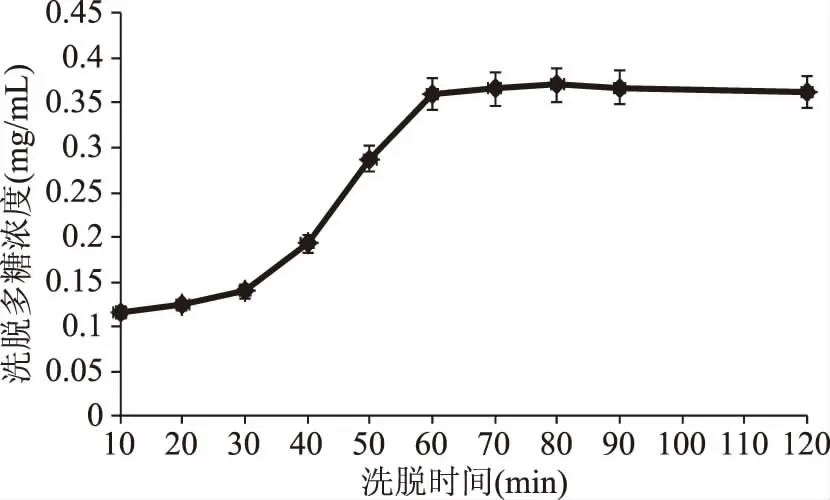
图8 0.2 mol/L NaCl 溶液洗脱时间对DEAE-52解吸附多糖浓度的影响Fig.8 Effect of elution time of 0.2 mol/L NaCl solutionon the release quantity of polysaccharide concentration of DEAE-52
2.3 Sephadex G-100 葡聚糖凝胶柱层析
如图9和图10中所示,NIOP1和NIOP2经Sephadex G-100 葡聚糖凝胶柱层析均为单一洗脱峰,且各峰面积所示多糖分别占总多糖的63.65%、71.24%,其中多糖的回收率分别为:79.98%、81.45%,可以初步判断洗脱所得多糖NIOP1和NIOP2均为分子量分布均一的多糖组分,但为进一步检验NIOP1和NIOP2的均一性,采用GPC对其均一性进行进一步鉴定。
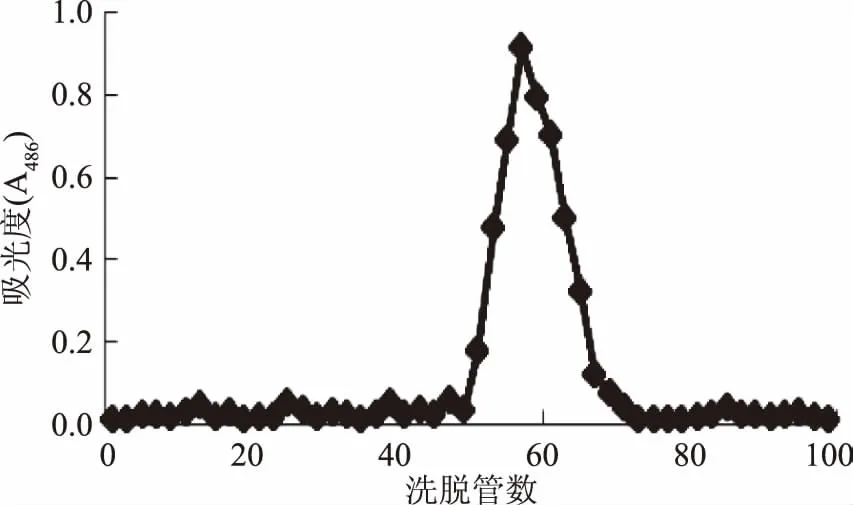
图9 NIOP1的Sephadex G-100葡聚糖凝胶柱层析峰图Fig.9 Sephadex G-100 column chromatography for NIOP1
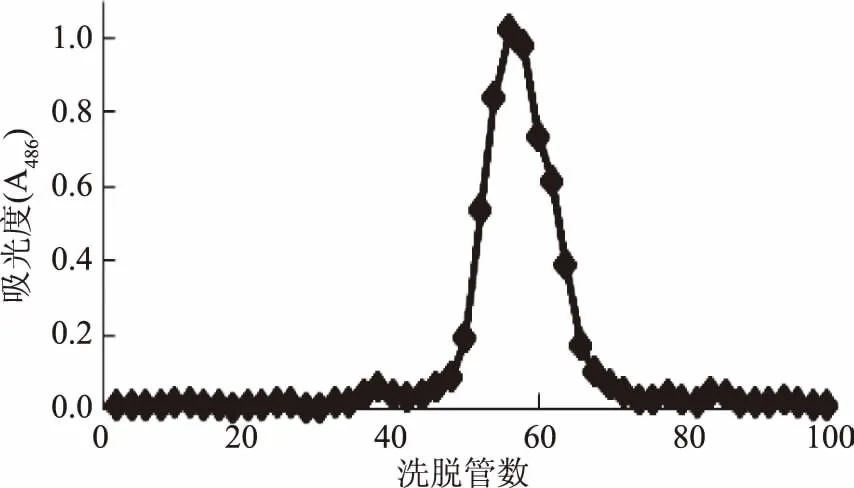
图10 NIOP2的Sephadex G-100葡聚糖凝胶柱层析峰图Fig.10 Sephadex G-100 column chromatography for NIOP2
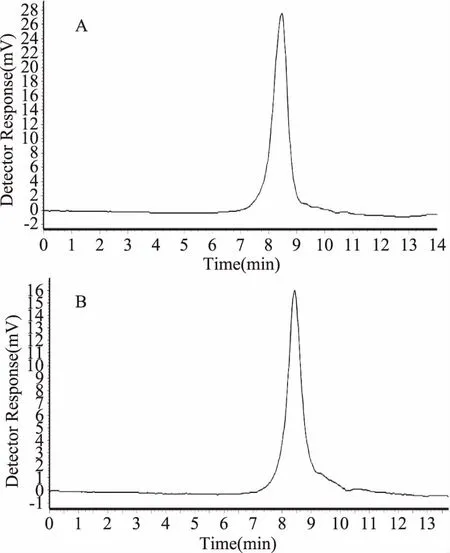
图11 葡聚糖凝胶色谱图Fig.11 The GPC gel chromatography spectrum注:A:NIOP1;B:NIOP2。
2.4 NIOP1和NIOP2纯度鉴定
由图11可以看出NIOP1、NIOP2组分在GPC上呈现一单峰,保留时间分别为8.47 min和8.41 min平均相对分子量分别是24574、27901 Da。凝胶柱色谱图与其相应的SephadexG-100凝胶柱层析洗脱结果相一致,进一步说明NIOP1和NIOP2具有较强的均一性分布。
3 结论
本实验的静态研究得出了最佳静态吸附和解吸条件,实验表明,DEAE-52纤维素在NIOP浓度为40 mg/mL,温度30 ℃,120 r/min转速下处理90 min时对NIOP的吸附效果最佳。而饱和吸附纤维最佳解吸条件是:NIOP1洗脱剂用量为12倍体积,洗脱时间为90 min;NIOP2洗脱剂用量为11倍体积,洗脱时间为60 min。且DEAE-52纤维素静态洗脱出的多糖NIOP1和NIOP2均为分子量均一分布的多糖,与前期动态洗脱多糖结果一致。与动态洗脱相比,DEAE-52纤维素静态吸附耗时少,操作简单,而且对NIOP具有良好的分离纯化效果,为后期大量制备多糖提供了一定的理论基础。
[1]Shin YS,Tamai Y,Terazawa M. Chemical constituents ofInonotusobliquusI,A triterpene,3β-hydroxy-8,24-dime lanosta 21,23 lacton of romscretium[J].Eurasian Journal of Forest Research,2000(1):43-50.
[2]刘迎秋,包海鹰. 桦褐孔菌Inonotusnobliquus化学成分及药理作用[J]. 中国食用菌,2008,27(4):34-39.
[3]陈义勇,黄友如,刘晶晶,等. 桦褐孔菌多糖IOP3a体内抗肿瘤活性及其机制[J]. 食品与生物技术学报,2013,32(9):983-988.
[4]Zhao F,Mai Q,Ma J,et al. Triterpenoids fromInonotusobliquusand their antitumor activities[J]. Fitoterapia,2015,101:34-40.
[5]张丽霞,张伟娜,李凌智,等. 不同提取方法对桦褐孔菌多糖抗氧化活性的影响[J]. 安徽农业科学,2012,40(10):5870-5872.
[6]Hu Y,Sheng Y,Yu M,et al. Antioxidant activity ofInonotusobliquuspolysaccharide and its amelioration for chronic pancreatitis in mice.[J]. International Journal of Biological Macromolecules,2016,87:348.
[7]崔鹤松,金光. 桦褐孔菌多糖对实验性高脂血症模型大鼠血脂的影响[J]. 延边大学医学学报,2007,30(3):173-174.
[8]Chen G,Luo Y C,Li B P,et al. Effect of polysaccharide from Auricularia auricula on blood lipid metabolism and lipoprotein lipase activity of ICR mice fed a cholesterol-enriched diet[J]. Journal of Food Science,2010,73(6):H103-H108.
[9]张泽生,杨超慧,史砷,等. 桦褐孔菌多糖对小鼠免疫调节作用的影响[J]. 食品研究与开发,2008,29(7):35-37.
[10]Fan L,Ding S,Ai L,et al. Antitumor and immunomodulatory activity of water-soluble polysaccharide fromInonotusobliquus[J]. Carbohydrate Polymers,2012,90(2):870-4.
[11]Hu T. Isolation,purification and effects of hypoglycemic functional polysaccharides fromInonotusobliquus[J]. African Journal of Biotechnology,2012,11(30):7738-7743.
[12]李翠丽,王炜,张英,等. 中药多糖提取、分离纯化方法的研究进展[J]. 中国药房,2016,27(19):2700-2703.
[13]王博,斯聪聪,程国才. 响应面优化超滤膜分离灵芝多糖工艺[J]. 食品工业,2015(12):1-4.
[14]江新凤,高其璋,杨普香,等. 乙醇沉淀法提取茶花多糖
的研究[J]. 蚕桑茶叶通讯,2013(5):31-33.
[15]戚跃明,陈涛. 紫芝胞外多糖分离纯化及抗氧化性的研究[J]. 食品工业科技,2013,34(4):105-108.
[16]任海伟,陈海秀,唐学慧,等. 大孔树脂纯化薏苡多糖的研究[J]. 食品工业科技,2012,33(3):249-251.
[17]景永帅,张丹参,吴兰芳,等. 荔枝低分子量多糖的分离纯化及抗氧化吸湿保湿性能分析[J]. 农业工程学报,2016,32(9):277-283.
[18]张岩,马丽娜,陶遵威. 中药多糖的分离纯化方法研究进展[J]. 天津药学,2011,23(3):72-74.
[19]李翠丽,王炜,张英,等. 中药多糖提取、分离纯化方法的研究进展[J]. 中国药房,2016,27(19):2700-2703.
[20]姜绍通,汪洪普,潘丽军. 芋头多糖的分离纯化及对细胞免疫的调节作用[J]. 食品科学,2013,34(19):287-292.
[21]Meng M,Cheng D,Han L,et al. Isolation,purification,structural analysis and immunostimulatory activity of water-soluble polysaccharides fromGrifolaFrondosafruiting body[J]. Carbohydrate Polymers,2016,157:1134.
[22]王丽.桦褐孔菌降血糖多糖的分离纯化与α-葡萄糖苷酶抑制活性研究[D].北京:中国农业大学,2016.
[23]刘璐,乔宇,汪兰,等. 山药多糖的抗氧化作用研究[J]. 食品科技,2014(12):212-216.
[24]李敏晶,毛婕昕,付荣香. DEAE-纤维素分离提纯海带硫酸多糖的研究[J]. 广东化工,2010,37(9):30-31.
[25]金鑫,赖凤英. 仙人掌多糖的提取、分离纯化及GPC法测定其分子量[J]. 现代食品科技,2006,22(2):138-140.
[26]许素新,刘廷岳. 离子交换纤维对桑叶多糖静态吸附和解吸的研究[J]. 时珍国医国药,2011,22(8):1943-1945.
[27]任爱农. 野菊花多糖的提取分离、免疫活性研究及分子量测定[D]. 镇江:江苏大学,2012.

