逆流超声辅助酶解法制备大米ACE抑制肽
,, ,
(江苏大学食品与生物工程学院,江苏镇江 212013)
米渣是生产淀粉、糖、味精、柠檬酸及酿酒等产品的加工副产物[1],富含优质的蛋白(40%~65%)[1],目前主要用于动物饲料生产,没有挖掘其潜在价值进行高值化利用,难以实现米渣价值的最大化,因此,急需对米渣进行精深加工。
研究表明,酶解菜籽粕[2]、玉米胚芽粕[3]等植物原料制备的血管紧张素转换酶(Angiotensin-I Converting Enzyme,ACE)抑制肽能有效地降低血压,因此,从米渣中提取大米蛋白用于酶解制备ACE抑制肽有望实现对米渣的高值化利用。近年来,非热物理加工技术发展迅速,已广泛的应用于食品深加工研究领域[4]。尤其是超声波技术,已经在促进活性成分的提取[5]、辅助酶解[6]和促进蛋白乳化[7]等方面起到显著的效果,其中最为显著的是在超声辅助酶解方面,能够有效地解决酶解产物活性不高、酶解不充分[8]等问题,如毛丽琴[9]用超声波辅助酶解制备ACE抑制肽。但传统的超声设备如李敏[10]等人使用的超声清洗机,张辉[11]使用的超声探头发生器均存在超声频率固定、超声不均匀、设备不易放大等缺陷,很难应用于工业化生产。因此,需要研发新型超声设备解决此类问题。
本文使用自主研发的新型逆流超声设备,可更换超声频率,逆流超声使超声更均匀。以大米蛋白为研究对象,首先优化酶解参数,在最优酶解参数基础上,研究不同超声参数预处理对大米蛋白酶解物ACE抑制活性的影响。
1 材料与方法
1.1 材料与仪器
米渣(实验测定蛋白含量56.1%)湖北京源山生物科技股份有限公司;ACE自提[12](200 g猪肺可提取ACE 356.41 U,比活力3.00412×104U/g);马尿酸(Hippuric acid,Hip)中国医药集团上海化学试剂公司;马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu tetrahydrate,HHL)美国Sigma公司;碱性蛋白酶(酶活2.09454×105U/g)河南鑫宏泰生物科技有限公司;甲醇、乙腈上海安普实验科技股份有限公司。
JY98-IIIDN型超声细胞粉碎机宁波新芝生物科技股份有限公司;逆流超声波设备江苏大学食品与生物工程学院(见图1);DF-1型集热式恒温磁力搅拌器金坛市中大仪器厂;DR-5C型低温冷冻离心机上海安亭科学仪器厂;PHS-3C型酸度计上海鸿盖仪器有限公司;Card-Waters型高效液相色谱系统美国Waters公司;ALPHA-2-4 Card-真空冷冻干燥机德国Martin Christ公司。
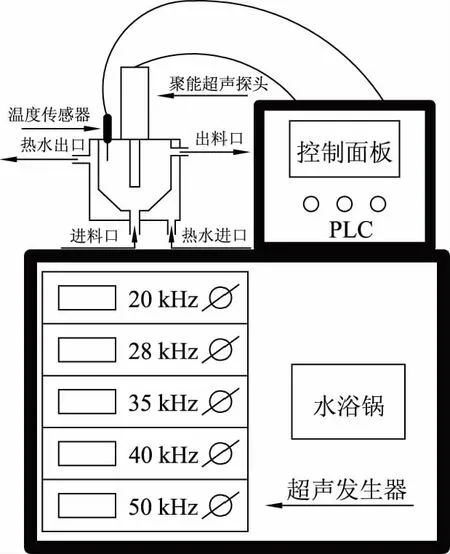
图1 超声设备示意图Fig.1 Schematic diagram of ultrasonic equipment
1.2 实验方法
1.2.1大米蛋白的提取参考Yang[13]等所描述的大米蛋白提取方法,将80 g米渣加入1000 mL蒸馏水,用3 mol/L的NaOH溶液调节混合液的pH,热水浴使温度稳定在50 ℃,搅拌3 h,稳定pH为7.8。然后在5000 r/min下离心15 min,取上清液用3 mol/L的盐酸调节pH到4.0,再在5030×g离心力下离心15 min,将沉淀重新悬浮于蒸馏水中,调节pH为7。使用冷冻干燥机将悬浮液干燥,采用凯氏定氮法测定蛋白含量(GB/T 5009.5-2003)。所提取的大米蛋白保存在干燥皿中待用。
1.2.2酶解参数的单因素筛选用碱性蛋白酶对底物蛋白进行酶解,根据Li[14]等的研究略作修改,初始设定酶解参数条件为底物浓度30 g/L、加酶量7.5%、酶解时间60 min、温度50 ℃、pH8.5,采用单因素逐级优化法,以ACE抑制率为主要指标,筛选底物浓度参数,确定最优底物浓度后同样的方法依次筛选加酶量、温度、pH、时间。
1.2.2.1不同底物浓度对ACE抑制率的影响分别将12 g大米蛋白加入600、400、300、240和200 mL蒸馏水中配成浓度分别为20、30、40、50和60 g/L蛋白溶液,实验条件采用反应温度50 ℃,加酶量为7.5%(E/S),pH8.5,酶解时间60 min。在酶解过程中不断滴加1 mol/L NaOH调节pH,记录消耗的碱量并计算DH,酶解结束后,沸水浴灭酶10 min,然后在5000 r/min离心10 min,取上清液稀释50倍检测ACE抑制率。
1.2.2.2不同加酶量对ACE抑制率的影响实验条件采用底物浓度30 g/L,反应温度50 ℃,维持pH为8.5,酶解时间60 min,按照设定的加酶量4.5%(E/S)、6%(E/S)、7.5%(E/S)、9%(E/S)、10.5%(E/S),分别加入5.4、7.2、9.0、10.8和12.6 mL碱性蛋白酶,后续酶解操作同1.2.2.1。
1.2.2.3不同温度对ACE抑制率的影响实验条件采用底物浓度30 g/L,加酶量7.5%(E/S),维持 pH为8.5,酶解时间60 min,温度分别设为40、45、50、55和60 ℃,进行实验,后续酶解操作同1.2.2.1。
1.2.2.4不同pH对ACE抑制率的影响实验条件采用底物浓度30 g/L,加酶量7.5%(E/S),反应温度50 ℃,酶解时间60 min,pH分别维持在7.5、8、8.5、9、9.5进行实验。后续酶解操作同1.2.2.1。
1.2.2.5不同时间对ACE抑制率的影响实验条件采用底物浓度30 g/L,加酶量7.5%(E/S),反应温度50 ℃,维持 pH为8.5,酶解时间分别设为30、45、60、75和90 min进行实验。后续酶解操作同1.2.2.1。
1.2.3超声参数的筛选实验使用自主研发的逆流超声波设备在大米蛋白酶解前进行超声预处理,设备示意图见图1,以传统超声设备(JY98-IIIDN超声细胞粉碎机)作为对照。初步设定逆流超声设备和传统超声设备超声参数为频率20 kHz、功率密度80 W/L、时间10 min,采用单因素逐级优化法,以ACE抑制率为主要指标,筛选最优超声频率、功率密度和超声时间。
1.2.3.1对传统超声参数进行筛选因传统超声无法调整超声频率,故对超声功率密度及超声时间进行筛选。分别设定超声功率密度为80、110、140、170、200 W/L,超声时间10 min对大米蛋白进行超声预处理,酶解实验按上述最优酶解参数进行,酶解结束后操作同1.2.2.1中的后续处理。取200 W/L超声功率密度,设定超声时间为5、7.5、10、12.5、15 min进行超声预处理,酶解实验按上述最优酶解参数进行,酶解结束后操作同1.2.2.1中的后续处理。
1.2.3.2对逆流式超声参数进行筛选设定超声频率为20、28、35、40、50 kHz,超声功率密度80 W/L,超声时间10 min,得到的酶解液后续操作同传统超声。采用筛选的20 kHz超声频率进行超声功率密度筛选,设定为80、110、140、170、200 W/L进行超声预处理,得到的酶解液后续操作同传统超声。取筛选的20kHz超声频率、170 W/L功率密度,对超声时间进行筛选,设定为5、7.5、10、12.5、15 min进行超声预处理,得到的酶解液后续操作同传统超声。
1.2.4大米蛋白水解度的测定方法采用pH-Stat法[15]测定蛋白水解度,计算公式如下:
式中:h-被裂解的肽键数;htot-为常数,即每个底物中蛋白中含有的肽键总数,大米蛋白为7.72 mmol/g;B-消耗的碱液的体积(mL);N-碱液的摩尔浓度(mol/L);α-大米蛋白的平均解离度,此处为0.969;m-底物中蛋白质总含量(g)。
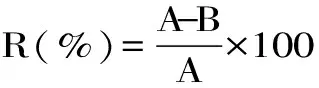
式中,R为酶解液对ACE的抑制率(%);A为空白对照组中马尿酸的峰面积(mAU·s);B为添加酶解液组中马尿酸的峰面积(mAU·s)。
1.3 数据分析
2 结果与分析
2.1 蛋白的提取
原料米渣(蛋白含量56.1%)经碱溶酸沉法提取出大米蛋白,经凯氏定氮法测定得到蛋白含量为81.57%。
2.2 不同酶解参数对大米蛋白水解度及酶解液ACE抑制率的影响
2.2.1底物浓度对大米蛋白水解度及酶解液ACE抑制率从图2可以看出大米蛋白的DH及酶解物ACE抑制率随底物浓度增加均呈现先增加后下降的趋势,当底物浓度为30 g/L时,ACE抑制率达到最高,而后酶解物ACE抑制率随着底物浓度的增加而降低,原因可能类似于杨晓军[17]酶解斑点叉尾鮰内脏制ACE抑制肽中所述底物浓度过高,导致酶解体系过于黏稠,减小了酶与底物结合的机率,从而导致ACE抑制率降低。结果表明,底物浓度为20 g/L和30 g/L时ACE抑制率无显著差异(p>0.05),30 g/L的底物浓度DH更高,多肽得率高,选择底物浓度为30 g/L进行后续实验。
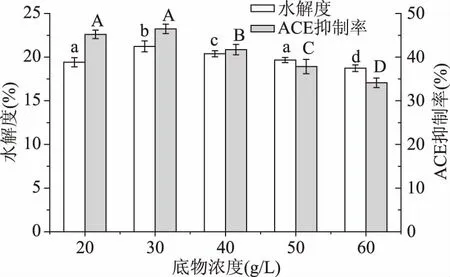
图2 底物浓度对大米蛋白水解度及酶解液ACE抑制率的影响Fig.2 Effect of substrate concentration on the DH and the ACE inhibitory rate of rice protein hydrolysate注:图中条形柱上的不同大、小写字母表示不同处理间差异显著(p<0.05),图3~图11同。
2.2.2加酶量对大米蛋白水解度及酶解液ACE抑制率的影响从图3可以看出酶解液的DH和ACE抑制率变化趋势一致,在加酶量为7.5%时,其酶解液的ACE抑制活性开始趋于平缓,是因为当加酶量为7.5%时,酶相对于底物来说处于饱和状态。加酶量为7.5%、9%、10.5%时ACE抑制率与DH的差异均不显著(p>0.05)。为了节约成本,选择加酶量为7.5%进行后续实验。
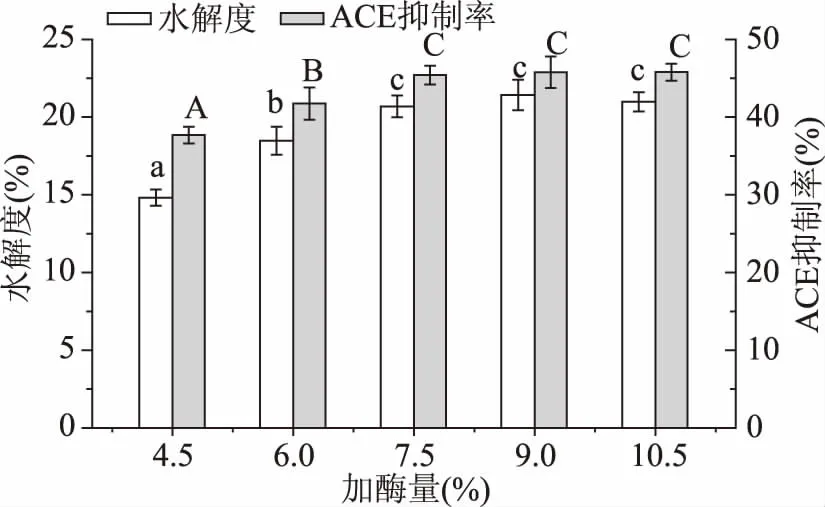
图3 加酶量对大米蛋白水解度及酶解液ACE抑制率的影响Fig.3 Effect of enzyme dosage on the DH and the ACE inhibitory rate of rice protein hydrolysate
2.2.3温度对大米蛋白水解度及酶解液ACE抑制率的影响由图4可以看出随酶解温度升高,ACE抑制率与DH均呈现先升高后趋于平稳的趋势,这是因为碱性蛋白酶酶活随温度升高而变强[18],达到50 ℃后酶活保持稳定,随后50、55、60 ℃时ACE抑制率与DH之间没有显著差异(p>0.05),为了减少能耗,选择酶解温度为50 ℃进行后续实验。
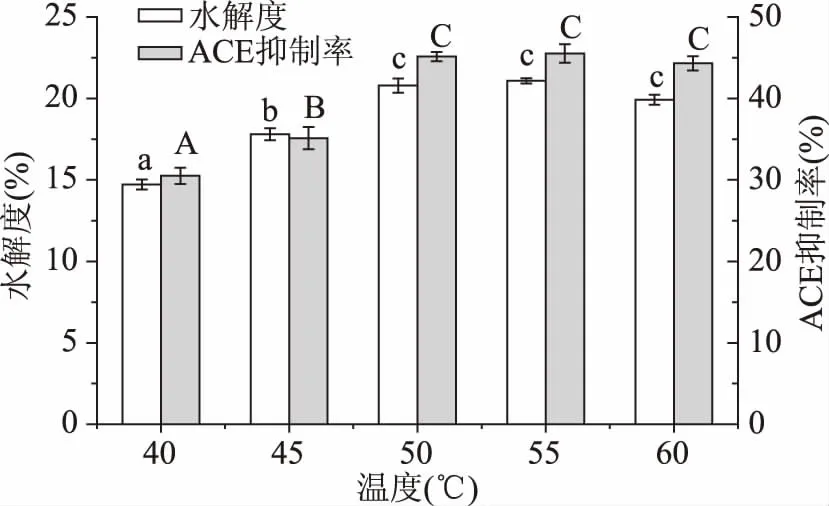
图4 温度对大米蛋白水解度及酶解液ACE抑制率的影响Fig.4 Effect of temperature on the DH and the ACE inhibitory rate of rice protein hydrolysate
2.2.4pH对大米蛋白水解度及酶解液ACE抑制率的影响图5表明,pH的变化使酶解液ACE抑制率呈现先上升后下降的趋势,这是由于随pH接近酶的最适pH8.5~9.0时,酶的催化效率变高,当超过最适pH时,酶的分子结构开始改变,催化活性降低,张艳萍等[19]研究的贻贝ACE抑制活性肽也表现出这种趋势。pH为8.5与9.0时ACE抑制率无明显差异(p>0.05),为了降低加碱量,选择pH为8.5进行后续实验。
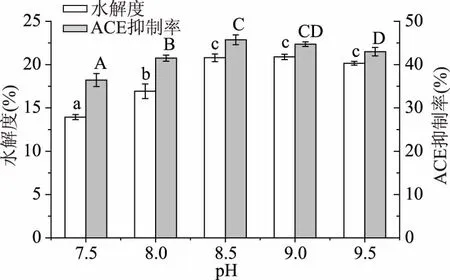
图5 pH对大米蛋白水解度及酶解液ACE抑制率的影响Fig.5 Effect of pH on the DH and the ACE inhibitory rate of rice protein hydrolysate
2.2.5酶解时间对大米蛋白水解度及酶解液ACE抑制率的影响图6中可以发现,大米蛋白的DH及酶解液ACE抑制率随着酶解时间的增加先上升后趋于稳定。酶解液的ACE抑制率在60 min时达到最大值。原因可能是随着酶解时间增加,生成新的具有降血压活性的多肽,使ACE抑制率升高的同时,部分具有降血压特性的肽链裂解,失去生物活性,使酶解产物的ACE活性降低[20],两种同时作用使ACE抑制率趋于平稳,与姚成虎[20]结论不同,可能是因为酶解时间不够长,仍有底物与酶反应生成新的具有ACE抑制活性的肽链。酶解时间为60、75、90 min时的酶解液ACE抑制率无明显差异(p>0.05),60 min与75 min时的DH无明显差异(p>0.05),为提高实验效率,选择酶解时间为60 min,此时大米蛋白酶解液ACE抑制率为45.59%,水解度为21.49%。
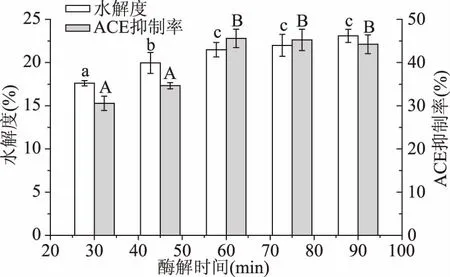
图6 酶解时间对大米蛋白水解度及酶解液ACE抑制率的影响Fig.6 Effect of time on the DH and the ACE inhibitory rate of rice protein hydrolysate
2.3 超声参数筛选
2.3.1传统超声功率密度对大米蛋白水解度及酶解液ACE抑制率的影响在已优化的酶解参数基础上对传统聚能探头式超声波设备进行参数筛选,由于传统聚能超声探头发生器无法调整超声频率,所以对功率密度与超声时间进行筛选。超声功率密度的筛选如图7所示,DH与ACE抑制率随着功率密度增加而增加,得到传统超声最佳参数为功率密度200 W/L。
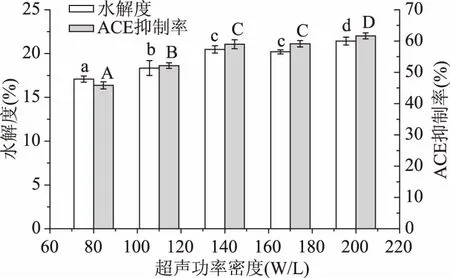
图7 传统超声功率密度对大米蛋白水解度及酶解液ACE抑制率的影响Fig.7 Effect of traditional ultrasonic power density on the DH and the ACE inhibitory rate of rice protein hydrolysate
2.3.2传统超声时间对大米蛋白水解度及酶解液ACE抑制率的影响传统超声时间的筛选如图8,在15 min时ACE抑制率达到最大,选取最优超声时间为15 min。在此参数下酶解液DH为20.32%,ACE抑制率为64.87%。
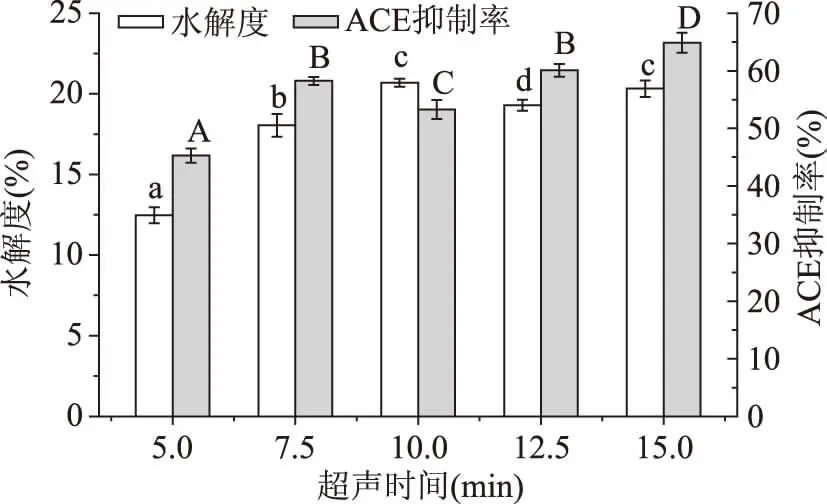
图8 传统超声时间对大米蛋白水解度及酶解液ACE抑制率的影响Fig.8 Effect of traditional ultrasound time on the DH and the ACE inhibitory rate of rice protein hydrolysate
2.3.3逆流超声频率对大米蛋白水解度及酶解液ACE抑制率的影响同样的,在已优化的酶解参数基础上,用不同频率超声预处理后大米蛋白酶解液的DH与ACE抑制率如图9所示,在20 kHz超声频率下ACE抑制率最高为64.02%,与未超声的空白组ACE抑制率相比提高了39.51%。35 kHz时水解度较大,其余超声频率DH差异不明显,与其他组ACE抑制率有较大的区别,可能是因为超声作用,使得蛋白酶优先酶解暴露蛋白表面的疏水性基团,使含有疏水氨基酸的肽增多[20],而含有疏水氨基酸的肽通常具有较高的ACE抑制率[21],在超声频率为20 kHz时这种现象最明显,选取20 kHz作为最优超声频率。
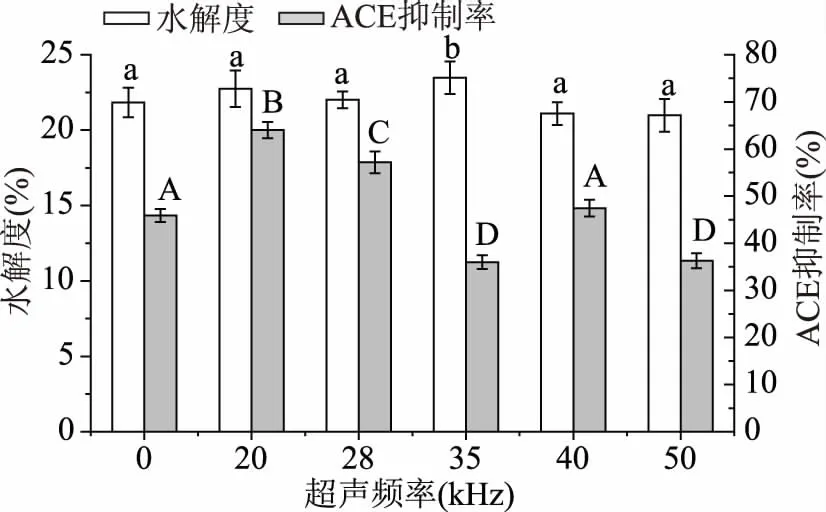
图9 逆流超声频率对大米蛋白水解度及酶解液ACE抑制率的影响Fig.9 Effect of countercurrent ultrasonic frequency on the DH and the ACE inhibitory rate of rice protein hydrolysate
2.3.4逆流超声功率密度对大米蛋白水解度及酶解液ACE抑制率的影响如图10所示,随超声功率密度升高,酶解液ACE抑制率与DH均呈先上升后下降趋势,在170 W/L进行预处理后ACE抑制率到达70.39%,可能是因为随超声功率密度升高,超声形成的空化泡破裂时释放的能量更强,击破蛋白颗粒,使蛋白酶切位点更多的暴露出来,DH增加,形成了更多的ACE抑制肽,ACE抑制率上升,这与金建[22]等的研究具有一致性。随后ACE抑制率与DH下降,原因可能是过高的功率密度产生过高的能量,暴露的疏水基团相互作用,使蛋白分子重新自组装聚集[22]。以最高ACE抑制率为指标选取最佳超声功率密度为170 W/L。
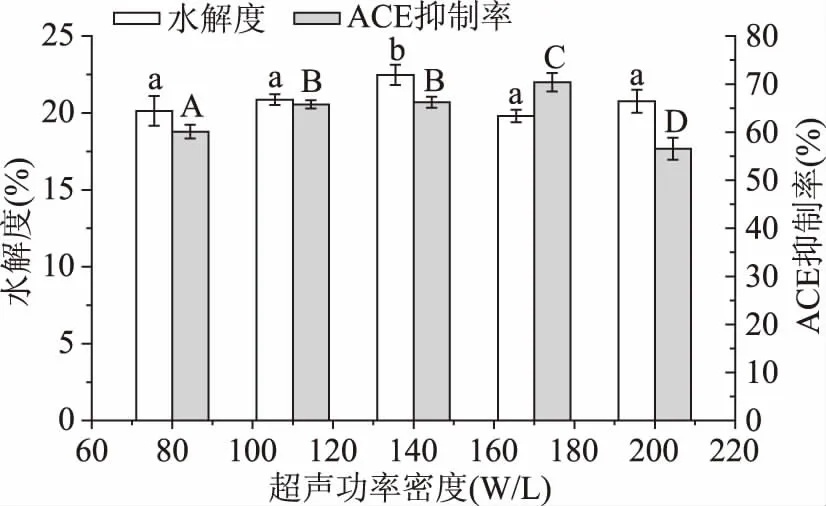
图10 逆流超声功率密度对大米蛋白水解度及酶解液ACE抑制率的影响Fig.10 Effect of countercurrent ultrasound power density on the DH and the ACE inhibitory rate of rice protein hydrolysate
2.3.5逆流超声时间对大米蛋白水解度及酶解液ACE抑制率的影响从图11中可以看出随超声时间的增加,ACE抑制率呈现先上升后下降状态,DH呈现一直上升状态,可能是因为超声时间延长,蛋白分子更多的展开,酶切位点暴露出来,水解度也随之增大,产生的具有ACE抑制的肽也增多,超声时间继续增加后ACE抑制率下降,这可能与超声功率密度过大导致的情况类似,是因为超声时间过长,已展开的蛋白分子发生折叠聚集[23],这与耿静静[24]所得结果相似。根据ACE抑制率的大小选取12.5 min为最优超声时间。
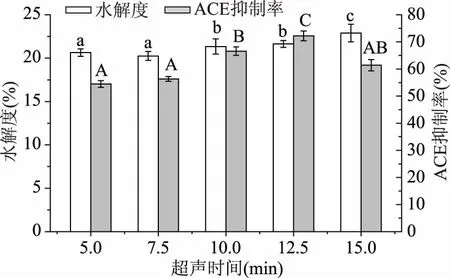
图11 逆流超声时间对大米蛋白水解度及酶解液ACE抑制率的影响Fig.11 Effect of countercurrent ultrasound time on the DH and the ACE inhibitory rate of rice protein hydrolysate
使用自主研发的逆流式超声波仪器筛选出的超声最优参数为:超声频率为20 kHz,功率密度为170 W/L,处理时间为12.5 min,在此参数下大米蛋白酶解液ACE抑制率为72.24%,相较于未超声提高了57.42%。相较于传统超声设备固定的超声频率,本实验所用逆流超声设备拥有20、28、35、40、50 kHz可供筛选,需要超声功率密为170 W/L低于传统超声设备所需的200 W/L,超声时间为12.5 min低于传统超声所需的15 min,设备效率高,能耗低,产物ACE抑制率相较于传统超声设备提高了11.36%。可能是因为逆流循环系统,使整体待处理液充分受到超声波作用,能够克服超声不均匀的问题,为其工业化生产打下基础。
3 结论
通过单因素逐级优化法确定了大米蛋白的最佳酶解参数为底物浓度30 g/L、加酶量7.5%(E/S)、温度50 ℃、pH8.5、酶解时间60 min。在此条件下,大米蛋白酶解液ACE抑制率为45.59%,DH为21.49%。
在最优酶解参数的基础上,筛选出传统超声设备最佳参数为:功率密度200 W/L,超声时间15 min,在此参数下超声波预处理酶解液的ACE抑制率为64.87%。筛选出自主研发逆流式超声设备参数为:超声频率20 kHz,功率密度170 W/L,处理时间12.5 min。在此参数下超声预处理得到大米蛋白酶解液ACE抑制率为72.24%,DH为21.64%相较于未超声时提高了57.42%,相较于传统超声设备ACE抑制率提高了11.36%。
本研究所用逆流超声波设备预处理与传统超声设备相比需要的超声功率密更小,时间更短,酶解液ACE抑制率更高,说明逆流超声设备在辅助酶解制备大米ACE抑制肽的研究中能有效提高酶解效率,减少能耗,提高酶解制备的ACE抑制肽的活性。
[1]张凯. 大米蛋白提取工艺优化、改性及理化性质的研究[D]. 长沙:湖南农业大学,2010.
[2]张艳. 菜籽饼粕蛋白酶法制备ACE抑制肽研究[D]. 武汉:武汉工业学院,2012.
[3]吴迪,任健,宋春丽. 酶解玉米胚芽粕制备ACE抑制肽的条件优化[J]. 粮油食品科技,2014,22(1):51-53.
[4]唐佳妮,张爱萍,孟瑞锋,等. 非热物理加工新技术对食品品质的影响及应用[J]. 食品工业科技,2010,31(3):393-398.
[5]陈晨,胡文忠,田沛源,等. 超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J]. 食品科学,2014,35(2):12-17.
[6]毛丽琴. 双低油菜ACEI活性肽制备技术研究[D]. 镇江:江苏大学,2007.
[7]李杨,韩飞飞,齐宝坤,等. 超声处理对绿豆分离蛋白乳化性的影响[J]. 食品工业科技,2015,36(24):226-229.
[8]Qu W,Ma H,Jia J,et al. Enzymolysis kinetics and activities of ACE inhibitory peptides from wheat germ protein prepared with SFP ultrasound-assisted processing[J]. Ultrasonics Sonochemistry,2012,19(5):1021-1026.
[9]毛丽琴. 双低油菜ACEI活性肽制备技术研究[D]. 镇江:江苏大学,2007.
[10]李敏,陈柳萌,曾江南,等. 超声预处理酶解与常规酶解鱼鳞胶原蛋白的比较[J]. 食品工业,2015,36(11):22-26.
[11]张辉. 超声辅助酶解制备麦麸抗氧化肽工艺的研究[J]. 食品科技,2016,41(1):219-224.
[12]Maruyama S,Rd C E,Demartino C,et al. Interaction of baboon anti-alpha-galactosyl antibody with pig tissues[J]. American Journal of Pathology,1999,155(5):1635-1649.
[13]Yang X,Li Y,Li S,et al. Effects of ultrasound pretreatment with different frequencies and working modes on the enzymolysis and the structure characterization of rice protein[J]. Ultrasonics Sonochemistry,2017,38:19.
[14]Li S,Yang X,Zhang Y,et al. Effects of ultrasound and ultrasound assisted alkaline pretreatments on the enzymolysis and structural characteristics of rice protein[J]. Ultrasonics Sonochemistry,2016,31:20-28.
[15]周慧江,朱振宝,易建华. 核桃蛋白水解物水解度测定方法比较[J]. 粮食与油脂,2012(2):28-30.
[16]吴琼英,马海乐,骆琳,等. 高效液相色谱法测定血管紧张素转化酶抑制剂的活性[J]. 色谱,2005,23(1):79-81.
[17]杨晓军,陆剑锋,林琳,等. 酶解斑点叉尾鮰内脏制备血管紧张素转化酶抑制产物[J]. 食品科学,2010,31(22):237-241.
[18]Otte J,Shalaby S M,Zakora M,et al. Angiotensin-converting enzyme inhibitory activity of milk protein hydrolysates:Effect of substrate,enzyme and time of hydrolysis[J]. International Dairy Journal,2007,17(5):488-503.
[19]张艳萍,戴志远,张虹. 贻贝蛋白的酶解及其酶解物的抗氧化活性研究[J]. 中国食品学报,2012,12(1):10-18.
[20]姚成虎,王志耕,梅林,等. 胃蛋白酶水解珠蛋白获得ACE抑制肽的工艺优化[J]. 农业工程学报,2008,24(5):284-288.
[21]贾俊强,马海乐,王振斌,等. 降血压肽的构效关系研究[J]. 中国粮油学报,2009,24(5):110-114.
[22]金建,马海乐,曲文娟,等. 超声预处理对玉米蛋白可酶解性的影响[J]. 中国粮油学报,2015,30(11):58-64.
[23]张艳艳. 基于超声预处理的谷朊蛋白ACE抑制肽制备及其过程原位监测技术研究[D]. 镇江:江苏大学,2016.
[24]耿静静. 超声辅助酶法制备燕麦蛋白ACE抑制肽的研究[D]. 镇江:江苏大学,2010.

